ECM/SVF-gel对比Coleman脂肪治疗糖尿病大鼠创面的效果与机制研究
赵文懿,杨中玉,孙晓涵,宋培军,徐 静△
(1.蚌埠医学院第一附属医院整形外科,安徽蚌埠 233000;2.蚌埠医学院组织移植实验室,安徽蚌埠 233000)
脂肪来源干细胞基质胶(ECM/SVF-gel)是一种对脂肪进行简单的物理机械处理后获得的凝胶状物质,制作过程中无外源性物质的添加,同时,含有高浓度的具有生物活性的细胞外基质(extracellular matrix,ECM)和血管基质组分(stromal vascular fraction,SVF)[1]。基于Coleman脂肪的制作过程,ECM/SVF-gel只需在Coleman脂肪的基础上再进行简单的破碎和离心即可获得,其制备过程中的破碎与离心步骤使脂肪组织中的成熟脂肪细胞被最大限度地破坏,从而获得了富含脂肪来源干细胞(adipose derived stem cells,ADSCs)和ECM的混合物质[2-3]。已有研究证实,ECM/SVF-gel可上调组织中生长因子——碱性或纤维生长因子(bFGF)和血管内皮生长因子(VEGF)表达水平,促进大鼠缺血性皮瓣中血管再生[4]。本研究对ECM/SVF-gel与Coleman脂肪治疗糖尿病大鼠创面的疗效进行了对比,并对ECM/SVF-gel的作用机制进行了初步探讨,旨在为临床应用ECM/SVF-gel治疗糖尿病导致的创面提供理论依据。
1 材料与方法
1.1材料
1.1.1动物来源
糖尿病造模选用14只300~350 g的SD大鼠,雄性,8~9周龄;脂肪供体鼠选用5只350~400 g的SD大鼠,雌性,6~8周龄;实验用鼠均购于山东省实验动物中心。实验过程中对动物的处置均符合动物伦理学标准。
1.1.2主要试剂
特级胎牛血清(FBS)购自澳洲CLARK公司,杜氏改良Eagle培养基(DMEM)/F12培养基、高糖DMEM培养基、磷酸盐缓冲液(PBS)均购自美国HyClone公司;4%多聚甲醛、青霉素-链霉素双抗均购自北京Biosharp公司,链脲佐菌素(STZ)、柠檬酸、柠檬酸钠均购自上海Yeason公司,4%多聚甲醛、石蜡、中性树脂均购自北京Solarbio公司;无水乙醇、二甲苯、水合氯醛均购自上海Macklin公司,大鼠表皮细胞生长因子(epidermal growth factor,EGF)、bFGF、VEGF和转化生长因子β1(transforming growth factor-β1,TGF-β1)的酶联免疫吸附试验(ELISA)试剂盒均购自上海酶联生物科技有限公司。
1.1.3仪器及耗材
100、40 μm滤网,0.22 μm滤芯均购自美国Biologix公司,2.4 mm鲁尔连接器购自黑龙江四海医疗,10 mL注射器购自上海KDL公司,超净工作台购自蚌埠新科净化设备厂,手术器械购自河南美邦医疗器械,石蜡包埋机购自孝感宏业医用仪器公司,切片机(RM2245)购自德国LEICA公司,移液枪购自德国Eppendorf公司,高速离心机(Multifuge X1R)、细胞培养箱均购自美国Thermo公司。
1.2方法
1.2.1Coleman脂肪和ECM/SVF-gel的制备
将体重350~400 g的SD大鼠麻醉后脱毛,用聚维酮碘消毒;无菌手术器械取大鼠腹股沟处脂肪,用无菌PBS反复冲洗,去除血液;移入无菌培养皿中,反复用剪刀剪切脂肪组织约3 min;加入适量无菌PBS,672 r/min离心3 min,将位于底层的水及结缔组织去除,位于中层的脂肪组织即为所需的Coleman脂肪。离心去水的脂肪组织按密度大小分为高、低密度脂肪组织,位于离心管中上2/3的组织为低密度脂肪组织,位于下1/3的组织为高密度脂肪组织。以内径为2.4 mm的鲁尔连接器连接2个10 mL注射器,将低密度脂肪组织置入,推注速度保持恒定(10 mL/s),反复推注约2 min,通过机械方式使脂肪乳糜化;推注完成后脂肪呈乳糜状;将高密度脂肪与推注完成后的低密度脂肪混合均匀,置于以内径为2.4 mm的鲁尔连接器连接的2个10 mL注射器中,再次互相推注约30 s后1 120 r/min离心3 min,可见上层有大量的油,底层则可见有少量的水,以上二者皆弃去,离心管中余下的位于油层之下的凝胶样物质即为所需的ECM/SVF-gel[5-6],见图1。
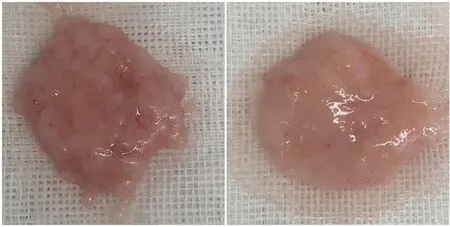
左:Coleman脂肪;右:ECM/SVF-gel;肉眼观察,与Coleman脂肪比较,ECM/SVF-gel质地更加细腻、光滑。
1.2.2生长因子的收集
SVF细胞数以5×105为基线,准备相应质量的ECM/SVF-gel及Coleman脂肪。将计算好相应质量的2种不同的脂肪组织制品分别移入T25培养瓶中,每个培养瓶中各添加5 mL完全培养基(含10% FBS),将培养瓶置于含有5%CO2、37 ℃培养箱中孵育24 h。24 h后为获得条件培养基(conditioned medium,CM)以DMEM/F12培养基(无FBS)将培养瓶中的完全培养基全部替换,培养24 h;24 h后分别收集培养瓶中的上清液,依次通过100、40 μm滤网,去除细胞及组织碎片;收集滤液,168 r/min离心5 min,离心后的上清液通过0.22 μm滤芯过滤除菌;移入冻存管中,置于-20 ℃冰箱储存备用。
1.2.3建立糖尿病大鼠模型
选取体重300~350 g的SD雄性大鼠14只,适应性饲养1周后禁食不禁饮,12 h后按55 mg/kg一次性腹腔注射1%的STZ溶液。注射1周后检测大鼠血糖变化。空腹血糖超过16.8 mmol/L,发生多饮、多尿、多食、体重减轻等即可确定为建模成功。
1.2.4建立大鼠创面模型及条件培养基的干预
取建模成功的糖尿病大鼠(14只)采用戊巴比妥腹腔麻醉,以直径10 mm的组织活检器在大鼠背部制作直径10 mm的全层皮肤缺损创面,每只大鼠2个创面;预先制备直径1 cm的环形硅胶片置于创面,再使用4-0尼龙线缝合4~6针,以防止创周皮肤在早期便严重皱缩,影响观察,见图2。
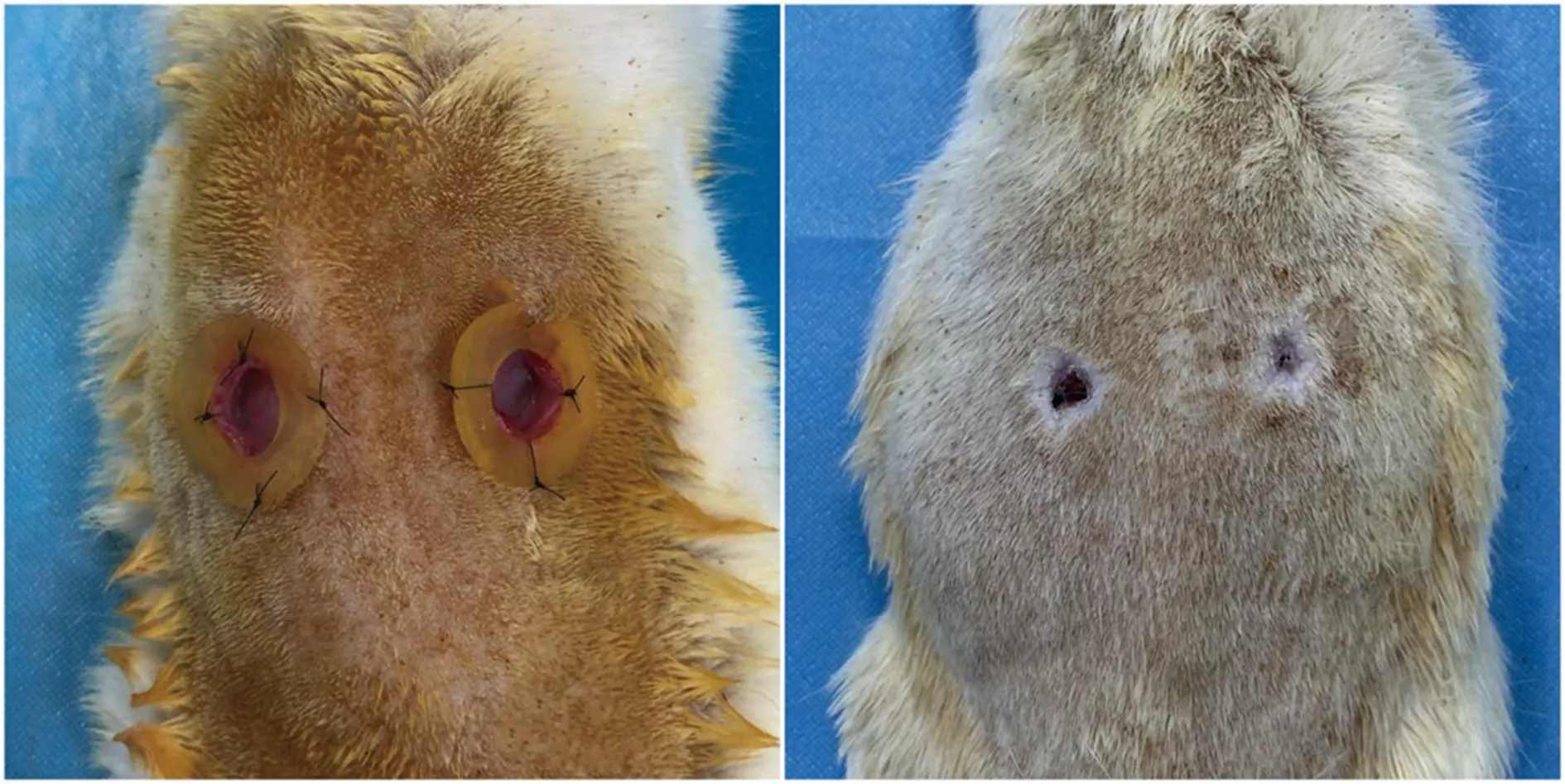
左:术后即刻;右:术后14 d,可见位于右侧的注射ECM/SVF-gel-CM的创面,相比位于左侧的注射Coleman-CM的创面,愈合情况更为良好,已近乎完全愈合。
将14只大鼠分为A组(Coleman-CM)和B组(ECM/SVF-gel-CM),将每只大鼠背部的2个创面按随机法进行随机分配,做好标记,2个创面分别注射A组(Coleman-CM)与B组(ECM/SVF-gel-CM),每个创面注射100 μL,其中20 μL注射在创面基底,80 μL注射在创面周围(4个点,每个点20 μL);注射完毕后以无菌敷贴包裹创面,单笼喂养。术后连续2 d给予青霉素皮下注射,预防感染。
1.2.5观察指标
1.2.5.1大体观察
对14只大鼠术后即刻,3、7 d,以及10只大鼠术后10、14 d进行创面观察和拍照,对比观察创面愈合情况。
1.2.5.2创面愈合率
通过Image J软件测量14只大鼠背部创面术后即刻,3、7 d,以及10只大鼠术后10、14 d创面面积,创面愈合率=(创面初始面积-剩余创面面积)/创面初始面积×100%。
1.2.5.3免疫组织化学染色观察
术后7 d随机挑选4只大鼠处死,术后14 d处死剩余10只大鼠,取创面皮肤组织制作切片,进行CD34免疫组织化学染色,镜下观察新生血管形成情况,阳性染色显示为棕色,通过Image J软件将各组样本的阳性染色结果进行分离,并分析比较各组阳性染色比例。
1.2.5.4生长因子检测
按照ELISA试剂盒的实验步骤,检测2种条件培养基(CMs)中的4种生长因子——EGF、bFGF、VEGF、TGF-β1表达水平。
1.3统计学处理
2 结 果
2.1创面愈合率
B组创面愈合率均明显高于A组,A组术后14 d创面愈合率为(82.04±3.84)%,B组创面愈合率则达到了(95.54±3.57)%,创面基本已全部上皮化。两组术后3、7、10、14 d创面愈合率比较,差异均有统计学意义(P<0.05),见图3、表1。

图3 两组糖尿病鼠的创面各个时间点的代表照片
表1 不同时间点各组创面愈合率比较
2.2CD34免疫组织化学染色结果
两组术后7 d创面内均出现了新生血管,B组阳性染色比例为19.304%,A组为14.276%,B组新生血管生成较A组多;两组术后14 d新生血管数量均有不同程度增长,B组阳性染色比例为32.726%,A组为26.155%,B组术后7、14 d新生血管生成均较A组多,差异有统计学意义(P<0.05),见图4。
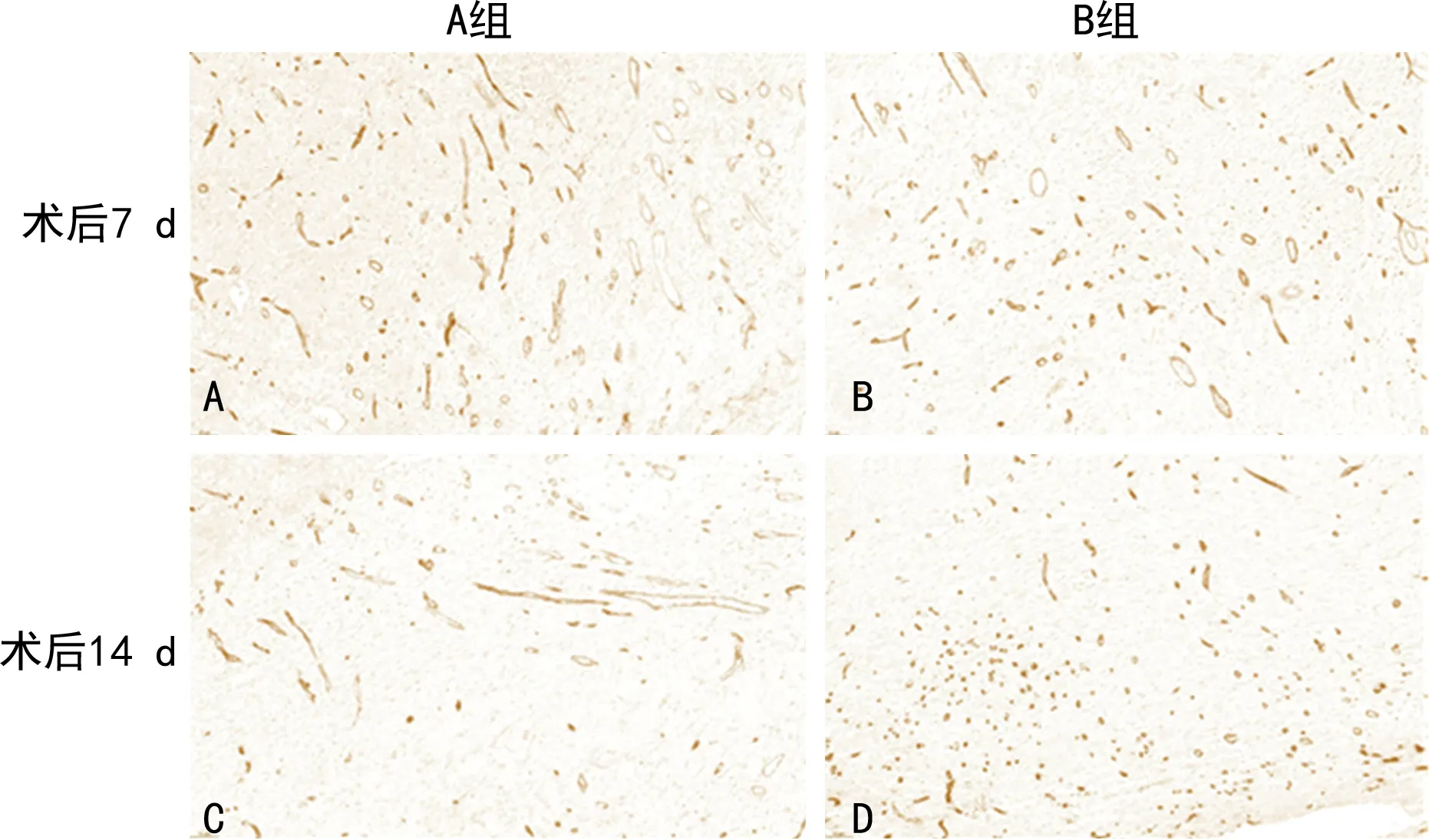
图4 创面组织CD34免疫组织化学染色图(×20)
2.3生长因子表达水平
A组EGF、bFGF、VEGF、TGF-β1表达水平均低于B组。其中EGF、bFGF、VEGF表达水平比较,差异均有统计学意义(P<0.05);TGF-β1表达水平比较,差异无统计学意义(P>0.05),见表2。
表2 ELISA检测2组CMs中生长因子水平
3 讨 论
以Coleman脂肪的制作过程为基础,ECM/SVF-gel是在经过后续的机械破碎和离心后获得的含有高度浓缩的、具生物活性且近似于生理状态下的ECM、SVF和ADSCs的凝胶状的可注射材料,相比于含有相同SVF细胞数的Coleman脂肪,ECM/SVF-gel中浓缩的ECM(胶原蛋白、纤维蛋白和弹性蛋白等)更多,从而起到了为ADSCs提供适宜生存的微环境的作用,同时,通过调节细胞行为,促进细胞增殖,激活细胞的分化潜能,促进更多的生长因子分泌,并免于巨噬细胞的吞噬[1-3]。
在本研究进行ELISA检测的4种生长因子中,EGF可促进上皮细胞、成纤维细胞增殖;bFGF可促进血管生成;VEGF可促进血管内皮细胞迁移、增殖,并促进新生血管形成;TGF-β1在促进各类ECM(如胶原蛋白、纤粘连蛋白等)表达的同时,也能够抑制降解[7-11]。
本研究应用的条件培养基(CM)本质即为干细胞的旁分泌产物,其中包括各种生长因子、免疫因子和外泌体。经检测上述4种生长因子在Coleman-CM和ECM/SVF-gel-CM中均有不同程度的表达,ECM/SVF-gel-CM中EGF、bFGF、VEGF水平均明显高于Coleman-CM,差异均有统计学意义(P<0.05),证实了相较于Coleman脂肪,ECM/SVF-gel能分泌更多的生长因子——EGF、bFGF和VEGF,并以旁分泌的途径作用于创面;虽然ECM/SVF-gel-CM中TGF-β1水平仍高于Coleman-CM,但差异无统计学意义(P>0.05);造成该生长因子水平差异无统计学意义的原因可能为检测时样品在低温冷冻中储存时间过长,造成了一定数量的生长因子失活或是多次检测过程中反复的冷冻和复苏导致样品中生长因子的失活[12]。
本研究将等量的2种CM分别注射至糖尿病大鼠背部创面,B组术后3、7、10、14 d创面愈合率均明显高于A组,差异均有统计学意义(P<0.05);A组术后14 d,创面愈合率为(82.04±3.84)%,B组创面愈合率则达到了(95.54±3.57)%,差异有统计学意义(P<0.05),符合ELISA检测的结果。同时,CD34免疫组织化学染色结果显示,与A组比较,B组术后7、14 d阳性染色结果更多,即B组新生血管数量在术后7、14 d均比A组更多,同样符合ELISA检测的结果。
综上所述,与Coleman脂肪比较,ECM/SVF-gel促进糖尿病大鼠创面愈合的效果更突出,其作用机制为通过旁分泌途径分泌更高浓度的生长因子(EGF、bFGF、VEGF等)作用于创面,促进创面部位生成新生血管,加速创面愈合;ECM/SVF-gel作为一种经机械破碎、浓缩自Coleman脂肪的制品具有局部注射用于修复慢性创面的潜力,为今后临床应用ECM/SVF-gel治疗各类创面,尤其是糖尿病患者肢体创面等难愈性创面提供了新的思路。

