明胶基高内相乳液在辣椒素负载中的应用
张榉,杜杰,王洪霞,冯鑫,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学,生物学研究中心,重庆,400715)
辣椒素(capsaicin,CAP)是辣椒中呈现辣味的主要成分之一,本身不提供能量。近年来的研究证实辣椒素具有控制血压、调节血脂、抑制脂肪堆积、镇痛等多种功能,从而具有控制体重、改善由肥胖引起的糖耐受量受损及慢性疼痛等慢性疾病调理方面的应用前景[1]。然而辣椒素的摄入会对机体产生强烈的灼烧感,对鼻腔、食道及胃肠道黏膜造成刺激[2],极大地限制了辣椒素在食品领域的应用。此外,辣椒素的低水溶性导致其在水介质中难以扩散,胃肠消化中生物可及性低。因此降低其对机体的刺激性、提高辣椒素的生物可及性对辣椒素的应用具有重要意义。利用O/W型乳液对脂溶性生物活性成分进行包埋是活性成分保护和提高其生物利用率的有效途径[3]。
本课题组前期的研究表明可以通过谷氨酰胺转氨酶(transglutaminase,TG)改性明胶制备具有高热稳定性和良好贮存稳定性的高内相乳液(high internal phase emulsions,HIPEs)[4]。本研究在前期研究基础上,将辣椒素溶解于大豆油中,制备负载辣椒素的明胶基HIPEs,探究负载辣椒素的明胶基HIPEs的外观、微观结构及流变学特性,并研究了HIPEs包埋及TG酶交联时间对辣椒素气味的掩盖作用。进一步通过动态体外胃消化和静态体外消化模拟实验研究了辣椒素在HIPEs中的释放特性和生物可及性等,旨在为降低辣椒素刺激性并提高其生物可及性提供理论指导,并为明胶基HIPEs的应用提供理论基础。
1 材料与方法
1.1 原料与试剂
A型明胶(来源于猪皮),美国Sigma-Aldrich公司;大豆油(购于重庆市永辉超市,未经纯化),九三集团;TG酶(标称酶活200 IU),上海Foodchem化工有限公司;胃蛋白酶(1∶10 000),德国BioFroxx生物试剂;脂肪酶(1∶100 000),上海Macklin生化科技有限公司;辣椒素,上海笛柏生物科技有限公司;胆盐,上海生工生物工程股份有限公司;无水乙醇,重庆市钛新化工有限公司;氢氧化钠、盐酸,成都市科隆化学品有限公司。所有试剂均为分析纯。
1.2 仪器与设备
JA 3003B电子天平,上海精天电子仪器有限公司;QL 901 Vortex涡旋混合器,海门市其林贝尔仪器制造有限公司;HH-4数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;PE 20实验室酸度计,上海梅特勒-托利多仪器有限公司;Heraeus Multifuge X3R台式高速冷冻离心机,美国赛默飞世尔科技公司;BX 53 正置荧光电子显微镜,日本OLYMPUS公司;T 18 高速分散器,美国IKA公司;MCR 302流变仪,澳大利亚ANTON PAAR公司;KQ-100B超声波清洗器,昆山超声仪器有限公司;UltiMate 3000高效液相色谱仪,赛默飞世尔科技有限公司;DHSI-Ⅳ动态仿生消化仪,苏州晓东宜健仪器设备有限公司。
1.3 实验方法
1.3.1 负载辣椒素的HIPEs的制备
将A型猪皮明胶加入去离子水中,在25 ℃下溶胀1 h后在60 ℃下搅拌孵育30 min。冷却至室温后用0.5 mol/L的NaOH调节pH至6.0。将提前预热至45 ℃的TG酶溶液(2 mg/mL)添加到明胶溶液中,TG酶与明胶的质量比为0.002∶1,使体系中明胶质量分数为2%。在45 ℃下分别水浴0、1、2、4 h后,沸水浴处理10 min灭酶。最后使用0.5 mol/L HCl将混合物的pH值调节至5.0。以溶解有辣椒素的大豆油为油相,制备负载辣椒素的明胶基HIPEs,置于4 ℃冰箱中备用。根据不同TG酶交联时间(0~4 h),负载辣椒素的明胶基HIPEs样品编码为GT0-CAP、GT1-CAP、GT2-CAP和GT4-CAP,未负载辣椒素的明胶基HIPEs样品编码为GT0、GT1、GT2和GT4,溶解有相同辣椒素含量的大豆油编码为free-CAP。
1.3.2 辣椒素标准曲线的制备
参考GB/T 21266—2007《辣椒及辣椒制品中辣椒素类物质测定方法》及高艳[5]测定辣椒素的方法对本实验样品中的辣椒素含量进行测定。以峰面积为纵坐标,辣椒素标准物质浓度为横坐标绘制标准曲线,计算得到标准曲线公式y=0.200 7x+0.005,R2=0.999 9。
辣椒素浓度的计算方法见公式(1):
(1)
式中:W为样品中辣椒素含量,mg/mL;C为标准曲线中查到的辣椒素含量,μg/mL;50为稀释倍数。
1.3.3 乳液的外观及微观结构
观察并拍摄乳液的外观图像,从宏观相行为角度评估乳液形成好坏程度。将乳液滴在载玻片上,盖上盖玻片,使用正置荧光光学显微镜(BX53,OLYMPUS)观察和拍摄HIPEs的微观结构。
1.3.4 流变学行为测定
使用流变仪对乳液进行流变学测量。在所有实验中均使用钢板(直径25 mm,间隙1 mm),频率为1 Hz,温度为25 ℃。稳态剪切测试:固定温度为25 ℃,在0.1~100 s-1的剪切速率下进行稳态剪切测试以获得HIPEs的黏度变化曲线。频率扫描测试:设置温度恒定为25 ℃,应变值恒定为0.5%,在0.1~100 rad/s的角频率范围内对HIPEs进行小振幅振荡频率扫描测试。
1.3.5 电子鼻测定
参照李颖慧等[6]的方法,取free-CAP(7.5 mL)和辣椒素HIPEs(10 mL)于30 mL进样瓶中,在25 ℃下平衡30 min后测试,测试流速为1 mL/min,清洗和测试时间均为60 s。每个样品重复测定4次,使用电子鼻设备自带的软件enose进行数据分析,包括主成分分析(principal component analysis,PCA)和线性判别分析(linear discriminant analysis,LDA)。
1.3.6 动态体外胃消化模拟模型及相关指标的测定
参考体内消化的相关实验数据对动态体外胃消化模拟模型参数进行设置,相关仪器运行参数如下:
实验温度为37 ℃。模拟胃液的配方参考静态体外消化实验中使用的胃模拟液,胃蛋白酶于实验开始前加入,即配即用。消化过程中的其他参数如表1所示。消化过程中每30 min收集一次消化样品,立即测定其pH值,记录消化过程中胃糜样品的pH值变化情况。同时记录每次消化样品的重量以得到胃排空曲线,计算消化过程中排出的样品占用样品初始总质量的比值,得到胃内剩余样品的占比,计算公式见公式(2):

表1 动态仿生消化设备运行参数Table 1 Operating parameters of dynamic bionic digestion equipment
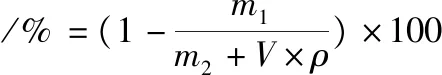
(2)
式中:m1表示累计排出的胃糜液体的质量,g;m2表示用于动态体外消化的样品总质量,g;V表示取样时累计加入的消化液的体积,mL;ρ表示消化液的密度,g/mL。
参照1.3.2中的方法测定释放至消化液中的辣椒素含量。
1.3.7 静态体外消化模拟模型
参照WINUPRASITH等[7]的方法配制模拟胃肠液:模拟胃液(simulated gastric fluid,SGF)pH 2.0,模拟肠液(simulated intestinal fluid,SIF)pH 7.0。
胃消化阶段:将4 mL辣椒素HIPEs与16 mL SGF混合在一起,将混合体系pH调节至2.0后加入胃蛋白酶(3.2 mg/mL),在恒温水浴摇床中以100 r/min的转速连续旋转2 h。肠消化阶段:将胃消化后的样品pH调至7.0结束胃消化。加入6.0 mL SIF和14 mL 胆汁盐(5.0 mg/mL),调节体系pH至7.0,5 min 后加入脂肪酶(1.6 mg/mL),使用磁力搅拌以100 r/min的转速模拟肠道蠕动。肠消化期间持续监测体系pH,每隔5 min使用0.15 mol/L的NaOH溶液调节体系pH,使pH维持在7.0,并记录消耗的NaOH的体积持续3 h。整个胃、肠消化阶段体系温度保持在37 ℃。
1.3.8 脂质消化的测定
脂质消化测定方法参考BELLESI等[8]的方法。通过肠消化阶段中所用的NaOH溶液量计算得到从乳液中释放出的游离脂肪酸含量(free fatty acid,FFA),计算方法见公式(3):
(3)
式中:CNaOH为使用的NaOH溶液的摩尔浓度,mol/L;VNaOH为消耗的NaOH溶液的体积,mL;Mw为该油的平均摩尔量,880 g/mol;m为HIPEs中大豆油的总质量,g。
1.3.9 辣椒素生物可及性测定
参考古成[9]的方法测定辣椒素的生物可及性。将消化后的混合物在4 ℃下10 000 r/min离心30 min,中间的清液层为混合胶束相。一般认为经过消化后溶解于混合胶束相的辣椒素可以穿过黏液层输送到上皮细胞,因此测定混合胶束相中的辣椒素含量可用于分析辣椒素的生物可及性,计算方法见公式(4):
生物可及性/%
(4)
1.4 数据处理
使用统计软件IBM SPSS 19.0进行分析数据,Origin 9.0用于绘制图形。每次实验至少独立进行3次,数据以平均值±标准偏差的形式表示,同时采用Duncan检验结果分析数据之间的差异(P<0.05则数据间存在显著性差异)。
2 结果与分析
2.1 负载辣椒素的明胶基HIPEs的外观和微观图像分析
前期研究已经证明,2%的明胶微凝胶制备的油相为75%的HIPEs较为稳定[4]。由图1可观察到负载了辣椒素的明胶基HIPEs仍旧具有较高的黏度,倒置时保持在玻璃瓶底部而不流动。由光镜图可知,乳液的液滴尺寸分布均一,与未负载辣椒素的明胶基HIPEs对比,3 mg/mL辣椒素的荷载对HIPEs的粒径略有降低,这可能是因为辣椒素的添加使更多的明胶在界面排布,进一步减小了液滴尺寸。还可观察到TG酶交联时间对乳液液滴尺寸无明显影响。

a~c-负载;d-未负载图1 负载与未负载辣椒素明胶基HIPEs的外观和微观图像Fig.1 Appearance and microscopic images of gelatin-based HIPEs loadedand unloadedcapsaicin
2.2 负载辣椒素的明胶基HIPEs的流变学行为分析
由图2可以看到,明胶基HIPEs的黏度随着剪切速率的升高逐渐降低,呈现出剪切变稀的特征,属于非牛顿流体。辣椒素的添加及TG酶交联时间对明胶基HIPEs黏度没有明显影响,与宏观观察的结果一致,可能的原因是油相含量高(>74%),而明胶连续相(<26%)、辣椒素(3 mg/mL)的占比相对较低,因此TG酶、辣椒素对乳液黏度的影响可以忽略不计。

a-交联时间为0 h;b-交联时间为1 h;c-交联时间为2 h;d-交联时间为4 h图2 负载与未负载辣椒素的明胶基HIPEs的黏度变化曲线Fig.2 Viscosity of gelatin based HIPEs loaded and unloaded with capsaicin
图3展示了HIPEs的模量随角频率变化的曲线,G′基本高于G″,表明HIPEs具有较强的网络结构,体系由弹性结构主导,频率依赖性变化较小。由图3可知,TG酶交联提升了乳液的模量,因为TG酶交联增加了明胶链的长度,水相明胶分子链缠结增加,从而明显增强了乳液网络结构;当负载辣椒素后,辣椒素中含有羟基等活性基团,可能与明胶存在相互作用,导致吸附至界面的明胶增加,连续相中明胶含量减少,因此负载辣椒素的未交联乳液表现出更低的模量;对比负载辣椒素的未交联乳液模量和负载辣椒素的交联乳液模量,可以发现随着交联度的增加,乳液的模量与未负载辣椒素的乳液模量逐渐接近,这可能是因为交联可能使界面明胶由胶体软颗粒转变为连续的胶体层,从而限制了更多连续相中明胶向界面迁移,从而增加了负载辣椒素的交联乳液的模量。整体上,明胶基辣椒素HIPEs仍旧表现为具有弹性主导的高黏弹性体系,GT1-CAP、GT2-CAP和GT4-CAP表现出较低的频率依赖性。
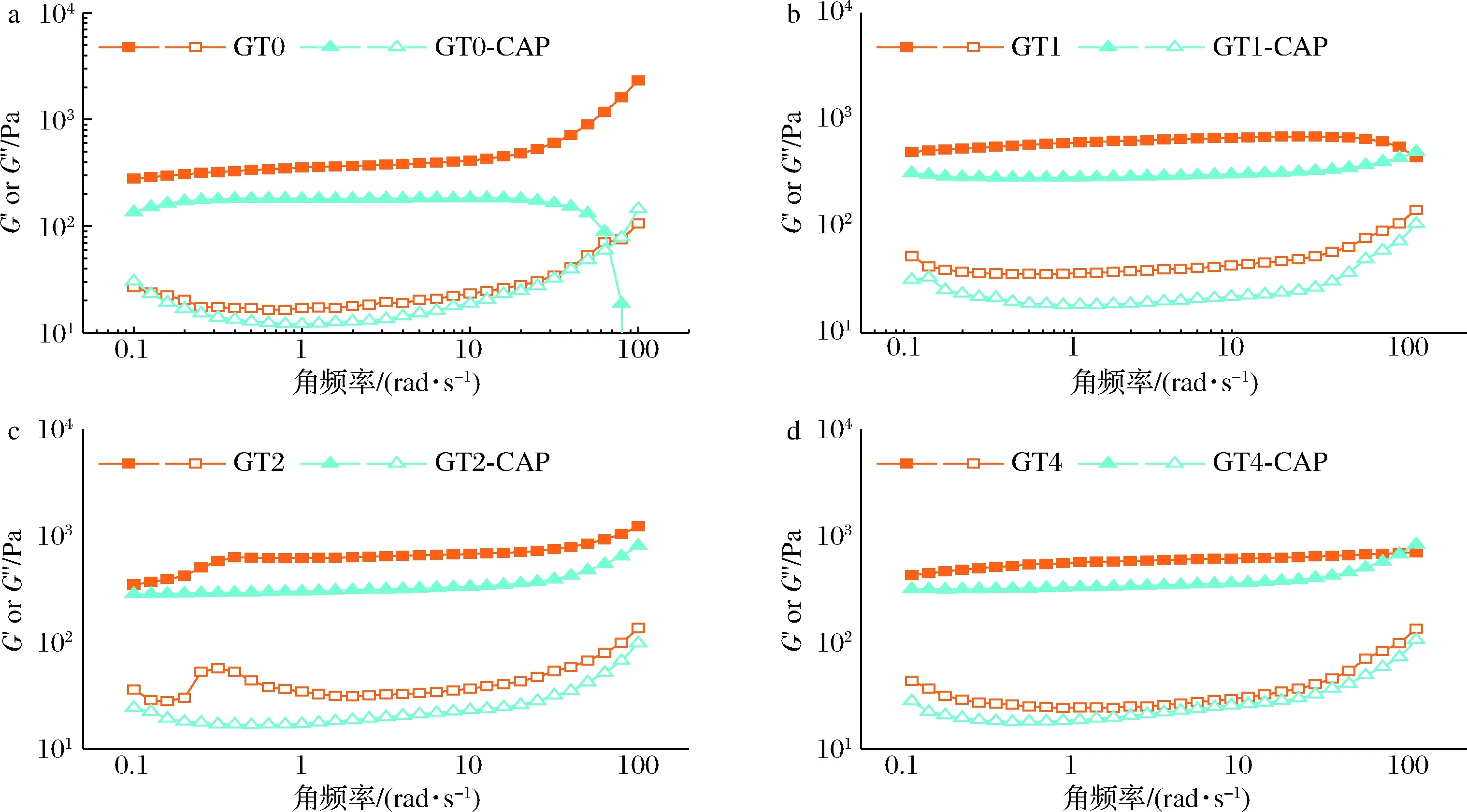
a-交联时间为0 h;b-交联时间为1 h;c-交联时间为2 h;d-交联时间为4 h图3 负载与未负载辣椒素的明胶基HIPEs的模量随角频率(0.1~100 rad/s)的变化曲线(G′为实心符号曲线,G″为空心符号曲线)Fig.3 The modulus of gelatin based HIPEs loaded and unloaded with capsaicin varies with angular frequency (0.1-100 rad/s)
2.3 电子鼻分析
电子鼻是一种快速检测样品中挥发性成分的新型人鼻模拟仿生气味扫描仪,具有快速、客观、重现性好、便捷等优点,现已广泛用于食品的分析检测[10]。图4展示了分别使用PCA和LDA分析的结果,第一主成分和第二主成分的累积贡献率大于92%,基本可以代表样品的主要气味信息。图4中每个三角形分别代表不同样品的数据采集点,三角形在图中的距离远近代表样品间的气味差异大小[11]。由图4-a可知,GT0-CAP和GT1-CAP存在部分重叠,说明这2组样品间气味相似,同样的情况也出现在GT2-CAP和GT4-CAP之间,但乳液组与溶解有辣椒素的游离大豆油组(free-CAP)相互独立,说明使用明胶基HIPEs包埋后的辣椒素气味与溶解在大豆油中的游离辣椒素有明显差异。由图4-b可知,与PCA相比,LDA得到的结果更加集中,对不同的样品分类更明显,这样的现象在先前的研究中也有出现[6]。由于第一主成分的贡献率大于99%,样品间的差异主要体现在横轴方向上的距离大小[12]。值得注意的是,随着TG酶交联时间的延长,辣椒素HIPEs的气味与游离辣椒素的气味之间的差别逐渐增大,GT4-CAP与free-CAP的差距最大。这可能是因为TG酶催化的靶向共价交联导致连续相结构更紧密,对内部油滴中荷载的辣椒素气味的封闭效果更好。通过比较样品间的距离可发现,HIPEs包埋对辣椒素的气味有明显的掩盖作用,且交联时间的延长有利于形成更紧密的连续相结构,从而对辣椒素的气味进行更好地掩盖,这为辣椒素的应用模式提供了依据。

a-PCA图;b-LDA图图4 溶解在大豆油中的游离辣椒素(free-CAP)和具有不同TG酶交联时间(0~4 h)的明胶基辣椒素HIPEs的电子鼻分析Fig.4 Electronic nose analysis of free capsaicin (free-CAP) and capsaicin-loaded HIPEs stabilized by gelatin with different TG crosslinking time (0~4 h)
2.4 辣椒素的动态胃消化分析
辣椒素对胃的灼伤作用限制了其在医疗、食品等方向的应用,降低和减缓辣椒素在胃中的释放有利于保护胃黏膜免受辣椒素的灼伤。已有研究表明,微胶囊和乳液等包埋手段可以有效减缓辣椒素的释放,减轻辣椒素对小鼠胃黏膜的刺激作用[13-14]。为进一步探究明胶基辣椒素HIPEs在胃消化过程中其微观结构的变化情况及其对辣椒素的缓释作用,采用动态仿生胃消化仪器进行了动态体外胃消化研究,设备具体示意图如图5-a所示。
消化过程中胃内食糜的pH值根据所摄取食物的量和食物本身的缓冲能力而变化[15],胃排空和胃液分泌将有助于消化过程中胃内食糜pH值的持续降低[16]。如图5-b所示,食物的摄入导致前期(0~30 min)胃中的pH值从2.0上升至3.5左右,这与摄入食物的稀释作用有关。随着胃排空作用和胃液的持续分泌,胃中pH值逐渐下降,到消化终止时恢复至禁食状态(pH 2.0左右),与先前的研究结果基本一致[17]。
动态胃消化过程胃内剩余样品质量随时间的变化曲线如图5-c所示。各组样品均在消化60 min内完成半数排空,胃消化的前30 min,大豆油的排空速度最快,随着消化的进行,各组样品的排空速率逐渐降低,总体排空趋势相似。在消化终止时,胃内剩余量均低于20%,基本符合先前报道的体内排空曲线[18]。胃内食糜pH变化曲线和胃内剩余量变化曲线符合已报道的体内变化规律,说明在本实验设置的运动参数下,DHSI-IV动态仿生胃系统能够较为准确地模拟动态胃消化过程。
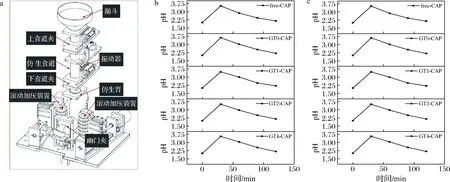
a-动态仿生胃设备示意图;b-动态胃消化过程中胃内食糜pH值随时间的变化曲线;c-动态胃消化过程中胃内剩余量曲线图5 动态仿生胃设备示意图、动态胃消化过程中胃内食糜pH值随时间的变化曲线和动态胃消化过程中胃内剩余量曲线Fig.5 Schematic diagram of dynamic bionic stomach equipment,variation curve of pH value of gastric chyme with time during dynamic gastric digestion and gastric retention curve during dynamic gastric digestion
由图6-a可以看到,直接溶解于大豆油中的辣椒素在胃消化前期大量释放,而包埋于明胶基HIPEs中的辣椒素在胃消化过程中的释放率显著降低,这可能是因为直接溶于大豆油中的辣椒素缺乏乳液结构中外层蛋白的保护,从而在动态胃消化过程中的模拟胃蠕动下更易释放至消化液中;同时HIPEs的高黏度也限制了胃蛋白酶的扩散和液滴中辣椒素的扩散速率。另外,TG酶交联后的明胶稳定的辣椒素HIPEs对辣椒素的缓释作用显著优于未交联明胶稳定的HIPEs,这避免了辣椒素在胃中的突释,对保护胃黏膜免受辣椒素刺激、促进辣椒素的应用有重要意义,与GUO等[19]的研究结果一致。
胃消化过程中,由于部分界面蛋白被胃蛋白酶水解,内部油滴泄露,在仿生胃的蠕动下液滴碰撞,泄露的油滴聚结在一起形成大的油滴[20],从而导致乳液的失稳。动态体外消化过程中不同时间下样品的外观和微观结构图像如图6-b所示。可以发现,胃消化30 min后,各组样品的微观和外观无明显变化,仅GT0-CAP的液滴间距离增大,这可能与连续相蛋白被部分降解及消化液的稀释作用有关。主要的差异体现在胃消化60 min后,各组样品均出现了不同程度的液滴聚结,同时伴有大油滴的产生,GT0-CAP液滴聚结程度最高。辣椒素的释放曲线也显示胃消化60 min后,GT0-CAP的释放率明显高于其余3组。从排出的食糜外观照片可以看到,在消化后期(90~120 min),由于胃排空作用,大部分乳液被排出,胃内剩余的乳液较少,排出的食糜大部分为消化液。因此在光学显微镜下观察到的液滴较少,GT4-CAP的液滴仍保持相对较小的状态。这可能是因为TG酶交联通过催化明胶中的靶向共价交联促进了紧密明胶共价骨架网络的形成,在胃消化过程中其稳定结构形成的空间位阻和更大的黏度阻碍了胃蛋白酶在界面的吸附,从而有效保护乳液液滴不被胃蛋白酶破坏,进一步阻碍了辣椒素在胃中的释放。
2.5 明胶基辣椒素HPIEs体外脂质消化分析
为进一步研究辣椒素在肠道内的消化吸收情况,通过静态体外消化模拟实验对明胶基辣椒素HIPEs的脂质消化过程进行分析。脂质在肠道中被脂肪酶水解为FFA,因此常采用FFA的释放描述脂质的消化情况,图6-c展示了样品在消化过程中的FFA释放曲线。由图6-c可以看到,FFA释放发生在肠消化的整个阶段,且随着消化时间的延长,FFA释放量逐渐增加。经过3 h的肠阶段模拟消化后,含有辣椒素的游离大豆油的FFA释放速率和释放量最高(40.4%),乳液样品中GT0-CAP的FFA释放量最高,为29.12%,并且随着TG酶交联时间的延长,FFA释放速率降低,最终释放量也逐渐降低。原因可能是游离大豆油缺乏外层蛋白的保护,在胆盐的乳化作用下更易与脂肪酶接触,从而表现出更高的FFA释放率。而在乳液体系中胆盐需要先取代界面蛋白,脂肪酶才能进一步与内部的油滴接触,在界面蛋白的保护下,内部的油滴更难被水解,从而表现出比游离大豆油更低的FFA释放率[8]。TG酶催化的靶向共价交联促进了HIPEs连续相形成更致密的三维网络结构,延缓了胆盐取代界面蛋白的速率,阻碍了内部油滴与脂肪酶的接触,从而降低了HIPEs中FFA的释放速率和释放量[21]。此外,从整体分析,无论是HIPEs还是游离的大豆油,其脂质消化程度都较低,这与大豆油中较高的长链脂肪酸含量有关,类似的结果在其他长链油(如玉米油)的脂质消化实验中也有报道[22]。
2.6 辣椒素生物可及性分析
先前的研究已证实,与直接将活性成分溶解在游离的油中相比,使用乳液荷载可更有效地提高活性成分的生物可及性[23]。如图6-d所示,直接溶解在大豆油中的辣椒素的生物可及性最低(30.48%),包埋在乳液体系中的辣椒素的生物可及性显著升高(P<0.05)。一般认为,活性成分从油相中的释放与脂肪的水解密切相关,然而具有最高FFA释放率的游离大豆油在生物可及性测定中却表现出最低的生物可及性。同时乳液体系中,FFA释放率随TG酶交联时间的延长而降低,但是其负载的辣椒素生物可及性却并未如预期一样逐渐降低,反而是GT0-CAP表现出最低的生物可及性。这可能归因于TG酶交联形成的高弹性乳液具有紧密的网络结构,减少了释放油滴在消化过程中的聚集,从而增加了辣椒素在胶束相的保留量[24],但是该改善作用与TG酶交联时间无相关性。冯鑫[24]在由明胶纳米颗粒稳定的乳液对β-胡萝卜素的包埋释放研究中也发现了类似的生物可及性与FFA释放率不一致的现象。TAN等[25]认为生物可及性与FFA释放率的不一致的原因可能是残留在体系中的明胶在胶束化过程中作为乳化剂促进了活性成分的胶束化,从而提高其生物可及性。
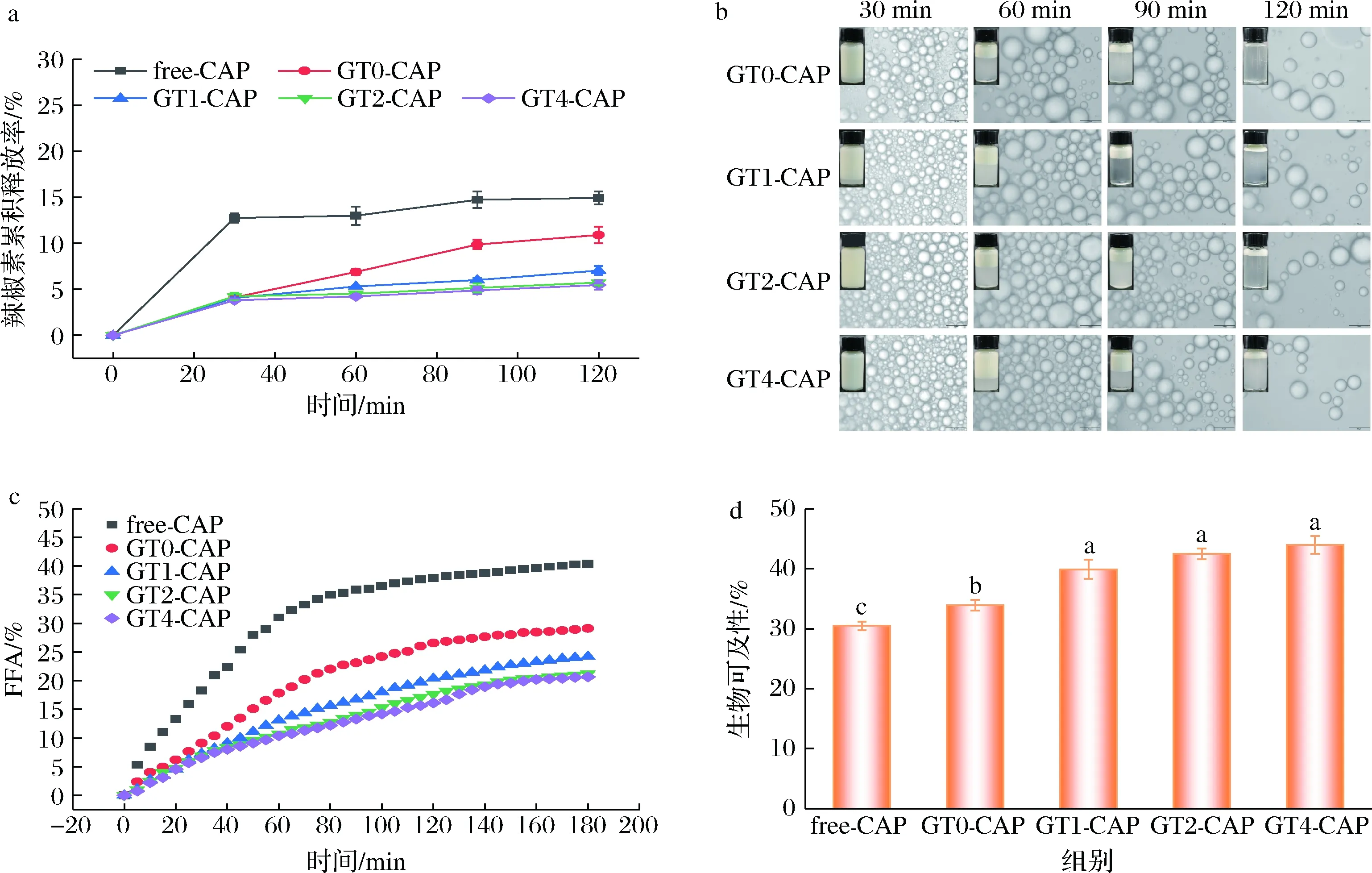
a-辣椒素的释放率;b-乳液外观和微观图像;c-FFA释放曲线;d-生物可及性图6 动态胃消化过程中辣椒素的释放率、乳液外观和微观图像、负载辣椒素的大豆油与具有不同TG酶交联时间的明胶基辣椒素HIPEs的FFA释放曲线和辣椒素的生物可及性Fig.6 Release rate of capsaicin and the appearance and microscopic images of the emulsion during dynamic stomach digestion,FFA release curve of capsaicin-loaded soybean oil and capsaicin-loaded HIPEs stabilized by gelatin with different TG crosslinking time and bioavailability of capsaicin 注:图6-d中不同小写字母表示差异显著(P<0.05)
3 结论
(1)明胶基HIPEs在负载辣椒素后乳液外观、液滴分布和尺寸没有明显变化;辣椒素的负载轻微降低了明胶基HIPEs的模量,但对黏度及频率依赖性没有明显影响,明胶基HIPEs仍表现为具有高黏度和较低频率依赖性的弹性结构主导体系。
(2)明胶基HIPEs包埋对辣椒素的气味有明显的掩盖作用而且可显著降低辣椒素在胃中的释放量,TG酶交联增强了HIPEs对辣椒素气味的掩盖作用,且可更好地防止辣椒素在胃中的突释。
(3)与未交联明胶稳定的HIPEs相比,TG酶交联明胶稳定的HIPEs具有更致密的三维网络结构,降低了胆盐对界面蛋白的取代速率,阻碍了脂肪酶与油滴的接触,从而降低了乳液体系中大豆油的脂质消化率。另一方面,更强的凝胶结构和更稳定的三维网络结构减缓了液滴聚结,增加了辣椒素在胶束相中的保留率,从而使得辣椒素的生物利用率提高。

