维生素C对镉负荷小鼠睾丸抗氧化功能的影响*
周 健,秦 浩,李晓红△,王永辉
(1.潍坊医学院公共卫生学院,山东潍坊 261053;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050)
重金属镉(cadmium,Cd)作为一种环境污染物,对人类和动物健康都构成威胁。在环境暴露人群中,吸烟者是暴露最严重的对象;不吸烟者通过饮食摄入受污染的食物和水而暴露于镉[1]。近几年,有研究报道,镉对生殖系统有一定的影响,镉暴露可导致睾丸组织损伤,严重可导致不育症发生[2]。镉致生殖系统损伤能影响人类繁衍,所以对其损伤的保护是研究的一个热点。镉生殖毒性是由多种机制介导的,其中之一是对睾丸细胞的氧化应激[1]。
维生素C(vitamin C,VC)是生活中常见的一种强抗氧化剂。波兰Gren Agnieszka等学者[3]曾进行过VC对镉染毒后小鼠肝、肾和脑的研究,结果显示单次高剂量镉比慢性低剂量镉具有显著的毒性效应,VC可减轻镉的应激效应。本研究染毒镉剂量和VC保护用量与其不同,且单次和重复染毒采用相同的剂量,而且目前镉剂量与睾丸损伤强度之间的关系,以及镉对睾丸损伤过程的机制尚不清楚。因此,本研究进行单次和重复染毒实验,观察睾丸的氧化损伤及VC保护作用,期望能够为人群防治镉暴露对生殖系统的不利影响提供理论依据,也为人们在日常生活中预防镉危害提供参考。
1 材料与方法
1.1 主要试剂与仪器
分析纯氯化镉(北京化工厂);维生素C(华中药业股份有限公司);丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、微量还原型谷胱甘肽试剂盒、总谷胱甘肽(T-GSH)试剂盒(南京建成生物工程研究所)。multiskan FC型酶标仪(美国赛默飞世尔仪器有限公司);分光光度计、紫外分光光度计(上海元析仪器有限公司);3-18K低温离心机(德国SIGMA公司)。
1.2 实验动物与分组
健康清洁级雄性昆明小鼠72只,6~7周龄,体重(34±2)g,购自青岛动物实验中心,生产许可证号为SCXK(鲁)20140007。饲养环境安静,通风良好,没有已知污染物影响,自由摄食和饮水。72只小鼠随机分为4组,对照组(Con)、氯化镉(CdCl2)组、维生素C(VC)组、维生素C+氯化镉(VC+CdCl2)组,分别灌胃+腹腔注射双蒸水、灌胃双蒸水+腹腔注射CdCl2、灌胃VC+腹腔注射双蒸水、灌胃VC+腹腔注射CdCl2。在前期实验的基础上采用CdCl23 mg/kg腹腔注射染毒,VC 200 mg/kg灌胃进行保护,经过适应性喂养3 d后,每日染毒1次,染毒1 d和3 d及同时补充VC保护。每日同时间段进行体重称量记录和染毒操作。染毒期间小鼠自由进食,饮水。
1.3 样本制备
第1日和第3日染毒24 h后取9只小鼠(8 h前已禁食),称重并记录,摘眼球取血并收集血液,待凝固后4℃离心取上清液,保存于-20℃冰箱备用。处死小鼠后,取出睾丸,用生理盐水漂洗,滤纸吸干称重并记录,然后剪碎,放入玻璃匀浆器中,于4℃的低温低速离心机离心10 min后取上清。
1.4 小鼠体重及脏器系数的测定
第1日和第3日染毒24 h后,各组小鼠称重,处死后取双侧睾丸称重,计算睾丸脏器系数。公式:睾丸脏器系数=(睾丸重量/体重)×100。
1.5 指标检测
依据试剂盒说明书测定血清SOD、MDA水平,睾丸组织SOD、MDA、GSH、GSSG、GSH-Px、T-GSH水平。
1.6 统计学处理
2 结果
2.1 小鼠体重和脏器系数变化
结果显示,Con与VC组近似,无显著性差异;镉负荷第1日与第3日小鼠体重与睾丸脏器系数都低于Con,VC处理后减轻的程度有所降低(表1)。
Tab.1 Effects of Cd on the body weight and testicular coefficient of mice in each group(±s,n=9)
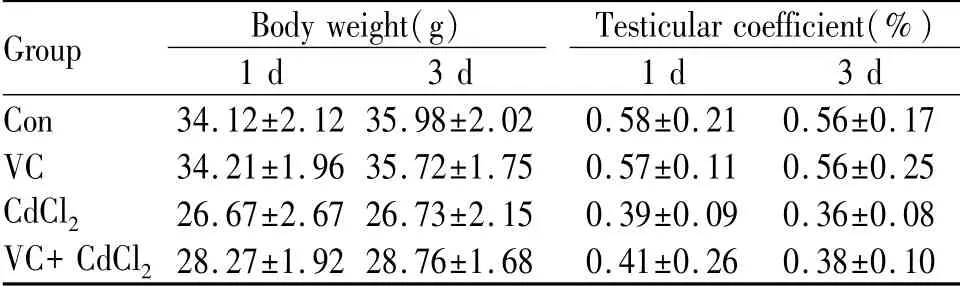
Tab.1 Effects of Cd on the body weight and testicular coefficient of mice in each group(±s,n=9)
Group Body weight(g)1 d 3 d Testicular coefficient(%)1 d 3 d Con 34.12±2.12 35.98±2.02 0.58±0.21 0.56±0.17 VC 34.21±1.96 35.72±1.75 0.57±0.11 0.56±0.25 CdCl2 26.67±2.67 26.73±2.15 0.39±0.09 0.36±0.08 VC+CdCl2 28.27±1.92 28.76±1.68 0.41±0.26 0.38±0.10
2.2 小鼠血清SOD及MDA的变化
结果显示,Con与VC组近似,无显著性差异;镉负荷第1日,染毒组SOD和MDA水平高于Con,VC处理后降低,接近Con;镉负荷第3日,染毒组SOD水平较Con显著降低(P<0.05),VC处理后较染毒组显著升高(P<0.05),MDA含量较Con显著升高(P<0.05),VC处理后含量显著降低(P<0.05);镉负荷第3日,染毒组SOD水平显著低于第1日(P<0.05),MDA含量高于第1日,但无显著性差异,VC处理后SOD水平低于第1日及MDA含量高于第1日,但无显著性差异(表2)。
Tab.2 Changes in serum levels of SOD and MDA of mice in each group(±s,n=9)
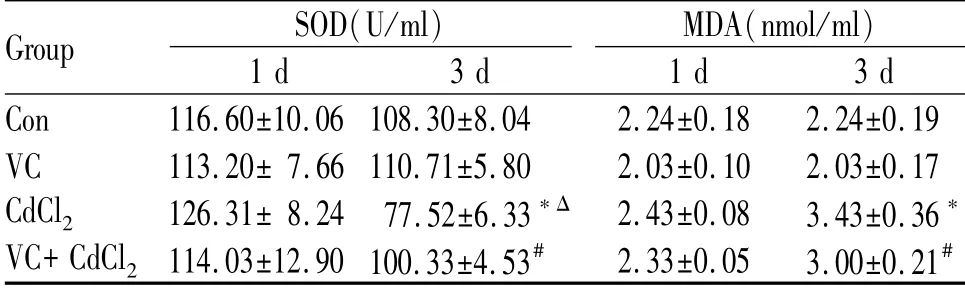
Tab.2 Changes in serum levels of SOD and MDA of mice in each group(±s,n=9)
SOD:Superoxide dismutase;MDA:Malondialdehyde*P<0.05 vs Con;#P<0.05 vs CdCl2;ΔP<0.05 vs CdCl2(1 d)
Group SOD(U/ml)1 d 3 d MDA(nmol/ml)1 d 3 d Con 116.60±10.06 108.30±8.04 2.24±0.18 2.24±0.19 VC 113.20±7.66 110.71±5.80 2.03±0.10 2.03±0.17 CdCl2 126.31±8.24 77.52±6.33*Δ2.43±0.08 3.43±0.36*VC+CdCl2 114.03±12.90 100.33±4.53# 2.33±0.05 3.00±0.21#
2.3 小鼠睾丸组织MDA及GSH/GSSG变化
结果显示,Con与VC组近似,无显著性差异;镉负荷第1日,染毒组MDA水平显著高于Con(P<0.05),GSH/GSSG水平显著高于Con(P<0.05),VC处理后较染毒组显著降低(P<0.05);镉负荷第3日,染毒组MDA含量显著高于Con(P<0.05),VC处理后含量显著降低(P<0.05),GSH/GSSG水平显著低于Con(P<0.05),VC处理后显著升高(P<0.05);镉负荷第3日,染毒组MDA含量显著高于第1日(P<0.05),VC处理后含量较第1日显著升高(P<0.05),GSH/GSSG水平低于第1日;VC处理后,GSH/GSSG水平未有明显变化(表3)。
Tab.3 Changes of MDA and GSH/GSSG in testis tissues of mice in each group(±s,n=9)
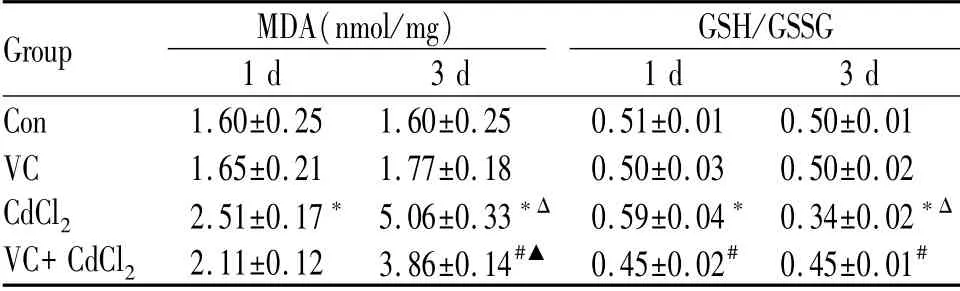
Tab.3 Changes of MDA and GSH/GSSG in testis tissues of mice in each group(±s,n=9)
MDA:Malondialdehyde;GSH:Reduced glutathione;GSSG:Oxidized glutathione*P<0.05 vs Con;#P<0.05 vs CdCl2;ΔP<0.05 vs CdCl2(1d);▲P<0.05 vs VC+CdCl2(1 d)
Group MDA(nmol/mg)1 d 3 d GSH/GSSG 1 d 3 d Con 1.60±0.25 1.60±0.25 0.51±0.01 0.50±0.01 VC 1.65±0.21 1.77±0.18 0.50±0.03 0.50±0.02 CdCl2 2.51±0.17*5.06±0.33*Δ0.59±0.04*0.34±0.02*Δ VC+CdCl2 2.11±0.12 3.86±0.14#▲0.45±0.02#0.45±0.01#
2.4 小鼠睾丸组织SOD、GSH-Px及T-GSH的变化
结果显示,Con与VC组近似,无显著性差异;镉负荷第1日,染毒组SOD、GSH-Px和T-GSH水平显著高于Con(P<0.05),VC处理后其水平显著降低(P<0.05);镉负荷第3日,染毒组SOD、GSH-Px和T-GSH水平显著低于Con(P<0.05),VC处理后其水平显著升高(P<0.05);镉负荷第3日SOD、GSH-Px和T-GSH水平显著低于第1日(P<0.05),VC处理后,第3日依旧低于第1日,但无显著性差异(表4)。
Tab.4 Changes of SOD,GSH-Px and T-GSH in testis tissues of mice in each group(±s,n=9)
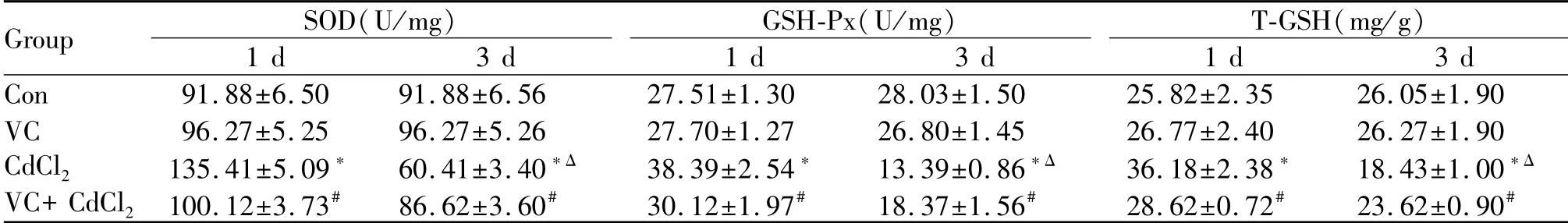
Tab.4 Changes of SOD,GSH-Px and T-GSH in testis tissues of mice in each group(±s,n=9)
SOD:Superoxide dismutase;GSH-Px:Glutathione peroxidase;T-GSH:Total glutathione*P<0.05 vs Con;#P<0.05 vs CdCl2;ΔP<0.05 vs CdCl2(1 d)
Group SOD(U/mg)1 d 3 d GSH-Px(U/mg)1 d 3 d T-GSH(mg/g)1 d 3 d Con 91.88±6.50 91.88±6.56 27.51±1.30 28.03±1.50 25.82±2.35 26.05±1.90 VC 96.27±5.25 96.27±5.26 27.70±1.27 26.80±1.45 26.77±2.40 26.27±1.90 CdCl2 135.41±5.09*60.41±3.40*Δ 38.39±2.54* 13.39±0.86*Δ 36.18±2.38* 18.43±1.00*Δ VC+CdCl2 100.12±3.73#86.62±3.60# 30.12±1.97# 18.37±1.56# 28.62±0.72# 23.62±0.90#
3 讨论
研究发现,镉负荷致小鼠体重及睾丸脏器系数降低[4],本研究也表明,不同镉负荷下小鼠体重及睾丸脏器系数降低。睾丸脏器指数降低表明镉对睾丸造成损伤[5]。VC处理后,降低的程度略有改善,说明VC对染镉小鼠睾丸组织具有一定保护作用。
MDA是膜脂过氧化最重要的产物之一,其浓度与细胞损伤程度呈正相关 性,MDA浓度可间接反应膜脂过氧化程度[6]。随着镉负荷延长,镉组小鼠血清、睾丸组织氧化产物MDA含量逐渐升高,呈剂量依赖性,表明镉的蓄积致小鼠氧化应激程度加重,VC干预后,第1日和第3日MDA含量显著低于染毒组,表明VC对第1日、第3日镉致氧化损伤有一定保护作用。文献报道,VC转化为抗坏血酸根给脂自由基提供电子干预脂质过氧化反应[7]。VC可能通过上述机制发挥作用。
GSH/GSSG是细胞内最丰富的氧化还原对,也是主要的抗氧化系统之一[8]。GSH/GSSG是细胞健康的指标,它代表氧化剂和抗氧化剂之间的动态平衡,细胞内这个比值的变化是细胞信号转导微调的基础,包括细胞循环调节和其他细胞过程所需的氧化应激信号[9]。因此,本实验分别对GSH/GSSG和T-GSH进行了研究。周雍[10]的研究表明,急性镉染毒1 h后还原型GSH含量急剧升高,48 h含量接近对照组。本研究显示,镉负荷第1日睾丸组织GSH/GSSG比值升高,可能与GSH含量应激性升高有关。氧化应激时,GSH氧化成GSSG,随着镉负荷时间延长GSH含量下降;睾丸组织累积较多的GSSG,GSSG可在谷胱甘肽还原酶作用下可还原为GSH,NADP+/NADPH系统提供所需的还原当量。有文献报道,苯并(a)芘染毒致小鼠睾丸组织细胞G-6-PD活性随着染毒剂量逐渐降低[11]。镉负荷可能也致小鼠睾丸组织细胞G-6-PD活性降低,GSSG在睾丸组织逐渐累积,导致GSH/GSSG比值降低。本研究镉负荷第3日GSH/GSSG比值降低可能与上述机制有关。VC参与GSSG转化为GSH的反应过程[12]。本研究不同镉负荷经VC干预GSH/GSSG比值接近对照组,可能与此机制有关,说明VC在一定程度上维持该比值的平衡,对镉负荷致小鼠睾丸组织细胞氧化损伤有一定保护作用。但是VC为水溶性易被代谢,镉负荷再延长是否能发挥保护作用需进一步研究。
酶和非酶系抗氧化系统包括SOD、GSH-Px、GSH,它们可以清除氧自由基,保护细胞免受氧化损伤。镉负荷第1日,血清SOD及睾丸组织SOD、GSH-Px、T-GSH水平升高。这一结果与其他学者[5,13]研究不一致,但也有学者[14]研究显示SOD活力水平升高。原因可能是:(1)剂量不同,机体产生的应激反应不同。(2)观察时间不同,本研究染毒结束后第1日观察。因此,本研究镉负荷第1日SOD、GSH-Px、T-GSH水平升高可能与应激性增加或者其他机制有关,需进一步研究。文献报道,镉能抑制SOD、GSH-Px活性,增加ROS和脂质过氧化损伤,干扰抗氧化酶的活性。镉还能改变细胞内氧化还原状态,通过与内源性及外源性抗氧化剂反应,如GSH[15]。本研究显示镉负荷第3日SOD、GSH-Px、T-GSH水平降低,可能与上述机制有关。细胞内氧化还原稳态的稳定是由于复杂的内源性抗氧化防御系统的保护作用,外源性抗氧化物质(如VC、VE等)强化内源性抗氧化防御系统的作用[16]。Culter提出,许多生物体有能力维持稳定的氧化应激,应用抗氧化补充剂证明有效性是假定初始氧化应激水平高于正常或高于机体的调节点,这样,抗氧化补充剂可能降低氧化应激增加的水平,但应激不能被内源性抗氧化物质阻止[16]。因为VC为水溶性的,可能在小鼠的日常活动中被代谢;镉的半衰期长,易体内蓄积,所以本研究中VC处理后SOD、GSH-Px与TGSH水平得到改善,但镉负荷第3日活力水平低于第1日,可能与上述机制有关。因此,VC在一定程度上可以减缓镉致小鼠睾丸的氧化损伤,但该保护作用可能有一定的时间限制。
研究表明,自噬由严重氧化应激触发,被认为是一种能清除细胞质中损伤的细胞器和蛋白降解成分的自然过程,但过度的自噬会破坏细胞的基本成分[17]。有研究表明,柚皮素通过下调p62和LC3-II的表达,进一步抑制MDA和H2O2的产生,保护睾丸免受镉诱导的自噬[17]。陈明生等[18]研究表明,VC联合替莫唑胺能够增强对胶质瘤细胞的毒性,这一作用是通过ERK信号通路来促进细胞凋亡并抑制替莫唑胺所介导的自噬作用。本研究VC对镉染毒的保护作用可能与睾丸自噬有关,需要进一步进行研究探讨。

