牛樟树提取物促进樟芝深层发酵无性产孢及其应用
李华祥,石瑀,罗志珊,高亚军,王娟娟,肖玉娟,袁磊,饶胜其,杨振泉*
1(扬州大学 食品科学与工程学院,江苏 扬州,225127)2(江南大学 生物工程学院,江苏 无锡,214122)3(厦门华厦学院 环境与公共健康学院,福建 厦门,361024)
牛樟树(CinnamomumkanehiraeHay)属于樟目、樟科、樟属(Cinnamomum),是一种常绿阔叶乔木,也是我国台湾地区特有的树种,同时也是樟芝的唯一天然宿主[1-2]。樟芝(Antrodiacamphorata,Antrodiacinnamomea或Taiwanofunguscamphoratus),又名牛樟芝或牛樟菇,是一种食药两用真菌,属于担子菌门(Basidiomycota)、多孔菌科(Polyporaceae)、薄孔菌属(Antrodia),具有解酒、保肝、抗炎、抗癌、抗氧化、抗病毒、抗肿瘤、缓解疲劳、调节免疫等多种生物活性[3-6],已成为目前食药用菌研究领域的热点之一。出众的生物活性使樟芝有着极大的市场需求,但野生樟芝子实体数量稀少、价格昂贵[7]。因此,大规模人工培养牛樟芝显得尤为必要。其中,深层发酵技术由于具有周期短、效率高、成本低、易于规模化生产等优点,已成为目前樟芝最主要的人工培养方式[8-10]。本文作者攻读博士学位期间所在课题组首次报道了樟芝在深层发酵过程中会产生无性节孢子的现象,并优化了其产孢条件[11]。随后,又发现以樟芝无性节孢子作为接种物进行深层发酵,可有效缩短樟芝发酵周期,提高发酵过程可控性及活性物质生产效率,并依此建立了基于无性孢子接种的樟芝快速发酵工艺[12-13]。
但是,樟芝深层发酵工艺在生产过程中仍然存在一些问题,如作为种子的樟芝无性孢子产量较低,导致种子制备时间长、成本高,限制了樟芝深层发酵工业生产效率[7,14]。此外,樟芝活性物质产量低也是樟芝深层发酵生产效益的主要限制因素[14]。因此,提高樟芝深层发酵产孢量及活性物质产量,是进一步提高樟芝深层发酵工业化生产效率、降低生产成本的关键所在。目前,提高樟芝深层发酵产孢量及活性物质产量的方法主要是优化发酵条件(包括培养基组成及发酵工艺)及添加外源物质[7]。如GENG等[11]以产孢量为检测指标,通过优化培养基中的碳源、氮源及碳氮比,明确了樟芝只有在营养匮乏的高碳氮比培养基中才能大量产孢,而在营养丰富的低碳氮比培养基中几乎不产孢;LU等[12]以总三萜产量为检测指标,通过优化培养基中碳源和氮源的种类及含量,发现樟芝在营养匮乏的培养基中不适于积累活性物质。随后,LI等[14]在综合考虑产孢及产活性物质的前体下,通过进一步优化培养基配方及发酵工艺,建立了一种基于无性孢子接种的樟芝深层循环发酵工艺,显著缩短了生产周期,提高了樟芝深层发酵活性物质的生产效率。
此外SHEN等[15]研究了在培养基中添加牛樟、沉水樟及香樟等不同樟树水提物对樟芝胞内多糖抗炎活性的影响,结果发现添加沉水樟(Cinnamomummicranthum)、土肉桂(Cinnamomumosmophloeum)及兰屿肉桂(Cinnamomumkotoense)水提物可增加樟芝胞内多糖的抗炎活性;CHANG等[16]研究了在培养基中添加牛樟树精油、香樟树精油、香杉精油及红桧精油对牛樟芝菌丝体生长及子实体形成的影响,发现牛樟树精油能够有效地促进牛樟芝菌丝体生长;LU等[17]研究了在培养基中添加香樟树的水提取物、甲醇提取物、石油醚提取物及乙酸乙酯提取物对樟芝产三萜的影响,结果表明香樟树水提物可促进樟芝菌丝生长,而香樟树石油醚提取物可显著增加樟芝总三萜产量;李一凡等[18]研究了平皿培养时在琼脂培养基中添加生长素、细胞分裂素等植物激素及木质素对樟芝菌丝体生长的影响,发现牛樟树粉末对樟芝菌丝体的生长有一定的促进作用,但直接添加牛樟树粉末不利于樟芝菌丝体的分离,故此法不适用于深层发酵。
上述研究结果表明樟树中确实含有对樟芝生长及产活性物质有利的化合物,但前人多以对樟芝菌丝生长及活性物质的影响为研究目标,所添加的物质也多为樟属(Cinnamomum)中其他树种的提取物。关于在深层发酵培养基中添加牛樟树提取物对樟芝无性产孢影响的研究,目前鲜见相关报道。因此,本文首先比较了在深层发酵培养基中添加牛樟树不同溶剂(甲醇、乙酸乙酯、石油醚及水)提取物对樟芝无性产孢的影响,明确能显著促进樟芝无性产孢的牛樟树提取物组分,再考察该提取物对樟芝生长及产活性物质的影响,最终获得既能显著促进樟芝产孢,又能促进樟芝活性物质积累的牛樟树提取物,为提高樟芝深层发酵种子制备效率及工业化生产效益提供理论依据并奠定实践基础,具有较大的开发价值及良好的应用前景。
1 材料与方法
1.1 材料与仪器
樟芝(Antrodiacamphorate)菌株购自“美国菌种保藏中心”(American Type Culture Collection,ATCC),编号为ATCC 200183,由江南大学生物工程学院许正宏教授惠赠,现保存于扬州大学食品科学与工程学院食品微生物应用与控制实验室;牛樟树木屑(50年以上树龄),福建皓天生物科技有限公司;PDA培养基,生工生物工程(上海)股份有限公司;葡萄糖、酵母粉、硫酸镁、磷酸二氢钾、盐酸等常规试剂,国药集团化学试剂有限公司,纯度均为分析纯。
R404A高速冷冻离心机、移液枪/枪头,Eppendorf(德国);DHZ-DA 型恒温摇床,太仓市实验设备厂;MS-100恒温金属浴,杭州奥盛有限公司;pH计,厦门开普瑞生物科技有限公司;真空冷冻干燥机(2.5 L),LABCONACO(美国);SW-CJ-2F超净工作台,苏州华宇;LV150 N光学显微镜,日本尼康;MDF-U5386S超低温冰箱/普通冰箱,SANYO(日本)。
1.2 培养基
1.2.1 斜面培养基
本文所用斜面培养基为商用PDA培养基。
1.2.2 种子培养基[19]
葡萄糖20 g/L,酵母粉1 g/L,KH2PO43 g/L,MgSO41.5 g/L,pH 4.5,121 ℃灭菌20 min后,冷却备用。
1.2.3 发酵培养基[19]
葡萄糖20 g/L,酵母粉10 g/L,KH2PO43 g/L,MgSO41.5 g/L,pH 4.5,121 ℃灭菌20 min后,冷却备用。
1.3 牛樟树提取物的制备
1.3.1 有机溶剂提取物
参照文献[20]的方法并稍作修改。称取20 g样品,按料液比1∶20(g∶mL)分别加入甲醇、乙酸乙酯或石油醚,超声30 min后,振荡提取3 h,用4层纱布过滤并收集滤液。重复上述提取操作3次,将滤液合并后蒸干并称重。所得干物质用适量体积的去离子水复溶,使得提取物最终质量浓度为50 mg/mL(母液),保存于-20 ℃冰箱中备用。
1.3.2 水提取物
参照文献[20]的方法并稍作修改。称取20 g样品,按料液比1∶20(g∶mL)加入去离子水,90 ℃水浴提取3 h,用4层纱布过滤并收集滤液。重复上述提取操作3次,将滤液合并后浓缩烘干并称重。所得干物质用适量体积的去离子水复溶,使得提取物最终质量浓度为50 mg/mL(母液),保存于-20 ℃冰箱中备用。
1.4 樟芝种子制备
1.4.1 原代种子制备
用接种铲将培养好的樟芝斜面菌丝体接种到发酵培养基中并用转子通过磁力搅拌打碎,26 ℃、150 r/min振荡培养12~14 d后,发酵液用4层无菌纱布过滤,滤液即为孢子悬浮液,即樟芝原代种子。
1.4.2 发酵种子制备
将原代种子按1.0×106个/mL的接种量接入种子培养基中,26 ℃、150 r/min振荡培养10 d后,发酵液用4层无菌纱布过滤,所得滤液即为樟芝发酵种子,可用于樟芝发酵生产接种或种子制备发酵接种。
1.5 樟芝摇瓶发酵培养
将樟芝发酵种子按1.0×106个/mL的接种量接入发酵培养基中,26 ℃、150 r/min振荡培养10~12 d。
1.6 牛樟树提取物的添加
将1.3中配制好的牛樟树提取物母液用直径0.45 μm的微孔滤膜过滤除菌后,根据所需添加浓度吸取相应体积的牛樟树提取物加入灭菌冷却后的种子培养基中,摇匀,再按1.4.2中的方法进行接种及发酵培养即可。以添加相同体积去离子水为对照组。
1.7 检测方法
1.7.1 生物量的检测
将发酵培养物用4层纱布过滤,收集滤渣,75 ℃烘干至恒重,称重并计算生物量。
1.7.2 孢子数的检测
将发酵培养物用4层纱布过滤,收集滤液,吸取50 μm滤液并用血球计数板在显微镜下计数,并计算产孢量。
1.7.3 胞内多糖的检测
按照文献[19]的方法采用称重法测定樟芝胞内多糖含量。即准确称取干燥并粉碎后的菌粉2 g于10 mL比色管中,加10 mL去离子水,95 ℃水浴提取1 h,重复提取3次,将上清液转移至50 mL离心管中,浓缩至10 mL后加30 mL无水乙醇4 ℃静置过夜,8 000 r/min,离心10 min,将沉淀75 ℃烘干后称重,即为粗多糖的质量。
1.7.4 总三萜含量的检测
按照文献[19]的方法采用香草醛-高氯酸法测定樟芝菌丝体中总三萜含量。即先以齐墩果酸为标准品绘制标准曲线。再精确称取干燥并粉碎后的菌粉100 mg于2 mL EP管中,加入1 mL甲醇,50 Hz超声30 min后振荡提取1 h,8 000 r/min离心10 min后,吸取上清液100 μL于10 mL具塞试管中,水浴蒸干,加0.3 mL现配制的质量浓度为50 g/L的香草醛-冰醋酸溶液和1 mL的高氯酸,60 ℃反应20 min,冰水冷却,加10 mL冰醋酸,摇匀,在550 nm下测定吸光度,根据标准曲线计算总三萜的含量。
1.8 数据统计及分析
本文所有实验组均设置至少3个生物重复,所有数据均采用“平均值±标准差”的形式展示,用Origin Pro 8.0软件进行绘图,用SPSS PASW Statistics 18.0软件进行差异显著性分析,差异显著水平为P<0.05。
2 结果与分析
2.1 不同牛樟树提取物对樟芝深层发酵无性产孢的影响
为了考察不同牛樟树提物对樟芝深层发酵无性产孢的影响,我们按1.6中的方法在发酵培养基中分别添加终质量浓度为50 μg/mL的牛樟树甲醇提取物、乙酸乙酯提取物、石油醚提取物及水提物,并从发酵第6天开始每天取样测定产孢量,以不添加任何牛樟树提取物组为空白对照,结果如图1所示。

图1 不同牛樟树提取物对樟芝深层发酵无性产孢的影响Fig.1 Effects of different extracts of Cinnamomum kanehirae Hay on sporulation in Antrodia cinnamomea注:“CK”表示空白对照,即不添加任何牛樟树提取物(下同);所有牛樟树提取物的添加质量浓度均为50 μg/mL
由图1可知,4种牛樟树提取物中,只有牛樟树水提物对樟芝无性产孢有显著促进作用,并使樟芝深层发酵最大产孢量较对照提高了41.2%;而牛樟树有机溶剂(甲醇、乙酸乙酯、石油醚)提取物对樟芝无性产孢则表现为明显抑制作用,其中尤以牛樟树石油醚提取物的抑制作用最为突出。因此,我们选择牛樟树水提物作进一步研究。
2.2 不同浓度牛樟树水提物对樟芝深层发酵无性产孢的影响
接下来,我们以产孢量为检测指标,对牛樟树水提物添加质量浓度在20~100 μg/mL进行了优化,结果如图2和图3所示。
由图2可知,牛樟树水提物对樟芝深层发酵产孢的影响呈浓度依赖性,且最佳添加质量浓度为60 μg/mL;当添加质量浓度低于60 μg/mL时,牛樟树水提物对樟芝产孢的促进效果随浓度的增加而增加;当添加质量浓度高于60 μg/mL时,牛樟树水提物对樟芝产孢的促进效果随浓度的增加而减少;在发酵培养基中添加终质量浓度为60 μg/mL的牛樟树水提物时,樟芝最大产孢量可达76.26×106个/mL,较不添加牛樟树水提物的对照组提高了58%,效果非常显著。由图3可知,在培养基中添加最终质量浓度为60 μg/mL的牛樟树水提物发酵所产生樟芝孢子与不添加牛樟树水提物的对照组相比,在形态上并无显著差异,但产孢量(孢子浓度)明显增加。
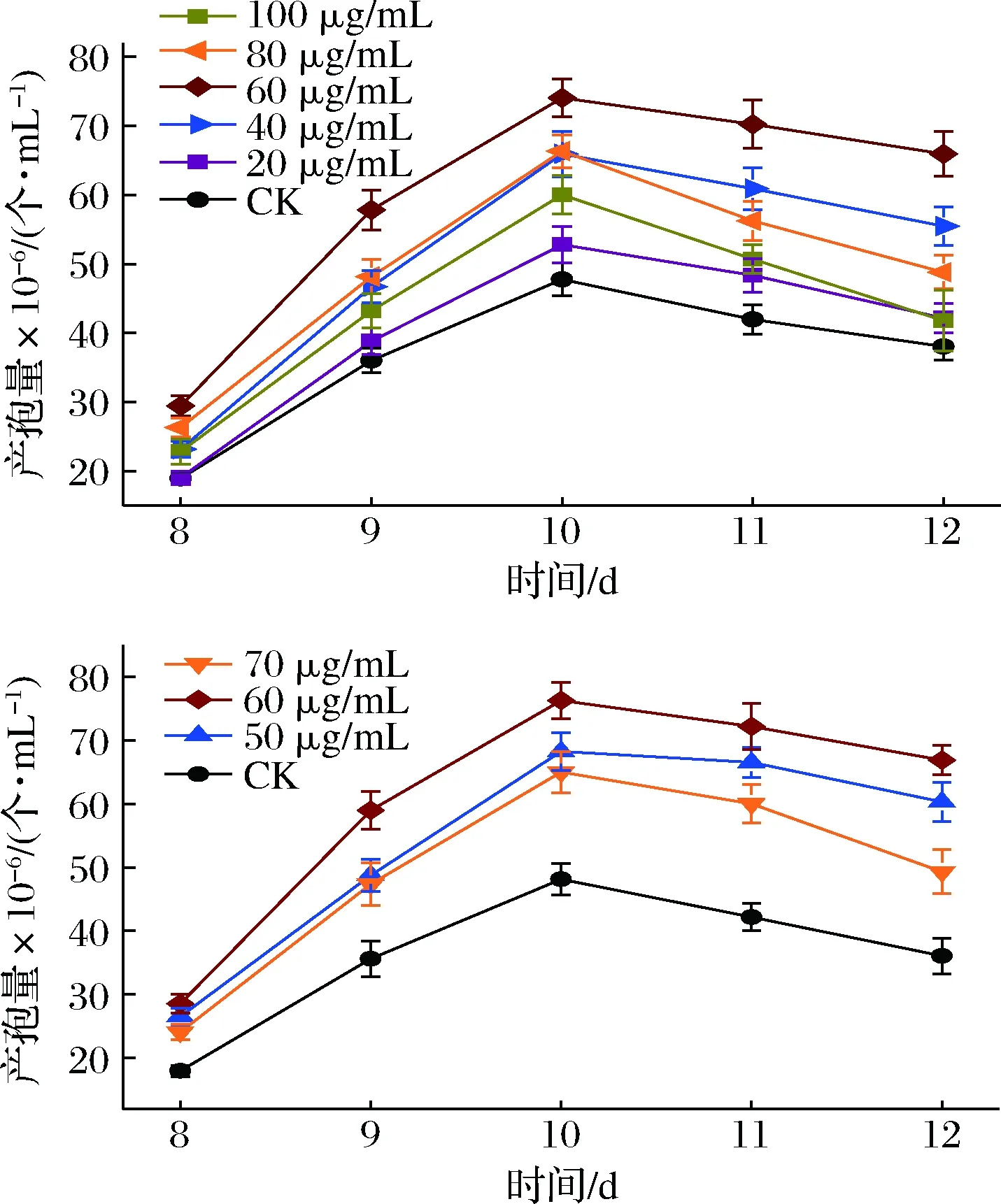
图2 不同浓度的牛樟树水提物对樟芝深层发酵无性产孢的影响Fig.2 Effects of different concentrations of water extract of Cinnamomum kanehirae Hay on sporulation for Antrodia cinnamomea in submerged fermentatioin

a-CK;b-60 μg/mL图3 樟芝深层发酵所产无性孢子Fig.3 The asexual spore of Antrodia cinnamomea from submerged fermentatioin注:图中均为发酵原液稀释4倍后,放大640倍(16×40)的光学显微镜照片
此外,从图2的结果还可以看出,在此发酵条件下,所有实验组产孢量均在发酵10 d时达到最大值。由于本研究的主要目的是提高樟芝深层发酵的种子制备效率,即为了获取樟芝无性孢子。因此,选择在产孢量达到最大值时结束发酵并收集孢子最为合理,故后续相关的生物量、胞内多糖产量及总三萜产量等指标,我们均采用发酵10 d的樟芝菌丝体样品进行测定。
2.3 添加牛樟树水提物对樟芝深层发酵产活性物质的影响
为了明确牛樟树水提物除了促进樟芝无性产孢以外,对樟芝的生长及活性物质积累是否也有影响,我们对在培养基中添加了终质量浓度为60 μg/mL牛樟树水提物且发酵10 d的樟芝菌丝体样品的生物量、胞内多糖产量及总三萜产量进行了检测,结果如表1所示。

表1 牛樟树水提物对樟芝深层发酵产活性物质的影响Table 1 Effect of water extract of Cinnamomum kanehirae Hay on producing bioactive substances in Antrodia cinnamomea
由表1可知,添加牛樟树水提物能显著促进樟芝生长及产活性物质。其中,生物量由4.89 g/L增加到6.18 g/L,提高了26%左右;总三萜产量由25.18 mg/L增加至34.65 mg/L,提高了35%左右。但促进效果最为显著的胞内多糖。添加牛樟树水提物后,樟芝菌丝体中的胞内多糖质量分数由11.17%增加至33.51%,提高了200%以上;胞内多糖产量则由546.22 mg/L增加至2 070.92 mg/L,提高了270%左右,产量是原来的3.7倍。可见,牛樟树水提物除了能显著促进樟芝无性产孢以外,还能显著促进樟芝菌丝体生长及活性物质的积累,可谓一举多得。
2.4 牛樟树水提物促产孢子的发酵性能研究
为了进一步确定牛樟树水提物促进樟芝无性产孢的应用价值,我们将添加牛樟树水提物(60 μg/mL)促进产生的樟芝无性孢子(以下简称“促产孢子”)与相同条件下不添加牛樟树水提物发酵产生的樟芝无性孢子(以下简称“对照孢子”)的发酵性能(包括产孢性能和产活性物质性能)进行比较,以明确牛樟树水是否会对樟芝孢子的种子活力产生负面影响。
首先,我们将“促产孢子”与“对照孢子”按1.0×106个/mL的接种量接入种子培养基中,26 ℃、150 r/min振荡培养12 d。期间,从第6天开始,每天取样进行孢子计数,以考察“促产孢子”与“对照孢子”的产孢性能,结果如图4所示。
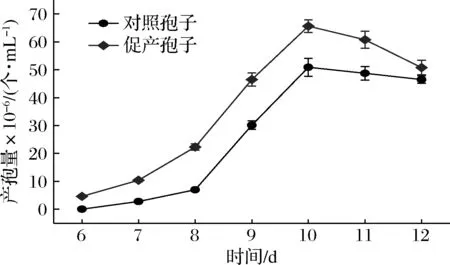
图4 牛樟树水提物促进产生的樟芝无性孢子深层发酵的产孢性能Fig.4 Sporulation performance of Antrodia cinnamomea spores induced by water extract of Cinnamomum kanehirae Hay注:“促产孢子”表示在种子培养基中添加最终质量浓度为60 μg/mL的牛樟树水提物,按1.0×106 个/mL的接种量接入樟芝原代孢子,26 ℃、150 r/min培养10 d后,所产生收集的樟芝无性孢子;“对照孢子”表示将樟芝原代种子按1.0×106 个/mL的接种量接入种子培养基中,26 ℃、150 r/min培养10 d后,所产生收集的樟芝无性孢子
由图4可知,“促产孢子”的产孢速度及最大产孢量均显著高于“对照孢子”,其最大产孢量65.63×106个/mL较“对照孢子”的50.88×106个/mL提高了28%左右。此结果说明樟芝“促产孢子”在深层发酵中的产孢性能显著优于“对照孢子”。
此外,我们还将“促产孢子”与“对照孢子”按1.0×106个/mL的接种量接入发酵培养基中,26 ℃、150 r/min 培养。由之前的研究结果[19]可知,本文所用樟芝菌株在该条件下发酵时,樟芝胞内多糖及总三萜等活性物质质量分数均在发酵10 d时达到最大值,因此,选择在第10天时结束发酵,并对样品的生物量、胞内多糖产量及总三萜产量进行测定,结果如表2所示。

表2 牛樟树水提物促进产生的樟芝无性孢子深层发酵的产活性物质性能Table 2 Bioactive substances production performance of Antrodia cinnamomea spores induced by water extract of Cinnamomum kanehirae Hay in submerged fermentatioin
由表2可知,樟芝“促产孢子”发酵产生的生物量及总三萜产量与“对照孢子”相比无显著差异;但“促产孢子”发酵的樟芝菌丝体中的胞内多糖质量分数及胞内多糖产量较“对照孢子”提高了39%和46%左右,分别为20.51%和1 432.84 mg/L。上述结果表明樟芝“促产孢子”在深层发酵中的生长及产三萜性能与“对照孢子”无显著差异,但“促产孢子”在深层发酵中产胞内多糖的性能显著优于“对照孢子”。
综上所述,樟芝“促产孢子”在深层发酵过程中的发酵性能要显著优于“对照孢子”,优势主要体现在产孢性能及产胞内多糖性能上,究其原因及机理,尚有待于进一步研究。
本研究结果较具实际意义及应用价值。因为通常情况下,樟芝产孢和产多糖的最适条件是不一致的:营养匮乏的培养基更适合樟芝产孢,营养丰富的培养基更适合樟芝产多糖[11-12]。因此,人们通常根据发酵目的不同而采用不同的培养基配方。即,制备种子(樟芝无性孢子)时采用营养较为匮乏的培养基,如本文所使用的“种子培养基”,碳氮比约为20∶1;发酵生产时通常采用营养较为丰富的培养基,如本文所使用的“发酵培养基”,碳氮比约为2∶1。但樟芝在营养匮乏的种子培养基中,生物量及三萜、多糖等活性物质含量通常较低[19]。因此,在制备樟芝种子的发酵过程中,收集完孢子后剩下的樟芝菌丝体通常显得很“鸡肋”,直接丢弃比较可惜,但用来提取活性物质又因为产量太低、提取成本太高而受到限制。本研究结果很好地解决了这个“鸡肋”问题,只需在种子培养基中添加微量(60 μg/mL)的牛樟树水提物,便可在显著提高樟芝孢子产量的同时,使得樟芝胞内多糖产量也提高至原来的3.7倍,效果极其显著。
3 结论
本文首先比较了牛樟树4种溶剂(甲醇、石油醚、乙酸乙酯、水)提取物对樟芝深层发酵无性产孢的影响,结果发现只有牛樟树水提物对樟芝产孢呈现出显著促进作用;随后,我们对牛樟树水提物的添加浓度进行了优化,发现其最佳添加质量浓度为60 μg/mL;在最佳添加浓度下,牛樟树水提物可使樟芝深层发酵产孢量较对照提高58%左右,同时生物量提高26%左右,三萜产量提高35%左右,多糖产量则提高270%左右;最后,本文对添加牛樟树水提物促进产生的樟芝孢子(简称“促产孢子”)的发酵性能进行了研究,发现“促产孢子”在产孢性能及产胞内多糖性能方面均显著优于不添加牛樟树水提物发酵产生的樟芝孢子,其中最大产孢量及胞内多糖产量较对照分别提高了28%及46%左右。本研究结果解决了制备樟芝孢子时所产生樟芝菌丝体的“鸡肋”问题,同时也显著提高了樟芝深层发酵生产的效益,可谓变废为宝,一举多得。此外,本研究成果操作方便、成本低廉、材料来源广泛,容易推广及规模化,具有较大开发价值及良好的应用前景。

