葛根-枳椇子药对发酵工艺及解酒功效评价研究
倪以宇,赵大庆,倪伟锋,曾婧,白竹林,王思明
(长春中医药大学,吉林省人参科学研究院,吉林 长春,130117)
葛根(PuerariaelobataeRadix)是豆科植物野葛的干燥块根,枳椇子为鼠李科枳椇属植物枳椇(HoveniaacerbaLindl.)的肉质果柄和干燥成熟的种子。基于文献记载[1-5],大都认为黄酮类化合物是解酒保肝的主要活性成分,而葛根、枳椇子中均含有丰富的黄酮类化合物,如葛根素、大豆苷元、二氢杨梅素和槲皮素等活性成分[1-2],其中从葛根、枳椇子中提取的黄酮化合物可以通过抑制体内对乙醇的吸收加速代谢以降低体内血醇浓度并增加体内抗氧化能力,从而达到解酒保肝的作用[2-3]。葛根、枳椇子等为药食同源的传统解酒毒药物[4],也是在临床应用、保健品、普通食品等方面最常采用的药物组合之一[5-6]。早在四千余年前,中国就利用微生物发酵进行酿酒、制酱醋,在此基础上加入中药材,形成了最早形式的中药发酵工艺[7]。结合目前研究进展,通过微生物发酵确实能对部分药材起到减毒增效[8-9]的作用。
本文以葛根-枳椇子为原料,采用课题组前期所优选最适的植物乳杆菌(Lactobacillusplantarum)和副干酪乳杆菌(Lactobacillusparacasei)这2种可用于普通食品的菌种,探究植物乳杆菌和副干酪乳杆菌混合发酵对提升葛根和枳椇子解酒功效的影响,确定发酵工艺。开发出因发酵而达到“增效”的高活性、高解酒能力的解酒护肝的功效型产品。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
葛根,安国市安兴中药饮片有限公司(经长春中医药大学中药鉴定教研室王哲副教授鉴定为来源于豆科植物野葛的干燥块根);枳椇子,河北仁心药业有限公司(经长春中医药大学中药鉴定教研室王哲副教授鉴定为来源于鼠李科枳椇属植物枳椇的成熟种子);MRS肉汤培养基,北京索莱宝科技有限公司;56°红星二锅头,北京红星股份有限公司;葛根五味子片,广东现代汉方科技有限公司;亚硝酸钠、硝酸铝、氢氧化钠(均为分析纯);植物乳杆菌(Lac-tobacillusplantarum):CGMCC1.568、副干酪乳杆菌(Lac-tobacillusparacasei):CGMCC1.2468,中国普通微生物菌种保藏管理中心;天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酸-丙酮酸转氨酶(alanine aminotransferase,ALT)、超氧化物歧化酶(superoxide dismutase,SOD)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)试剂盒,上海优选生物科技有限公司。
1.1.2 实验动物
SPF级ICR小鼠,雄性,4周龄,个体质量(20±2) g,购自长春亿斯实验动物技术有限公司(许可证号:SCXK(吉)-2020-0002)。饲养环境温度为(23±2) ℃,相对湿度为40%~60%,光照、黑暗各12 h。
1.2 仪器与设备
SX-700蒸汽灭菌器,日本TomyDigitalBiology公司;KQ-600E超声清洗器,昆山超声仪器有限公司;SW-CJ-2D双人单面净化工作台,苏州净化设备有限公司;ZQPW-70全温振荡培养箱,天津莱玻特瑞仪器设备有限公司;UV-2550紫外可见分光光度计,日本岛津公司;Infinite 200 Pro酶标仪,瑞士TECAN公司。
1.3 试验方法
1.3.1 葛根-枳椇子发酵工艺流程
基于课题组前期试验筛选,采用固体发酵的方式[7],工艺流程如下:
葛根-枳椇子→粉碎过80目筛网→混合放入100 mL锥形瓶中→分别加入40 mL(料液比1∶4)MRS培养基→(121 ℃,20 min)灭菌→冷却至室温
1.3.2 发酵菌液制备
取液氮中甘油冻藏的植物乳杆菌和副干酪乳杆菌,解冻后接种至MRS肉汤培养基中进行活化[1%(体积分数)总接种量、37 ℃、200 r/min],活化2遍,活化完成。根据单因素和正交试验所需要的不同发酵条件接种到葛根-枳椇子中发酵(37 ℃、200 r/min)[10]。
1.3.3 提取方式筛选
使用水提、醇提这两种常规提取方法,基于《太平惠民和剂局方》记载,葛根-枳椇子常用质量比为1∶1。水提:葛根-枳椇子加水煎煮1 h,3 500 r/min离心10 min后过绢布去药渣,加95%(体积分数)食用乙醇至提取液中,配制成含40%(体积分数)乙醇的溶液,醇沉12 h后过绢布去渣滓[11-13],挥醇浓缩为0.15 g/mL(生药浓度)的浓缩液;醇提:葛根-枳椇子加入6倍于生药量的60%(体积分数)乙醇,水浴80 ℃,回流提取1 h,后过绢布去渣滓,80 ℃挥醇,浓缩为0.21 g/mL(生药浓度)的浓缩液。通过解酒防醉实验来比较不同提取方式对解酒防醉效果的影响[14]。
1.3.4 单因素试验
起始条件是pH值6.5、接种比例(体积比)(植∶副)=1∶1、总接种量5%(质量分数)、发酵时间72 h,进行单因素试验,考察不同起始条件pH值(4.5、5.0、5.5、6.0、6.5、7.0),接种比例(体积比)(植∶副)(1∶1、1∶2、2∶1、1∶3、3∶1)、总接种量(2%、3%、4%、5%、6%、8%)(质量分数),发酵时间(24、36、48、60、72、84 h)对黄酮含量和醉酒醒酒时间的影响。
1.3.5 正交试验设计
在单因素试验的基础上,以pH值(A)、总接种量(B)、发酵时间(C)、接种比例(植∶副)(D)为试验因素,以黄酮含量(R)和醉醒酒时间(S)为评价指标,运用L9(34)正交设计试验配合多指标综合加权评分法,优选出最佳的发酵工艺,方差分析因素与水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.3.6 解酒防醉实验
取SPF级ICR雄性小鼠若干只,适应性饲养7 d后,按照单因素试验条件随机分为模型组、不发酵提取液组、空白发酵组(不加药材只加菌)、发酵提取液组(不同起始条件的发酵提取液),禁食不禁水12 h后,给药组分别灌胃相应药物(0.075 mL/10g),模型组灌胃等剂量纯水。30 min后,每组各灌胃56°白酒(0.125 mL/10g),分别观察并记录每组小鼠醉酒潜伏期(灌酒-翻正反射消失的时间)和醒酒时间(翻正反射消失-翻正反射恢复的时间)[14-15]。
1.3.7 生物指标检测
1.3.7.1 预处理
取适应性饲养7 d后SPF级ICR雄性小鼠70只,随机分为空白组、模型组、阳性对照组(葛根五味子片)、葛根-枳椇子不发酵组、葛根-枳椇子发酵组(低、中、高剂量),空白组和模型组纯水(0.15 mL/10g)灌胃,其他给药组给予相应药物灌胃阳性组(5 mg/10g)、不发酵组(15 mg/10g)、葛根-枳椇子发酵提取液低剂量组(7.6 mg/10g)、葛根-枳椇子发酵提取液中剂量组(15 mg/10g)、葛根-枳椇子发酵提取液高剂量组(23 mg/10g),30 min后,除空白组灌胃纯水外,其他组均灌胃56°酒(0.08 mL/10g),连续8 d[16-18]。灌酒30 min后取血,脊椎脱臼法处死小鼠,解剖取肝脏,在预冷的培养皿中,用生理盐水洗净后,清除水分,锡纸包裹,冻入液氮[19]。
1.3.7.2 小鼠血清指标检测
末次给药后,摘眼球取血,4 ℃静置30 min,4 ℃离心(3 000 r/min、10 min),取上清液得血清,参照试剂盒说明书测定7组小鼠血清中ALT、AST、IL-6、TNF-α等指标。
1.3.7.3 肝脏匀浆指标检测
称取0.1 g肝脏组织,加入9倍体积的生理盐水,在预冷的研钵中充分研磨制成匀浆,4 ℃、3 000 r/min离心10 min,取上清液得10%组织匀浆,参照试剂盒说明书测定7组小鼠肝脏中SOD水平。
1.4 实验数据统计与处理
每组实验重复3次,实验数据均用平均值±标准差(Mean±SE)表示;采用GraphPad Prism 8.0.1进行误差分析和差异显著性分析以及绘图;用IBM SPSS Statistics 21.0设计正交试验以及方差分析。
2 结果与分析
2.1 提取方法比较
由图1可知,使用醇提取的药液延长醉酒潜伏时间的效果优于水提取的药液,并且使用醇提取的药液缩短翻正反射恢复时间的效果也优于水提取的药液。推测原因可能是大部分黄酮类化合物相对于水而言,用有机溶剂更容易提取出来。因此,试验最佳的提取方法是醇提。
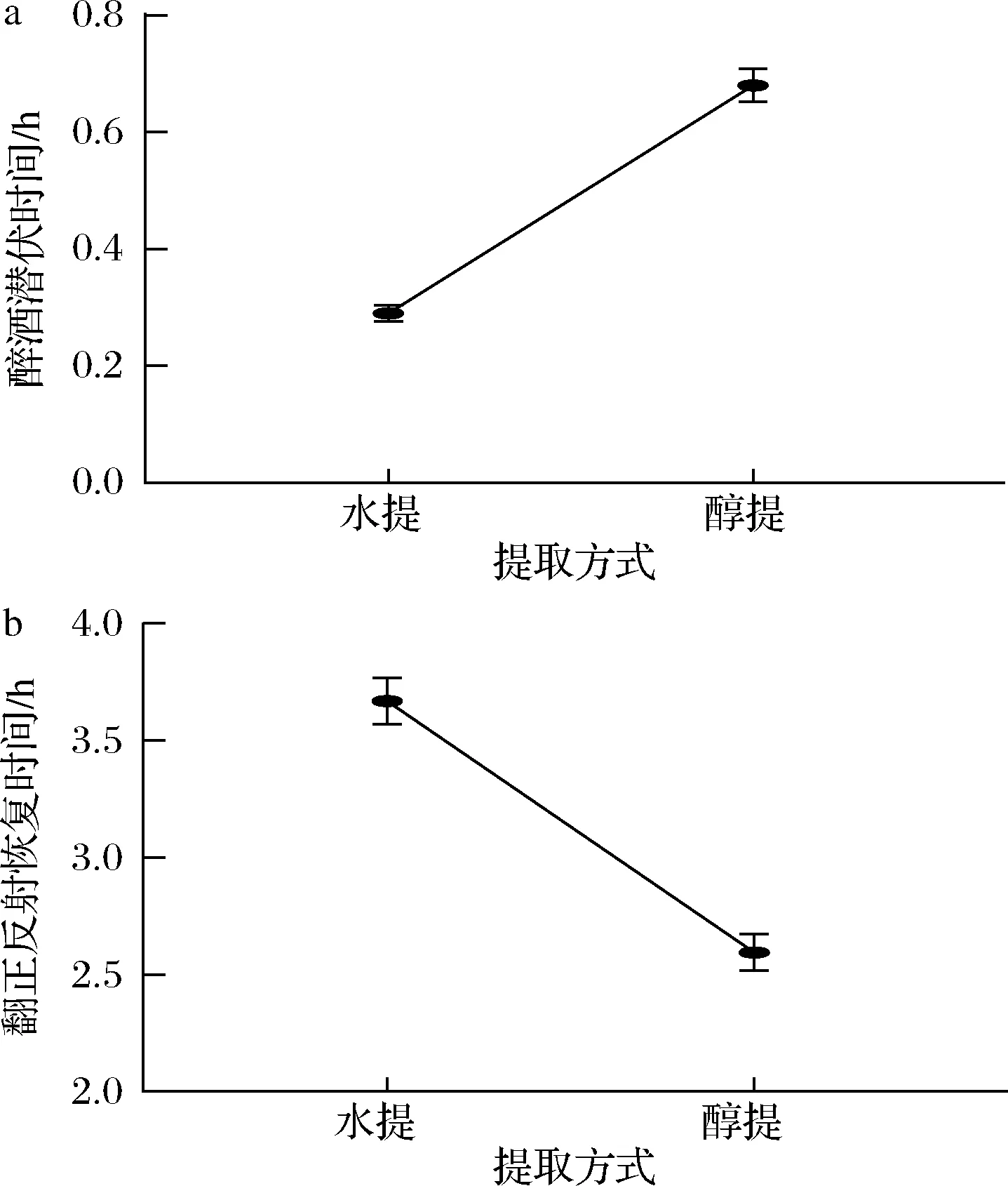
a-解酒潜伏时间;b-翻正反射恢复时间图1 不同提取方法对解酒防醉时间的影响Fig.1 Effect of different extraction methods on anti drunkenness time
2.2 单因素试验
2.2.1 起始pH和总接种量对黄酮含量的影响
由图2可知,随起始pH值和总接种量升高黄酮含量先升高后降低,在pH为6.5时黄酮含量最高。原因可能是,强酸弱酸都会抑制乳酸菌的生长代谢;而总接种量达到3%(质量分数)之后黄酮含量与总接种量呈反比例关系,推测原因可能是菌密度过大,乳酸菌的繁殖代谢等活动受到生长空间等因素的影响而衰减。

a-pH值;b-总接种量图2 pH值和总接种量对黄酮含量的影响Fig.2 Effects of pH value and total inoculation amount on favonoids content
2.2.2 发酵时间和接种比例对黄酮含量的影响
由图3可知,黄酮含量在48 h时最高,在过了峰值48 h之后与发酵时间呈负相关,原因可能是在48 h 前乳酸菌处于生长期,过了48 h生长过盛,导致营养物质供不应求,使黄酮含量降低;当两种菌株接种比例过高或者过低时,黄酮含量都比较低,接种比例(体积比)(植∶副)=1∶2时,黄酮含量最高。

a-发酵时间;b-接种比例图3 发酵时间和接种比例对黄酮含量的影响Fig.3 Effects of fermentation time and inoculation ratio on flavonoids content
2.2.3 起始pH对醉酒醒酒时间的影响
由表2可知,延长醉酒潜伏时间的效果随起始pH的升高呈先升高再降低的趋势,在pH为6.5时达到峰值;缩短翻正反射恢复时间的效果随起始pH值的升高呈先降低再升高的趋势,在pH为4.5时达到峰值。
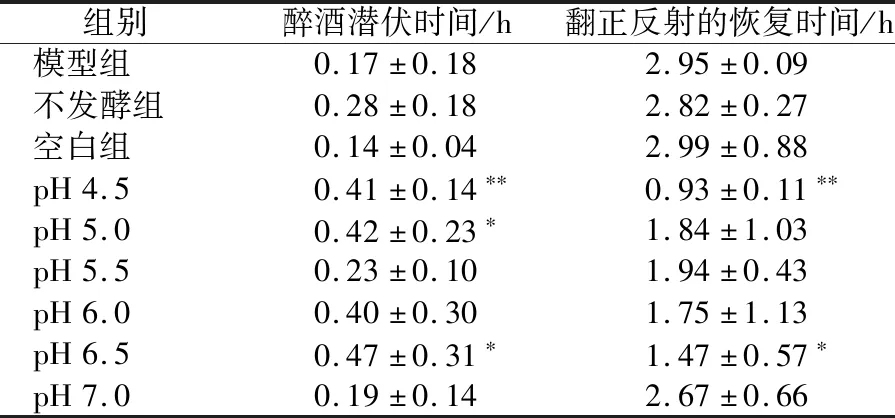
表2 pH值对醉酒醒酒时间的影响Table 2 Effect of pH value on sobering time
2.2.4 乳酸菌总接种量对醉酒醒酒时间的影响
由表3可知,延长醉酒潜伏时间的效果在总接种量在3%之前逐渐上升,在6%达到峰值,随后呈下降趋势;缩短翻正反射恢复时间的效果随总接种量的升高呈降低的趋势,在总接种量为2%时达到峰值。

表3 总接种量对醉酒醒酒时间的影响Table 3 Effect of total inoculum volume on drunken waking time
2.2.5 发酵时间对醉酒醒酒时间的影响
由表4可知,延长醉酒潜伏时间的效果在48 h达到峰值;缩短翻正反射恢复时间的效果与发酵时间呈反比例关系,在发酵时间为36 h时达到峰值。

表4 发酵时间对醉酒醒酒时间的影响Table 4 Effect of fermentation time on drunkenness and sobering time
2.2.6 接种比例对醉酒醒酒时间的影响
接种比例对延长醉酒潜伏时间的影响如表5所示,结果表明,植物乳杆菌与副干酪乳杆菌比例在2∶1时效果最好,乳杆菌(植∶副)接种比例=1∶1时,缩短翻正反射恢复时间的效果最好。

表5 接种比例对醉酒醒酒时间的影响Table 5 Effect of inoculation proportion on drunkenness and sobering time
2.3 正交试验设计
在单因素试验的基础上,以起始pH值(A)、总接种量(B)、发酵时间(C)、接种比例(植∶副)(D)为评价因素,根据因素影响发酵工艺效果的重要程度分配权重系数。即黄酮含量(W1)的权重系数为0.7,醉酒潜伏期(W2)的权重系数为0.15,醒酒时间(W3)的权重系数率为0.15进行加权求和,综合加权评价结果见表6和表7[20]。

表6 发酵条件优化正交试验结果与分析Table 6 Results and analysis of orthogonal tests for optimization of fermentation conditions

表7 正交试验结果方差分析Table 7 Analysis of variance of orthogonal test results
根据正交试验结果极差分析,发酵工艺影响黄酮含量的主次因素为C(发酵时间)>A(pH值)>B(总接种量)>D(接种比例),以黄酮含量为主要指标发酵条件的最佳组合是A3B1C1D3。即最佳发酵工艺为pH 7,总接种量2%,接种比例(植:副)2∶1,发酵时间36 h。方差分析结果显示,A、B和C因素起始pH值、总接种量和发酵时间显著(P<0.05)影响黄酮含量,D因素接种比例对黄酮含量影响不显著(P>0.05)。
2.4 验证试验
最佳条件下,进行平行试验3次,黄酮含量依次为3.627、3.698、3.760 mg/g,平均值为3.70 mg/g,相对标准偏差(relative standard deviation,RSD)1.8%(RSD<5%),较发酵前提升了33%,故此发酵工艺设计合理。
2.5 血清指标检测
如图4所示,根据给药8 d后小鼠血清中转氨酶水平的检测,与空白组相比,连续灌胃酒精8 d后的模型组的小鼠血清中ALT、AST活性极显著升高,IL-6、TNF-α含量显著和极显著升高(P<0.05和P<0.01),表明酒精性肝损伤造模成功;与模型组相比,灌胃阳性药和葛根-枳椇子高剂量发酵提取液的小鼠血清AST活性极显著降低(P<0.01);灌胃阳性药、葛根-枳椇子低、中、高剂量发酵提取液的小鼠血清ALT活性极显著降低(P<0.01);灌胃不发酵提取液和葛根-枳椇子低、中、高剂量发酵提取液的小鼠血清IL-6含量极显著降低(P<0.01);灌胃阳性药、不发酵提取液、葛根-枳椇子低、中、高剂量发酵提取液的小鼠血清TNF-α含量极显著降低(P<0.01),表明葛根-枳椇子发酵提取液能减轻酒精对肝脏的损伤,其中葛根-枳椇子发酵提取液效果均优于不发酵组,且高剂量组效果最优。
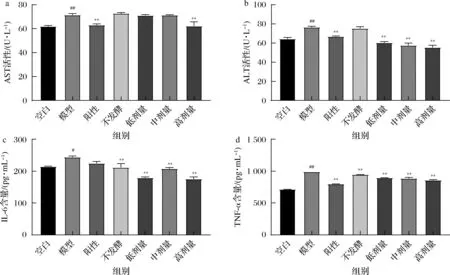
a-AST;b-ALT;c-IL-6;d-TNF-α图4 小鼠血清AST、ALT活性检测及IL-6、TNF-α含量检测结果Fig.4 Detection of serum AST and ALT activities and IL-6 and TNF-α in mice Content test results注:#P<0.05表示与空白组比较,具有显著性差异,##P<0.01表明与空白组比较,具有极显著性差异;*P<0.05表示与模型组比较,具有显著性差异,**P<0.01表明与模型组比较,具有极显著性差异(下同)
2.6 肝脏SOD活力检测
如图5所示,根据给药8 d后小鼠肝脏的抗氧化酶水平的检测,与空白组相比,连续酒精灌胃8 d后的模型组的小鼠肝脏SOD活性极显著降低(P<0.01);与模型组相比,灌胃阳性药和葛根-枳椇子低、中、高剂量发酵提取液的小鼠肝脏SOD活性显著或极显著降低(P<0.05或P<0.01),其中葛根-枳椇子发酵提取液效果均优于不发酵组,且高剂量组效果最优。

图5 小鼠肝脏SOD活力检测结果Fig.5 Detection results of SOD activity in mouse liver
3 结果与讨论
本实验首次运用两种可用于普通食品的乳酸菌(植物乳杆菌、副干酪乳杆菌)混合发酵葛根-枳椇子,考察其发酵前后黄酮含量变化的同时还运用多指标加权评分法对小鼠耐酒醒酒时间的变化进行分析,使其可行性更高。由优化发酵工艺条件的正交试验结果得,葛根-枳椇子的最佳发酵工艺条件为pH 7,总接种量2%(质量分数),接种比例(体积比)(植∶副)2∶1,发酵时间36 h。与发酵前比较,黄酮含量提升了33%;与模型组比较,发酵前后的醉酒潜伏时间分别延长了64.7%和51.7%,发酵前后的翻正反射恢复时间提前了29.2%和37.1%,减轻了肝损伤引起的小鼠血清中AST、ALT、IL-6和TNF-α水平升高,同时提升了小鼠肝脏的SOD活力。结果表明,与发酵前相比,两种菌混合发酵后的药物确实显著提高了解酒护肝的功效(P<0.05)。可见,葛根-枳椇子的混合发酵可以提升药物中黄酮类化合物的含量,加强解酒能力,极大程度的改善由酒精导致的肝损伤。基于文献大都认可黄酮是解酒保肝的主要活性成分,因此我们主要对黄酮类化合物的成分变化来进行研究,其成分分析也是我们下一阶段将进行的研究。

