空间效应对超声辅助浸渍冻结鱼肉冻藏品质的影响
袁海洲,柯志刚,徐霞,周绪霞,丁玉庭*
1(浙江工业大学 食品科学与工程学院,浙江 杭州,310014)2(浙江省深蓝渔业资源高效开发利用重点实验室,浙江 杭州,310014)3(国家远洋水产品加工技术研发分中心(杭州),浙江 杭州,310014)4(海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁 大连,116034)
冷冻作为目前最常用的食品保存方法,可实现食品的营养、风味和感官特性长时间高保真保存。冷冻保存食品的原理为,在冻结过程中及冷冻状态下,食品中的水分结晶形成冰晶,降低了食品的水分活度,从而使得内源酶活力和寄生其中的微生物的增殖受到抑制,最终达到延长食品保质期的目的[1]。但传统冻结方式,如鼓风冻结、平板接触冻结等,热传导速率小,冻结速度较慢,造成形成的冰晶体积大、形状无规则且分布不均匀。这种无规则且大体积的冰晶会引起细胞的机械损伤,造成食品解冻时汁液流失和营养物质损失。因此,提高食品冻结速度,从而减小冰晶尺寸、调节冰晶形状与分布(圆形且分布均匀),这对提高冷冻食品品质至关重要。
超声是指频率为20~10 000 kHz的声波,根据其频率和能量的不同分为高能低频(20~100 kHz)、高能中频(100~1 000 kHz)及低能高频(5~10 MHz)3种类型[2]。在食品分析与加工领域,不同频率的超声有不同应用,其中低能超声主要用于食品物化特性的无损检测,高能超声可用于改变食品的物化性质,如细胞破碎、乳状液制备、钝酶、改变结晶过程等[3]。1974年,MILES等[4]研究发现在食品冻结过程中同时施加一定频率的超声处理可显著减小冰晶尺寸,改善冻品的品质。近年来,越来越多的研究显示,超声辅助处理可减小食品冻结过程中形成的冰晶尺寸,使其细小且分布均匀,从而减小冻品解冻时的汁液流失和蒸煮损失,保护食品的色、香、味及营养价值,显著提高冻品品质[3]。例如,SUN等[5]比较了超声辅助浸渍冻结(ultrasound-assisted immersion freezing,UIF)、空气冻结(air freezing,AF)和浸渍冻结(immersion freezing,IF)对冻藏期间鲤鱼块的冰晶尺寸、蛋白质热稳定性以及物理化学特性等的影响和差异。他们发现,与AF和IF相比,UIF样品冰晶小且分布均匀,结合水与自由水的流动性减小,解冻后汁液流失和蒸煮损失降低,蛋白质热稳定性提高,贮藏期间的脂质氧化程度减小,冻品品质得到了明显提高。SHI等[6]也发现一定强度的超声协同处理显著减小了草鱼块在IF过程中的总冻结时间及相变时间,有效保护了肌肉纤维结构,减小了解冻后汁液流失。
由于超声的传播需要液体作为介质,因此目前绝大部分UIF都是在IF过程中施加一定强度的超声协同处理。已有的UIF研究中,超声换能器一般都置于超声装置的底部,且样品置于超声腔体的固定位置。但由于介质中存在粒子、气泡等阻碍物,会造成超声波发生散射衰减,且当声波传播距离较大及一定黏度介质吸收超声能量时还会发生吸收衰减和扩散衰减[7]。由于上述超声波在液体介质中传播时的衰减,不同位置的超声强度可能存在一定差异,由此可能造成不同位置UIF的冻结速度和冻品品质存在差异。但目前尚没有关于空间位置对UIF食品品质影响的相关研究报道。本研究基于实验室定制的超声装置,以鲢鱼块为对象,探究空间位置对UIF冻结速度和鱼肉品质的影响。相关研究结果将为该技术在食品冻结保存中的应用提供指导和理论参考。
1 材料与方法
1.1 材料与试剂
材料:新鲜鲢鱼,杭州市下城区朝晖菜市场,均重(6±1.5) kg。宰杀后去头、去尾、去皮、去骨并洗净,取背部肌肉顺纤维方向横切成约3 cm×3 cm×2 cm的鱼块,用聚乙烯薄膜包裹后置于4 ℃ 冰箱中预冷备用。
试剂:丙二醇、乙醇、磷酸氢二钠、磷酸二氢钠、NaCl、Tris、HCl、KCl、5,5′-二硫代双(2-硝基苯甲酸) [5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、2,4-二硝基苯肼、乙酸乙酯、盐酸胍、氧化镁、硫代巴比妥酸、三氯乙酸(trichloroacetic acid,TCA)、尿素、氯化钙、三磷酸腺苷二钠、钼酸胺、对苯二酚、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、1,1,3,3-四乙氧基丙烷(1,1,3,3-tetraethoxylpropane,TEP)、硼酸、苏木素染液与伊红染液等(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
QHAUSAR2130电子天平,美国Adventurer公司;DW-6050低温恒温反应浴,杭州大卫仪器有限公司;L93-4L热电偶温度计,中国路普公司;UV762紫外可见分光光度计,上海仪电分析仪器有限公司;CR21GⅡ 高速离心机,日立Hitachi公司;HR2860型飞利浦打浆机,德国飞利浦有限公司;海能K9840自动凯氏定氮仪,济南海能仪器股份有限公司;DW2000超声仪,宁波新芝生物科技股份有限公司;J-715圆二色谱分光光度计,日本Jasco公司。
1.3 实验方法
1.3.1 前处理
实验所用的UIF装置如图1所示。低温反应浴中盛有自配载冷剂(8%食盐+44%水+24%丙二醇+24%乙醇),将其温度降至(-35±3) ℃后泵入右侧超声处理装置,载冷剂在二者之间循环。超声装置底部均匀安装有6个超声波换能器,4个侧面各安装2个换能器。将样品篮放入超声槽中,在篮子的中心位置选取轴向3个不同位置为实验位点,分别距超声槽底部1、11和21 cm。

1-数据采集电脑;2-数据记录仪;3-K 型热电偶;4-超声控制面板;5-置物篮;6-超声波换能器;7-超声波发生器;8-制冷循坏泵;9-超声装置;10-搅拌器;11-低温反应浴图1 UIF装置示意图Fig.1 Schematic diagram UIF device
1.3.2 超声强度测定
参考XIN等[8]的方法。向超声装置中注入一定体积的超纯水,对其进行超声处理。处理条件如下:频率为20 kHz,60 s开/60 s关模式,处理时间为4 min,功率设定为100、140、180、220、260和300 W。使用L93-4L K型热电偶记录上述不同位置温度的变化值,不同位置的超声强度计算如公式(1)、公式(2)所示:
(1)
(2)
式中:Pus,实际超声功率,W;m,液体质量,kg;Cp,液体的比热容,J/(kg·℃);ΔT/t,温度-时间曲线的初始斜率,℃/s;Ia,声强,W/cm2;A,超声装置横截面积,m2。
1.3.3 冻结曲线绘制
将4 ℃预冷的鲢鱼鱼块放置在1.3.1所述轴向3个不同位点进行浸渍冻结,当样品中心温度降至0 ℃时开启超声,按照 60 s开/60 s关模式,处理时间为4 min。超声频率为20 kHz,功率为180、220、260及300 W。在鱼块冻结过程中,将L93-4L K型热电偶探头插入鱼块的几何中心位置,每隔5 s记录1次温度值,绘制冻结曲线。当样品中心温度为-18 ℃时取出并置于-18 ℃冰箱中冻藏,对冻藏过程中样品指标进行测定。
1.3.4 冰晶形态观察
将切鱼肉的工具预冷,将冻藏90 d样品切成长宽各1 cm,厚约5 mm的鱼片,在其周围滴上OCT(optimal cutting temperature compound)包埋剂,在冷冻切片机的速冻台上进行包埋,包埋后切成厚度为6 μm的样品。然后用Mayer氏苏木素染液染色5 min,自来水浸洗返蓝后用1%水溶性伊红染液再染色5 min,制作好的切片在光镜下观察并拍照,利用ImageJ软件对图片进行分析。
1.3.5 持水性测定
持水性用汁液流失率和蒸煮损失率表示,其测定参考樊震宇等[9]所述方法。取冻藏一定天数的鲢鱼,其质量为W1,解冻后用滤纸吸去表面水分,其质量为W2。汁液流失率计算如公式(3)所示:
(3)
式中:X1,汁液流失率,%;W1,解冻前样品质量,g;W2,解冻后样品质量,g。
取解冻后样品,用吸水纸吸干表面水分后称得其质量为W3,将样品用聚乙烯包装袋密封后在85 ℃ 水浴锅中蒸煮15 min,取出后冷却至室温,用滤纸吸干表面水分后其质量为W4。蒸煮损失率计算如公式(4)所示:
(4)
式中:X2,蒸煮损失率,%;W3,蒸煮前样品质量,g;W4,蒸煮后样品质量,g。
1.3.6 肌原纤维蛋白的提取
参照SUN等[10]所述方法并经适当修改。称取2.0 g搅碎的鱼肉,加入20 mL缓冲液A(20 mmol/L磷酸盐缓冲液,pH = 7,含有0.1 mol/L NaCl,1 mmol/L EDTA),15 000 r/min均质60 s,然后在4 ℃ 下离心10 min(6 000 r/min)。去上清液,重复上述操作2次。将所得沉淀溶解于10 mL缓冲液B(20 mmol/L磷酸盐缓冲液,pH = 7.2,含有0.6 mol/L NaCl),4 500 r/min离心20 min后过滤收集上清液,此步骤重复2次所得滤液即为肌原纤维蛋白溶液。利用双缩脲法对蛋白质浓度进行测定。
1.3.7 总巯基含量测定
参照SUN等[11]的方法并稍作修改。取1 mL肌原纤维蛋白溶液(2.0 mg/mL),加入9 mL Tris-HCl缓冲液(0.02 mol/L,pH = 7.2,内含10 mmol/L EDTA,0.6 mol/L KCl,8 mol/L尿素,2% 十二烷基硫酸钠),并混合均匀。取4 mL混合液并加入0.4 mL 0.1%的DTNB溶液,25 ℃水浴30 min后测定其在412 nm处吸光度,用ε=13 600 mol/(L·cm)计算总巯基含量。
1.3.8 羰基含量测定
根据ZHANG等[12]的方法并经适当修改。取1 mL肌原纤维蛋白溶液(2.0 mg/mL)于离心管中,再向其中加入1 mL溶解于2 mol/L HCl的 2,4-二硝基苯肼溶液(10 mmol/L),黑暗、室温环境下静置1 h(每隔10 min漩涡1次),然后加入1 mL TCA(体积分数20%),4 ℃下10 000 r/min离心15 min。弃上清液,用1 mLV(乙酸乙酯)∶V(乙醇)=1∶1洗涤沉淀3次,除去未反应的试剂。向沉淀中加入4 mL盐酸胍溶液(6 mol/L,溶于20 mmol磷酸盐缓液,pH=6.5),37 ℃ 溶解20 min,对样品在370 nm处吸光度进行测定。用ε=22 000 mol/(L·cm)计算羰基含量。以2 mol/L HCl代替2,4-二硝基苯肼溶液作为对照。
1.3.9 Ca2+-ATPase活性的测定
参照GUO等[13]的方法,略有改动。取4 mL肌原纤维蛋白液(2.0 mg/mL),依次加入1 mL CaCl2(0.05 mol/L),1 mL KCl(4 mol/L)及1.5 mL三磷酸腺苷二钠(6.67 mol/L),28 ℃水浴保温30 min后立即加入1 mL 15%的TCA终止反应,空白组自反应开始时加入1 mL 15%的TCA。反应终止后用滤纸过滤,滤液定容至100 mL。用钼酸铵比色法对释放的无机磷含量进行测定。肌原纤维蛋白Ca2+-ATPase活性以每分钟每毫克肌原纤维蛋白所释放的无机磷的量表示。
1.3.10 蛋白质二级结构的测定
参考SUN等[11]的方法稍作修改。使用J-715圆二色谱分光光度计(日本Jasco公司)分析蛋白质二级结构的变化。将1.3.6节提取的肌原纤维蛋白溶液的质量浓度稀释至0.2 mg/mL后将其转移到1 mm石英管中。参数设定如下:响应时间为0.25 s,在200~260 nm扫描,扫描速率为100 nm/min,每个样品重复测定3次,利用CD pro软件分析二级结构含量。
1.3.11 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
采用SUN等[5]的方法并稍作修改。取搅碎的鱼肉2.0 g,加入20 mL 7.5% 的TCA(含0.1% EDTA)并振荡30 min,然后在4 000 r/min,4 ℃下离心10 min,室温下过滤。取5 mL滤液并加入5 mL硫代巴比妥酸溶液(0.02 mol/L),90 ℃水浴40 min后冷却至室温,对其在532 nm处吸光度进行测定。用TEP作标准曲线计算TBARS含量。
1.3.12 挥发性盐基氮(total volatile basic nitrogen,TVB-N)测定
参照GB 5009.228—2016方法进行测定。
1.3.13 数据分析
实验中所有指标均测定3次,结果以平均值±标准差的形式表示。采用SPSS 22对数据进行统计分析。采用ImageJ软件分析冰晶的大小,CD pro软件分析蛋白质二级结构,采用Origin 2018软件制图。
2 结果与分析
2.1 空间效应对超声强度的影响
空间位置对UIF的影响正是由于不同位置处超声强度不同所致。超声处理过程中,换能器将电能装换为机械能,后者振动形成的超声波在介质中传播并发生一定程度的衰减。本研究中,自配载冷剂即为传波介质,其在不同位置处黏度、密度相同,且其中粒子或气泡等阻碍物影响较小,因此超声波的衰减主要由扩散衰减导致,而散射衰减与吸收衰减可忽略[7]。图2显示了在20 kHz、0~300 W功率下,超声装置中距离底部1、11、21 cm,即上部、中部和下部3个不同位置的超声强度。由图2可知,随着功率的增加,超声强度也明显增大。例如在底部,当功率为100 W时,其超声强度为0.140 W/cm2,如果超声功率增加到300 W,则其强度增加至0.700 W/cm2。在轴向不同位置,超声强度自下而上呈一定程度的衰减,如在220 W下,下部、中部、上部的超声强度分别为0.436、0.401、0.392 W/cm2。

图2 不同功率及不同位置下的超声强度Fig.2 Ultrasonic intensity at different position with different power
2.2 空间效应对UIF冻结速度的影响
功率是影响UIF冻结速度和冻品品质的重要因素[14]。为比较空间位置对UIF冻结速度和鱼肉品质的影响,首先需确定最适超声功率。将样品置于超声槽下部,对其在冻结过程中施加不同功率(180、220、260及300 W)的超声处理,利用K型热电偶对样品在冻结过程中的中心温度进行记录(图3-a),并对样品通过最大冰晶生成带的时间(-1~-5 ℃)和总冻结时间(中心温度降低至-18 ℃)进行了统计(表1)。由图3可知,鲢鱼的冻结过程呈典型的三阶段。第1阶段为冷却过程,只除去食品中的显热,降温较快;第2阶段为中心温度从食品的冻结点(约-1 ℃)降低至-5 ℃左右,此阶段食品中大部分水结成冰,放出大量的潜热,降温速度比较慢;第3阶段为中心温度从-5 ℃左右降至终温,此时放出的热量一部分由于冰的降温,另一部分是由于残留的少量水继续结冰,降温较快[15]。其中第2阶段(-1~-5 ℃),即通过最大冰晶生成带,其时间的长短显著影响形成的冰晶的大小和形态。时间越短,形成的冰晶越细小,分布越均匀,对冻品造成的机械损伤也越小[16]。由图3-a和表1可知,与对照组相比,不同功率超声协同处理均显著减小了样品在冻结过程中通过最大冰晶生成带的时间和总冻结时间。例如,在对照组和180、220、260及300 W超声协同处理下,样品通过最大冰晶生成带的时间和总冻结时间分别为(395±35)、(284±8)、(261±17)、(289±28)、(299±22)和(820±55)、(645±25)、(620±41)、(671±54)、(685±39) s。超声协同处理提高浸渍冻结速度是由于超声的空化效应和微射流作用。超声在液体介质中的传播会产生空化气泡,这些空化气泡因膨胀而破裂,在破裂瞬间会释放巨大的能量,局部会产生数个GPa的压力,并伴随产生微射流和冲击波[14]。空化气泡和微射流作用加快了传热传质过程,从而加速了冰晶的形成。并且,其也会破坏形成的冰晶形成细小碎片,后者能够作为晶核诱使新的冰晶的生成,从而有效减小了形成的冰晶的尺寸[17]。由表1结果可知,在220 W超声协同处理下,样品通过最大冰晶生成带的时间和总冻结时间均最短,因此,在后续研究中,选定此功率为实验功率。

表1 鲢鱼在IF和不同功率下UIF的相变时间及总冷冻时间Table 1 Phase transition time and total freezing time of silver carp during IF and UIF with different power
底部IF和不同位置UIF冻结曲线和样品通过最大冰晶生成带的时间、总冻结时间分别如图3-b和表2所示。上部、中部、下部UIF样品通过最大冰晶生成带的时间分别为(288±19)、(270±22)和(261±17) s,分别较IF组减小了27.1%、31.6%和33.9%,而总冻结时间分别较IF组减小22.2%、23.8%和24.4%。其中,下部UIF样品通过最大冰晶生成带的时间最短,较上部减小9.4%,较中部减小3.3%,此结果与前述超声强度的结果基本一致,表明在本研究所用超声槽及超声功率(220 W)下,超声强度自下而上的衰减对样品的浸渍冻结速度有一定影响。

a-鲢鱼IF和不同功率UIF冻结曲线;b-鲢鱼IF和不同位置UIF冻结曲线图3 鲢鱼IF和不同功率及不同位置UIF的冻结曲线Fig.3 Freezing curves of silver carp during IF and UIF with different power or at different position

表2 鲢鱼在IF和不同位置下UIF的相变时间及总冷冻时间Table 2 Phase transition time and total freezing time of silver carp during IF and UIF at different position
2.3 空间效应对UIF鲢鱼冰晶形态的影响
为探究空间位置对UIF鱼体中冰晶形态的影响,本研究对不同位置UIF鲢鱼在-18 ℃贮藏90 d后的冰晶形态进行了观察,结果如图4所示。图4中,粉红色代表肌肉纤维,白色孔洞代表冰晶留下的空隙。由图4可知,底部IF组白色空隙明显大于UIF组,且肌纤维分布较为分散。与IF相比,UIF组冰晶细小,分布均匀,肌纤维保持相对完整的结构。SUN等[5]发现在175 W超声功率下,UIF猪肉经冻藏0 d后的冰晶平均直径为21.47 μm,远小于AF和IF组的37.73 和26.55 μm,且在-18 ℃贮藏180 d后,UIF样品的冰晶分布依然规则均匀。刘宏影[18]以海鲈鱼为对象的研究也证实超声辅助处理显著减小了IF样品中冰晶尺寸,其机制正是由于超声提高了冻结速度,有效减小了样品通过最大冰晶生成带的时间。
为进一步明确不同位置UIF样品冰晶大小的差异,对各组样品冰晶的面积和当量直径进行了统计分析,结果如表3所示。IF组冰晶面积及当量直径分别为 (1 282.9±158.2) μm2和(40.4±3.3) μm,而上部、中部、下部UIF组则分别为(688.3±52.1)、(670.4±75.3)、(648.5±73.6) μm2和 (29.6±1.3)、(29.2±2.7)、(28.7±2.6) μm。虽然底部、中部、上部UIF样品的冰晶面积和当量直径逐渐增大,但均无显著性差异(P>0.05)。该结果与表2结果基本一致,也表明在本研究所用的UIF装置中,空间位置对鱼肉在IF过程中形成的冰晶大小有一定影响,但并不显著。

a-IF;b-上部UIF;c-中部UIF;d-下部UIF图4 IF和不同位置UIF鲢鱼在-18 ℃下冻藏90 d后冰晶形态观察(×200)Fig.4 The morphology of ice crystal of silver carp frozen by IF and UIF at different spatial position after storage at -18 ℃ for 90 d(×200)

表3 IF和不同位置UIF鲢鱼冻藏过程中冰晶大小变化Table 3 Changes in the average area and diameter of ice crystals of silver carp frozen by IF and UIF at different position during frozen storage
2.4 空间效应对UIF鲢鱼汁液流失率及蒸煮损失率的影响
肉类及水产食品解冻过程中,由于内部的冰晶融化成水并且无法被肌肉全部吸收,因此会有部分水分流失形成汁液流失。流失的汁液中除了水分外,还包括蛋白质、无机盐和一些维生素等营养物质。汁液流失率过高会引起可溶性营养成分减少,组织结构发生变化,口感变差,最终引起产品质量的下降[18]。底部IF和不同位置UIF鲢鱼在-18 ℃冻藏90 d内的汁液流失率如图5-a所示。随着贮藏时间的延长,各组样品的汁液流失率均增加。对照组贮藏90 d后,其汁液流失率由贮藏0 d的(1.02±0.10)% 增加至(6.63±0.41)%。与对照组相比,UIF组汁液流失率明显减小。在贮藏90 d时,上部、中部、下部UIF样品的汁液流失率分别为(5.37±0.23)%、(5.24±0.18)%和(5.20±0.29)%,均显著低于对照组(P<0.05)。超声协同处理减小冻品汁液流失率是由于其提高了冻结速度,减小了样品通过最大冰晶生成带的时间,使得冰晶尺寸和体积减小,分布均匀,因此对鱼体肌肉的机械损伤减小[15]。在整个贮藏期内,上部、中部、下部UIF样品的汁液流失率均没有显著性差异,这表明空间位置对其影响较小。
加热使肌原纤维变性而引起肌肉结构性损伤,从而导致其中水分和可溶性物质的损失,即蒸煮损失,其对产品的外观、营养价值等都有较大影响,对冷冻水产品品质评价有重要意义[19]。与汁液流失类似,在冷冻过程中冰晶的生长会挤压相邻的肌原纤维,损坏排列紧密的肌肉组织,使得肌肉保水力下降,蒸煮损失率提高[5]。不同样品的蒸煮损失率如图5-b所示。随着冻藏时间的延长,各组样品的蒸煮损失率均增加。但在整个贮藏期内,UIF组始终低于IF组(P<0.05),这是由于冰晶尺寸影响了肌肉与水的结合能力。在第90天时,下部UIF样品的蒸煮损失率最小为(14.58±0.38)%,与IF组相比降低了18.46%,而上部及中部UIF样品则分别为(14.85±0.54)%和(15.38±0.62)%。这些结果显示,空间位置虽然对样品的蒸煮损失率有一定影响,但差异并不显著。

a-汁液流失率;b-蒸煮损失率图5 IF和不同位置UIF鲢鱼的汁液流失率及蒸煮损失率变化Fig.5 Change of the juice loss rate and cooking loss rate of silver carp frozen by IF and UIF at different spatial position during frozen storage
2.5 空间效应对鲢鱼蛋白质稳定性的影响
IF及不同位置UIF鲢鱼冻藏60 d后的圆二色谱如图6-a所示。不同位置UIF样品在220 nm处都有一特征峰,而IF样品在197 nm处有一特征峰,二者分别代表α-螺旋和无规卷曲,这表明UIF样品和IF样品的蛋白质二级结构有明显区别。相对定量分析结果显示(图6-b),与IF样品相比,UIF样品的α-螺旋和β-转角含量明显更高,而代表着蛋白质无序、松散结构的β-折叠和无规则卷曲含量则明显更低。例如,IF样品的α-螺旋、β-转角、β-折叠及无规则卷曲分别为50.1%、15.8%、18.9%及14.2%,底部UIF样品则分别为57.3%、20.1%、14.1%和8.5%。LYU等[20]研究发现α-螺旋是肌球及肌原纤维蛋白主要的二级结构,这表明UIF样品保持了更多的鱼肉蛋白原本的结构。

a-CD谱;b-各种二级结构含量图6 IF和不同位置UIF鲢鱼的二级结构分析Fig.6 Secondary structure of protein of silver carp frozen by IF and UIF at different spatial position during frozen storage
Ca2+-ATPase 活性反映了肌原纤维蛋白的变性状况,也是常用的鱼肉蛋白质变性指标[21]。IF和不同位置UIF样品在贮藏过程中Ca2+-ATPase活性变化如图7所示。由图7可知,在0~90 d冻藏期内,各样品的Ca2+-ATPase 活性均呈下降趋势。各样品初始Ca2+-ATPase活性为0.80~0.82 μmol Pi/(min·mg蛋白质),冻藏30 d后,各组之间无显著性差异(P>0.05)。若进一步延长贮藏期至60或90 d,IF样品Ca2+-ATPase活性下降速度明显快于UIF样品。冻藏90 d时,IF样品Ca2+-ATPase活性为(0.387±0.012) μmol Pi/(min·mg蛋白质),而不同位置UIF样品中上部样品的Ca2+-ATPase活性最低,但仍高IF样品12.0%。

图7 IF和不同位置UIF鲢鱼冻藏期间Ca2+-ATPase活性Fig.7 Activity of Ca2+-ATPase of silver carp frozen by IF and UIF at different spatial position during frozen storage
综合图6和图7结果可知,超声协同处理可以有效保护IF鱼肉蛋白质结构,其机制正是由于超声处理有效减小了冰晶的尺寸,减小其对细胞的损伤,提高了冷冻后鱼肉蛋白质的稳定性[11]。不同位置UIF样品各二级结构含量及Ca2+-ATPase活性均无显著性差异,表明空间位置对UIF鲢鱼蛋白质稳定性无明显影响。
2.6 空间效应对UIF鲢鱼蛋白质氧化的影响
巯基是蛋白质中重要的活性基团,易与各种活性氧基团反应,其含量是常用的蛋白质氧化指标[16]。底部IF及不同位置UIF鲢鱼在冻藏期间总巯基含量变化如图8-a所示。随着冻藏时间的延长,各样品总巯基含量均明显下降(P<0.05)。样品初始巯基含量在75~80 nmol/mg左右,而IF组和上部、中部、下部UIF组冻藏60 d后则分别减小至(52.85±0.59)、(57.35±1.27)、(56.25±1.57)及(58.57±0.93) nmol/mg,若延长冻藏时间至90 d,则分别进一步减小至(45.76±0.85)、(50.65±0.84)、(51.92±0.76)、(52.61±1.00) nmol/mg。与IF组相比,UIF样品的巯基含量在整个贮藏期明显更高,而不同位置UIF样品在整个贮藏期内总巯基含量并没有显著差异(P>0.05)。
蛋白质中赖氨酸、苏氨酸、脯氨酸和精氨酸等氨基酸残基侧链在多种活性氧基团的作用下易氧化生成羰基,其含量也是常用的蛋白质氧化指标[12]。各样品在冻藏期间中羰基含量变化如图8-b所示。在贮藏0 d时羰基含量为1.3~1.5 nmol/mg,在贮藏前30 d,变化均不显著,不同组之间也无显著性差异(P>0.05)。若进一步延长贮藏时间至60 d,各组样品的羰基含量均明显增加。此时,IF组为(2.60±0.11) nmol/mg,而上部、中部和下部UIF组则分别为(2.25±0.08)、(2.18±0.10)、(2.32±0.04) nmol/mg,均显著小于前者(P<0.05)。冻藏90 d时,上部、中部及下部UIF样品的羰基含量分别为(2.48±0.04)、(2.36±0.08)和(2.52±0.03) nmol/mg,相互之间均无显著性差异(P>0.05)。贮藏前期羰基含量变化不显著的原因可能是由于2,4-二硝基苯肼比色法灵敏度较低,并不适合于低含量羰基化合物的检测。而贮藏后期羰基含量增加减缓的原因可能是由于生成的羰基化合物与样品中的多种成分如糖、脂和亲核化合物反应,或相互间聚合生成不溶性氧化产物所致[22]。
上述结果均表明超声协同处理有效抑制了IF鱼肉蛋白质在贮藏期间中的氧化,该结论与SUN等[10]在鲤鱼块中的研究结论一致。其原因可能是超声协同处理减小了冻品中冰晶的尺寸,使得样品的机械损伤程度减小,暴露在空气中的氨基酸残基也相应减少,因此氧化程度降低[18]。综合巯基和羰基测定结果可知,空间位置对UIF鲢鱼的蛋白质氧化无明显影响。

a-总巯基含量;b-羰基含量图8 IF和不同位置UIF鲢鱼的总巯基含量及羰基含量Fig.8 Change of the total sulfhydryl groups and the carbonyl content of silver carp frozen by IF and UIF at different spatial position during frozen storage
2.7 空间效应对UIF鲢鱼TBARS值的影响
脂肪氧化会改变水产品的色泽和口感,并造成多不饱和脂肪酸等营养成分的损失。TBARS值是检测脂质氧化程度的常用指标。由图9可知,冻藏期间各样品的TBARS值均呈上升趋势。贮藏0 d时样品的TBARS值在0.20 mg/kg左右,贮藏60 d后IF组线性增加至(0.62±0.01) mg/kg,而上部、中部、下部UIF组则分别增加至(0.53±0.01)、(0.53±0.01)及(0.51±0.01) mg/kg。若延长贮藏时间至90 d,IF组增加至(0.68±0.01) mg/kg,显著高于各UIF组。该结果表明超声协同处理显著减小了鱼肉脂质在贮藏期间的氧化,其机制是超声减小了冻品中冰晶的尺寸,并使其形状呈规则圆形,从而减小了样品的机械损伤,最终使得样品暴露在空气中的面积减小,因而脂质氧化速率降低[23]。另外,水由液态转变为固态过程中,其体积膨胀使得细胞受到挤压变形甚至破裂,从而使得胞内氧化酶、促氧化剂等释放,也会加速脂质的氧化[23]。UIF样品由于膜损伤减小,其胞内各种促氧化剂释放到胞外的比例减小,这也是超声协同处理减小UIF样品在冻藏过程中脂质氧化的原因之一。在整个贮藏期内,不同位置UIF样品的TBARS值基本保持一致,相互之间无显著性差异(P>0.05),说明空间位置对UIF样品在贮藏过程中的脂质氧化影响很小,其原因正是由于这些样品的冻结速率没有显著性差异,从而使得样品间冰晶尺寸也没有显著性差异。目前,尚没有关于空间位置对UIF样品的冻结速度、冰晶尺寸、TBARS值等影响的相关研究报道。但已有的其他相关研究论文都显示,样品冻藏期间TBARS值变化高度依赖样品的冻结速度和冰晶尺寸。冻结速率越大,冰晶尺寸越小,样品冻藏期间TBARS值也就越小。例如,MA等[24]研究发现,AF、IF、单频超声辅助浸渍冻结、双频超声辅助浸渍冻结、三频超声辅助浸渍冻结的冻结速率依次增大,而经这些方法冻结样品冻藏后TBARS值则依次减小。SUN等[5]在鲤鱼块中的研究也发现,AF、IF和UIF样品的冻结速率依次增大,形成的冰尺寸则依次减小,样品在冻藏期间的TBARS值也依次减小。
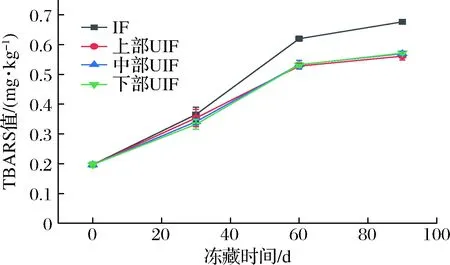
图9 IF和不同位置UIF鲢鱼冻藏期间TBARS值变化Fig.9 Change of TBARS values in silver carp frozen by IF and UIF at different spatial position during frozen storage
2.8 空间效应对UIF鲢鱼TVB-N含量的影响
动物性食品在酶和细菌的作用下,蛋白质会分解产生氨以及胺类等碱性含氮物质(TVB-N)[25],其含量是评价水产品新鲜度最常用的指标之一。各样品在贮藏期间内TVB-N含量变化如图10所示。随冻藏时间的延长,各样品TVB-N值均增加,其中IF组上升速度最快,而UIF组上升较缓慢,且前者始终高于后者。冻藏至90 d时,IF组及上部、中部及下部UIF组的TVB-N值分别为(12.73±0.61)、(11.10±0.33)、(10.65±0.67)和(10.48±0.59) mg/100g,依据国家标准GB 2733—2015,所有样品均处于一级鲜度。已有多项研究显示超声协同处理有效减小了IF鱼、虾等水产品贮藏过程中TVB-N的生成。在整个贮藏期内,不同位置UIF样品的TVB-N值差异并不显著(P>0.05),表明超声位置对UIF鱼肉在冻藏期间的鲜度影响很小。

图10 IF和不同位置UIF鲢鱼冻藏期内TVB-N含量变化Fig.10 Change of TVB-N content in silver carp frozen by IF and UIF at different spatial position during frozen storage
3 结论
本研究结果表明,超声协同处理显著增加了鱼肉IF冻结速度,从而有效减小了样品中的冰晶尺寸和冻藏过程中的汁液流失率、蒸煮损失率,抑制了样品在冻藏期间的蛋白质结构变化和氧化、脂质氧化等,有效提高了冻藏鱼肉的鲜度(P<0.05)。不同位置UIF鱼肉的结果表明,随着与超声换能器距离的增加,超声强度和UIF冻结速度均有一定程度减小,冻结鱼肉中形成的冰晶尺寸稍有增大,但并不显著。不同位置UIF鱼肉在冻藏过程中的汁液流失率、蒸煮损失率、蛋白质结构变化和氧化、脂质氧化、鲜度等均无显著性差异(P>0.05)。这些结果表明,超声协同处理通过提高IF冻结速度而有效减小了样品的冰晶尺寸,从而提高了样品冻藏期间的品质。不同位置UIF冻结速度和冰晶尺寸均无显著性差异,从而使得样品冻藏品质也无显著性差异。本研究结果对UIF的应用具有一定的借鉴和参考。

