沙门氏菌噬菌体SM-p2内溶酶及穿孔素的生物信息学分析和克隆表达
戚 斌,解天慧,石 慧
(西南大学食品科学学院 重庆 400715)
沙门氏菌是一种常见的食源性致病菌,人们在食用受污染的肉类、牛奶和鸡蛋时可能感染沙门氏菌,导致呕吐、腹泻、发烧、头痛,甚至死亡[1]。2019年,欧洲确诊了近88 000 例人类沙门氏菌病病例。在美国,沙门氏菌每年导致大约135 万人感染、26 500 人住院和420 人死亡。在中国,80%~90%的食源性细菌中毒事件是由沙门氏菌引起的[2-3]。为了避免沙门氏菌对食品安全造成严重的影响,人们采取积极的措施来预防和控制。例如,使用有机酸、水蒸气等传统的方法来杀灭食品表面的沙门氏菌,然而,这样会改变食品的感官特性,而且还有可能在食品上造成有毒、有害物质的残留[4]。利用抗生素来杀灭沙门氏菌容易造成耐药菌的出现,对沙门氏菌的控制造成极大的挑战[5]。寻找新型的抗菌物质已刻不容缓。
近些年来,由于噬菌体具有无毒,特异性高,裂解性强和抗耐药性等优良特点,已作为一种新型的生物抑菌剂被大量研究[6-7]。目前噬菌体已开始应用于清除食品中致病菌,然而,在噬菌体制剂的研发中存在一些缺陷或不足,如作为活体病毒,噬菌体常常不被人们接受以及一些噬菌体对于耐药基因的传播等[8]。内溶酶和穿孔素不仅保留了噬菌体的抑菌作用,而且细菌还很难对内溶酶和穿孔素产生抗性,可很好地解决噬菌体制剂存在的不足和缺陷。
内溶酶和穿孔素是一种存在于dsDNA 噬菌体中,对细菌具有裂解活性的蛋白[9]。内溶酶和穿孔素可直接裂解细菌细胞壁或细胞膜[10]。内溶酶能够降解细菌的肽聚糖,使细菌裂解死亡;穿孔素能在细菌质膜上形成小孔,协助内溶酶降解肽聚糖。无毒、高效抑菌、不易产生耐药性等特点,使内溶酶和穿孔素开始应用于食品安全和医药等各个方面[11-12]。
本研究利用十聚体寡核苷酸随机引物对前期分离的一株烈性沙门氏菌噬菌体SM-p2 的DNA进行随机扩增并鉴定,利用鉴定结果设计内溶酶Lys 2 与穿孔素Hol 2 的引物并确定它们的基因。通过生物信息学分析预测该噬菌体内溶酶结构和特征,最后通过基因克隆表达得到内溶酶Lys 2和穿孔素Hol 2。
1 材料与方法
1.1 试验材料
SM-p2 为烈性噬菌体,保存于本实验室;pEASY-Blunt E1 大肠杆菌表达试剂盒、感受态大肠杆菌Trans1-T1、BL21 (DE3)、胶回收试剂盒、Ni-IDA 填料,北京全式金生物有限公司;T 载体PCR 产物克隆试剂盒,上海生工生物工程股份有限公司。RNase A、DNaseI、乙二胺四乙酸(EDTA)、蛋白酶K,索莱宝生物技术有限公司;其它试剂均为国产分析纯级。本试验所用引物见表1。

表1 本试验所用引物序列Table 1 Primers sequence in this research
1.2 仪器与设备
电子天平,Sartorius 公司;2720 Thermal CyclerPCR 仪,AppliedBiosystems 公司;DYY-8C 电泳仪,北京六一生物科技有限公司;JY88-IIN 超声细胞粉碎仪,宁波新芝生物科技有限公司;011005酶标仪,Biotek 公司;Bio-rad ChemiDoc XRS+019900 化学发光凝胶成像分析系统,Biorad 公司;DK-8D 水浴锅,上海齐欣科学仪器有限公司;UV-1600 紫外-可见分光光度仪,北京普析通用仪器有限责任公司;5810R 冷冻高速离心机,Eppendorf公司;MX-F 微型涡旋混合仪,上海泸西分析仪器有限公司。
1.3 方法
1.3.1 噬菌体SM-p2 DNA 的提取 噬菌体悬浮液首先用RNase A(5 μg/mL)和DNaseI(2 U/mL)在37 ℃下处理30 min,然后在80 ℃下孵育15 min 使DNase I 失活。纯化的噬菌体被蛋白酶K(50 μg/mL)于56 ℃下处理1 h,辅以SDS(0.5%)和EDTA(20 mmol/L)。加入等体积的苯酚/氯仿/异戊醇(25∶24∶1),混合并在4 ℃下以12 000×g 离心20 min。转移上清液并与等体积的异丙醇混合并保持在-20 ℃过夜。离心后,用冰冷的75%乙醇洗涤沉淀3 次。最后,将颗粒风干,溶解在50 μL TE缓冲液(10 mmol/L Tris-HCl;1 mmol/L EDTA,pH 8)中并储存在-20 ℃。
1.3.2 噬菌体SM-p2DNA 的随机扩增 以噬菌体SM-p2 的DNA 为模板,用引物287、277、275、272、270、241、228 和208 进行PCR 扩增。PCR 扩增体系:Taq 聚合酶(5 U/μL)0.25 μL、10xPCR 缓冲 液2.5 μL、dNTPs (2.5mmol/L)2.5 μL、ddH2O 17.5 μL、模板DNA 0.5 μL、MgCl21.3 μL、上下游引物各1 μL。PCR 扩增条件:94 ℃预变性4 min;94 ℃变性30 s,34 ℃复性30 s,72 ℃延伸2 min,共30 个循环。选择第1 次扩增结果中又少又亮的条带进行再扩增,将第2 次扩增的PCR 产物回收后进行TA 克隆并测序。测得的序列在NCBI 上进行相似性比对(Blastn)。
1.3.3 噬菌体SM-p2 内溶酶 (Lys 2) 和穿孔素(Hol 2) 基因的确定 将上述随机二次扩增PCR产物的核酸序列在NCBI 上进行相似性比对,选取Blast 比对结果中同源率最高的噬菌体的内溶酶和穿孔素基因设计引物。获得4 条引物,即Hol 2 的上下游引物(Lys 2 的上下游引物),以SM-p2的DNA 为模板,结合Hol 2 的上游引物和Hol 2下游引物(Lys 2 上游引物引物和Lys 2 的下游引物)进行PCR 扩增。PCR 扩增体系:Taq 聚合酶(5 U/μL)0.3 μL、10xPCR 缓冲液5 μL、dNTPs(2.5 mmol/L) 1 μL、ddH2O 35.2 μL、模 板DNA 0.5 μL、MgCl24 μL、上下游引物各2 μL。PCR 扩增条件:94 ℃预变性4 min;94 ℃变性30s,50 ℃复性30 s,72 ℃延伸1 min,共30 个循环;最后72 ℃延伸5 min。
1.3.4 Lys 2 与Hol 2 的生物学信息分析 分别利用 SOPMA、ExPASy ProtParamtool、TMHMM Server v.2.0 和Pfam 数据库对SM-p2 内溶酶和穿孔素的二级结构、理化特征、跨膜结构和结构域进行预测。利用PyMOL 内溶酶和穿孔素的二级结构进行可视化。
1.3.5 重组质粒的构建与转化 将内溶酶Lys 2或穿孔素Hol 2 基因片段与载体质粒pEasy-Blunt E1 以物质的量比7∶1 的比例加入离心管中,在室温下反应8 min 后,将试管置于冰上冷却。加连接产物于刚解冻好的50 μL Trans1-T1感受态细胞中,在含有卡那霉素的抗性平板上进行筛选,以T7 promoter primer 和目的基因的下游引物进行菌落PCR 挑选阳性菌,将的阳性菌提取质粒后送至测序公司测序。将测序正确的重组质粒转化到BL21(DE3)感受态大肠杆菌。
1.3.6 Lys 2 与Hol 2 的诱导表达与纯化 将含有pEASY-Lys 2、pEASY-Hol 2 重组质粒的大肠感受态细胞接种到含有卡那霉素抗性(0.1 μg/mL)的LB 肉汤培养基,200 r/min、37 ℃培养至OD600nm在0.5 左右。分别加入终浓度为0.1,0.5,1,2,5 mmol/L 的异丙基硫代半乳糖苷(IPTG)诱导。在200 r/min、37 ℃的条件下诱导表达5 h。取诱导后的菌液6 000 r/min 离心10 min,收集细菌沉淀;将沉淀重悬于100 mL 无菌的PBS 缓冲液中,冰浴下超声破碎,待溶液变得澄清后,10 000 r/min 离心1 h,收集上清;使用0.45 μm 的滤膜过滤得上清液。利用镍亲和柱纯化过滤后的上清,将过滤后的上清液加入柱子,上清液自然流出并收集穿透液。再用25 mL Tris-NaCl 缓冲液清洗柱子并收集洗涤液后,使用浓度分别为20 mmol/L 和50 mmol/L 的咪唑洗脱杂蛋白,收集洗脱液。再分别用200 mmol/L 和500 mmol/L 咪唑对目的蛋白进行洗脱。取36 μL 纯化好的目标蛋白洗脱液与4 μL 4×SDS-PAGE 上样缓冲液混和,用水浴锅在100 ℃下水浴3~5 min 充分混匀,得蛋白凝胶电泳上样液,进行蛋白凝胶电泳。NanoDrop 紫外分光光度计用于检测蛋白浓度。
1.3.7 Hol 2 表达对BL21(DE3)的生长的毒害作用 分别挑取含有pEASY-Hol 2、pEASY-Lys 2和pEASY-Blunt E1 重组质粒和空质粒的到10 mL 含卡那霉素的LB 肉汤培养基中37 ℃培养至OD600nm在0.4~0.6 后,最终在200 r/min,37 ℃条件下加入终浓度为1 mmol/L 的IPTG 诱导培养2 h。定期检测菌液浊度,时间间隔为20 min,以描述大肠杆菌BL21(DE3)的生长趋势。
2 结果与分析
2.1 噬菌体SM-p2DNA 的随机扩增及Lys 2 与Hol 2 基因的确定
如图1b 所示,噬菌体SM-p2 DNA 的随机扩增产物具有多样性,引物208 在泳道1 中的PCR产物条带少且亮,选择泳道1 中的PCR 产物进行再扩增。最终回收到一段700~800 bp 的DNA 片段 (图1c)。将回收的这段DNA 测序,再进行Blastn 比对。Blast 比对结果显示,沙门氏菌噬菌体Sepoy 的核苷酸还原酶与随机扩增的SM-p2 DNA片段同源率最高,为72.12%。根据沙门氏菌噬菌体Sepoy 内溶酶和穿孔素的DNA 序列设计引物。将设计好的引物,以SM-p2 的DNA 为模板进行PCR。所图1d 所示,得到SM-p2 内溶酶Lys 2 的基因片段,大小在800 bp 左右;得到SM-p2 穿孔素Hol 2 的基因片段,大小在700 bp 左右。

图1 Lys 2 与Hol 2 基因的PCR 扩增Fig.1 PCR amplification of gene of Lys 2 and Hol 2
2.2 Lys 2 和Hol 2 的生物学信息分析
2.2.1 噬菌体SM-p2 内溶酶和穿孔素的二级结构 如图2所示,Lys 2 和Hol 2 的主要二级结构都为α-螺旋,分别占氨基酸总数的56.06%和41.64%;Lys 2 和Hol 2 中第2 丰富的结构是无规则卷曲,分别占氨基酸总数的29.17%和39.35%。在2 种蛋白的二级结构中均未发现β-折叠。延长链和β-转角在Lys 2 和Hol 2 占氨基酸总数含量较少。由于Lys 2 和Hol 2 的二级结构中很少有层状结构,且主要二级结构为α-螺旋结构,因此可以推断Lys 2 和Hol 2 具有稳定的结构[14]。
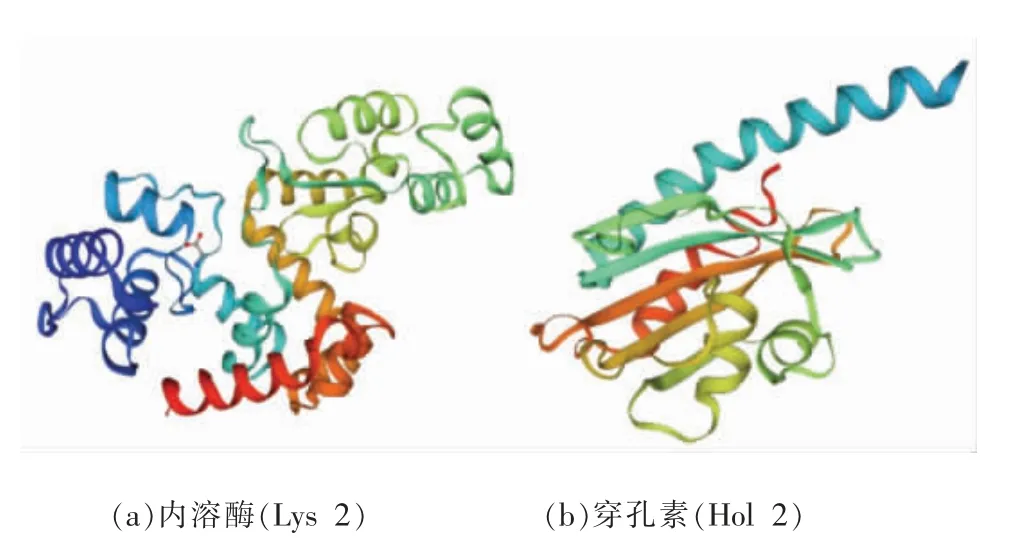
图2 Lys 2 和Hol 2 二级结构的可视化Fig.2 Visualization of secondary structure of Lys 2 and Hol 2
2.2.2 Lys 2 与Hol 2 的特性预测 一般来说,不稳定系数小于40 表示蛋白质是稳定的[15]。如表2所示,Lys 2 和Hol 2 的分子质量分别是24.51 ku和28.66 ku,且不稳定系数都低于40。

表2 Lys 2 和Hol 2 的理化性质Table 2 The physicochemical properties of Lys 2 and Hol 2
2.2.3 Lys 2 与Hol 2 的跨膜结构预测 对噬菌体SM-p2 内溶酶和穿孔素的跨膜结构进行预测(图3) 结果显示,穿孔素Hol 2 在N 端在21~38位氨基酸形成一个跨膜结构,39~150 位氨基酸处于胞外,1~27 位氨基酸处于胞内;内溶酶Lys 2 在150~200 之间由于螺旋程度较低最终并未形成跨膜结构。

图3 内溶酶Lys 2 的跨膜结构(a)和穿孔素Hol 2 的跨膜结构(b)Fig.3 The transmembrane structure of endolysin Lys 2 (a) and holin Hol 2 (b)
2.2.4 Lys 2 与Hol 2 的结构域预测 如图4a 所示,噬菌体SM-p2 的内溶酶Lys 2 由两个结构域构成,一个结合结构域(CBD)和一个催化结构域(EDA),CBD 的主要位点是肽聚糖,EDA 起裂解细菌的作用,其本质属于N-乙酰胞壁酸酶,能裂解β-1,4-糖苷键。如图4b 所示噬菌体SM-p2 的穿孔素Hol 2,含有一个保守结构域,其主要作用是进行信息调节和破坏细菌细胞。

图4 内溶酶Lys 2(a)和穿孔素Hol 2(b)的结构域Fig.4 Endolysin Lys 2 (a) and holin Hol 2 (b)structure domain
2.3 重组质粒的构建
构建重组表达质粒pEASY-Lys 2 和pESAYHol 2 来表达Lys 2 与Hol 2 功能蛋白。结果如图5所示,菌落PCR 产物在泳道1 和泳道2 有明显的条带,大小分别为700 bp 和800 bp 左右,这与Hol 2 和Lys 2 基因大小一致,表明目的基因成功插入到了质粒中,重组质粒构建成功。

图5 菌落PCR 产物Fig.5 PCR products of colony
2.4 Lys 2 与Hol 2 的诱导表达与纯化
向含pEASY-Lys 2、pEASY-Hol 2 的菌液和含空载体pEASY 的菌液中加入IPTG 诱导表达的蛋白以及纯化后的蛋白进行SDS-PAGE 电泳分析,结果显示,0.1,0.5,1,2,5 mmol/L 的IPTG 均能诱导蛋白表达,其中Lys 2 在1 mmol/L 和2 mmol/L 的浓度下表达量最高,在26 ku 到33 ku左右出现明显条带 (图6a);在0.1~5 mmol/L 的IPTG 浓度范围内,加入的IPTG 浓度对Hol 2 的诱导表达无明显影响,都能在20 ku 到25 ku 附近出现明显条带。作为阴性对照的质粒空载蛋白在相应位置并未出现明显的条带,表明Lys 2 与Hol 2 在大肠杆菌原核表达系统中的成功表达 (图6b)。

图6 不同浓度IPTG 诱导内溶酶Lys 2(a)和穿孔素Hol 2(b)表达Fig.6 Different concentrations of IPTG induce expression of Lys 2 (a) and Hol 2 (b)
如图7,SDS-PAGE 电泳图所示,Lys 2 能够在镍亲和柱中被200 mmol/L 咪唑大量洗脱并纯化 (图7a,泳道8),Hol 2 能够在镍亲和柱中被500 mmol/L 咪唑大量洗脱并纯化(图7b,泳道6),且只在与目标蛋白分子质量大小一致的位置出现唯一清晰的条带。经检测,Lys 2 和Hol 2 的质量浓度分别为5.419 mg/mL 和2.191 mg/mL。

图7 内溶酶Lys 2(a)和穿孔素Hol 2(b)的纯化Fig.7 Purification of Lys 2 (a) and Hol 2 (b)
2.5 Hol 2 表达对BL21(DE3)的生长的毒害作用
穿孔素具有直接裂解细菌细胞内膜的功能,可能对表达细菌产生毒害。如图8所示,随着时间的增加,BL21(DE3)+pEASY-Blunt E1(对照组)的菌液OD600nm值显著高于BL21(DE3)+ pEASYHol 2 的菌液OD600nm值,说明穿孔素Hol 2 的表达抑制了细菌的生长。Hol 2 的表达虽能够抑制细菌的生长,但不能降低菌液的浓度,并在表达80 min 后菌液浓度趋于稳定,说明Hol 2 在加入IPTG 诱导表达的后的第80 分钟表达量趋于稳定,故Hol 2 的最佳表达时间为80 min。此外,BL21 (DE3) + pEASY-Lys 2 在不同时间菌液OD600nm值与对照组无显著性差异,说明内溶酶Lys 2 的表达不会抑制细菌的生长。
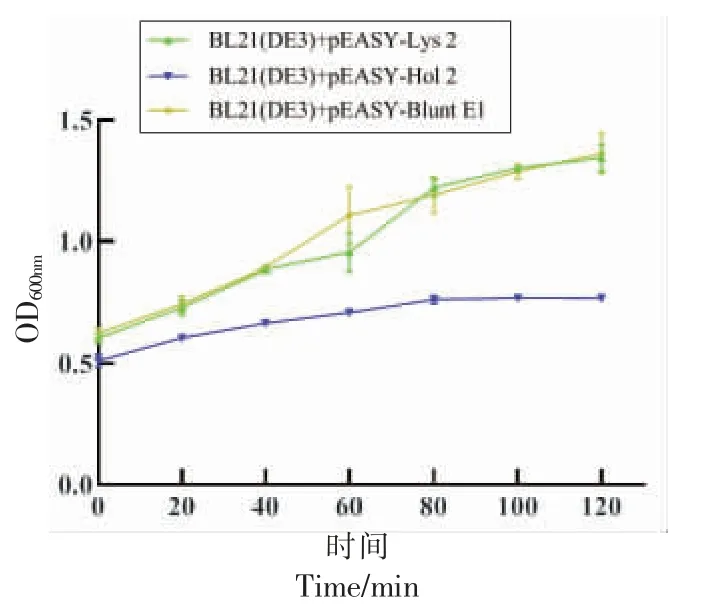
图8 内溶酶和穿孔素表达对大肠杆菌BL21(DE3)生长的抑制作用Fig.8 Inhibition of expression of endolysin and holin on growth of BL21 (DE3)
3 结论
噬菌体编码的、有抑菌作用的内溶酶和穿孔素,可作为一种新型抑菌剂控制食品中的病原菌。本研究对筛选的SM-p2 噬菌体进行了初步的鉴定,结果表明,噬菌体SM-p2 的DNA 片段与沙门氏菌噬菌体Sepoy 的同源率最高为72.12%。生物信息公共数据库显示,沙门氏菌噬菌体Sepoy 是一种含双链DNA 的肌尾科噬菌体。因此,SM-p2可能也是一种双链DNA 噬菌体。内溶酶和穿孔素一般存在于双链DNA 噬菌体的尾刺上可以破坏细菌细胞壁,使噬菌体的DNA 注入宿主细菌,对细菌具有很强的裂解活性,如T4 噬菌体[16]。
双链DNA 噬菌体的内溶酶是一种高效的革兰氏阳性裂解酶,它具有无毒、高特异性、不易产生细菌耐药性等特点[17]。内溶酶具有模块化结构域,一般由细胞壁识别结构域(CBD)和催化结构域(EDA) 两部分组成,CBD 能够识别细菌,EDA能够裂解细菌死亡[18]。内溶酶的结构域决定了能够裂解的宿主范围,一般既有CBD 又有EDA 的内溶酶宿主范围小,仅有一个球状催化结构域的内溶酶能裂解多种细菌,甚至是革兰氏阴性细菌[19]。也有研究表明,有的内溶酶不止一个CBD或EDA[20-21]。跨膜结构对于穿孔素传递信息和控制细菌裂解时间具有重要的意义[22]。Lys 2 的生物信息学显示,Lys 2 具有典型的内溶酶结构,即由一个CBD 和一个EDA 组成,既可以识别具有特定结构的细菌又能对结合到细菌造成裂解。Hol 2有一个跨膜结构,用于传递信息和裂解细胞膜。
本研究利用原核表达系统成功表达了Lys 2和Hol 2,IPTG 诱导Lys 2 和Hol 2 表达的最佳浓度为1 mmol/L,在此浓度下诱导表达和纯化最终获得5.419 mg/mL 的内溶酶溶液。穿孔素Hol2在未诱导之前少量表达,虽抑制了BL21(DE3)的生长,但并不能降低菌液浓度,在用IPTG 诱导表达80 min 后菌液浓度不在变化,因此穿孔素Hol 2 的最佳表达时间是80 min,纯化后的穿孔素Hol 2 质量浓度为2.191 mg/mL。

