基于模拟体系研究甘薯/马铃薯淀粉体外消化特性及结构变化
范会平,侯冰洁,索 标,张波波,艾志录*
(1 河南农业大学食品科学技术学院 郑州 450002 2 农业农村部大宗粮食加工重点实验室 郑州 450002 3 国家速冻米面制品加工技术研发专业中心 郑州 450002)
随着经济的发展和生活水平的提高,中国粮食需求量逐渐增加,然而,受耕地资源的约束和种植效益的影响,小麦、水稻等主粮品种继续增产的空间变小,难度加大,而甘薯作为我国重要的粮食作物,具有产量高,用途广,适应性强的优点,在我国粮食产量中的占比仅次于水稻、小麦和玉米,甘薯年产量在1 亿t 以上,无论种植面积还是年产量均居世界首位,因此,甘薯在保障我国粮食安全中起着重要的作用[1-3]。
甘薯营养价值很高,被营养学家们称为营养最均衡的保健食品。甘薯具有高淀粉、高膳食纤维、低脂肪等营养学特性,并具有调节人体酸碱平衡、整肠、抗肿瘤、抗衰老、减肥等保健作用[4]。由于甘薯中含有丰富的纤维素和淀粉物质,食用不易消化且又会促进胃酸的大量分泌,因此一旦食用不当,会使人腹胀、打嗝,出现消化不良的情况[5]。淀粉作为甘薯中含量最多的组分,其消化特性与甘薯的消化特性息息相关;同时,淀粉是全球饮食中最丰富的常量营养素,也是人体主要的膳食能量来源。马铃薯和甘薯的淀粉含量分别约为干物质的66%~80%和58%~80%[6]。然而,目前有关淀粉消化方面的研究,大多是对其消化率及所含快消化淀粉(Rapidly digestible starch,RDS)、慢消化淀粉(Slowly digestible starch,SDS)、抗性淀粉(Resistant starch,RS)含量的研究,而对淀粉消化过程中的消化产物变化的研究还很少。
本研究通过对甘薯淀粉与马铃薯淀粉进行体外消化,研究其消化过程中消化产物的一些变化,阐述模拟体外消化时间与淀粉结构及理化性质变化之间的关系,为扩大甘薯淀粉应用范围提供依据,而且对于推进甘薯主食化进程具有重要的意义。
1 材料与方法
1.1 材料与试剂
甘薯淀粉、马铃薯淀粉,新乡良润全谷物食品有限公司;猪胰α-淀粉酶(50 U/mg)、淀粉葡萄糖苷酶(2 000 U/mg),德国Ruibio 公司;3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)试剂,实验室自配;其它所用试剂为分析纯级。
1.2 仪器与设备
TDL-5000bR 离心机,上海安亭科学仪器厂;DHR-2 旋转流变仪,美国TA 仪器公司;SHZ-82A水浴恒温振荡器,金坛市医疗仪器厂;BenchTop Pro 冷冻干燥机,美国Virtis 公司;Rise-2008 激光粒度仪,济南润之科技有限公司;DZKW-4 电子恒温水浴锅,北京中兴伟业仪器有限公司;UV-2000紫外-可见分光光度计,上海沪粤明科学仪器有限公司;电子天平,德国Sartorious 公司;X′ Pert3Powder 粉末X 射线衍射仪XRD,英国马尔文仪器有限公司;扫描电子显微镜SEM,德国蔡司公司。
1.3 方法
1.3.1 酶对淀粉体外消化的模拟 采用猪胰α-淀粉酶和淀粉葡萄糖苷酶对淀粉进行模拟体外消化[7]。准确称取1.5 g(精确到0.001 g)淀粉加入30 mL 醋酸缓冲液(pH 5.2) 混匀后于95 ℃糊化10 min,将糊化后样品放入37 ℃恒温水浴锅平衡至37 ℃;加入5 mL 猪胰α-淀粉酶(100 U/mL)和淀粉葡萄糖苷酶(40 U/mL)的混合液,在37 ℃条件下水浴振荡(170 r/min),分别在30,60,90,120,180 min 取样,加入无水乙醇终止消化,在4 000 r/min 的条件下离心5 min,弃去上清液,沉淀先用0.2 mol/L 的醋酸缓冲液冲洗,再用蒸馏水冲洗一次。真空冷冻干燥48 h,待测。
1.3.2 淀粉水解率及葡萄糖释放量 准确称取100 mg 葡萄糖,溶于少量蒸馏水中并定容于1 000 mL 容量瓶中。分别移取0.0,0.2,0.4,0.6,0.8,1.0,1.2 mL 的标准葡萄糖溶液于50 mL 的比色管中,加入蒸馏水定容于2 mL,然后分别加入1.5 mL DNS 试剂并摇匀,在沸水浴中加热5 min,冷却后加蒸馏水定容于25 mL,混匀后于波长540 nm 处测定吸光度,平行3 次,取平均值制作葡萄糖标准曲线。
在模拟淀粉体外消化的10,20,30,60,90,120,180 min 各取1 mL 酶解液,加入4 mL 无水乙醇,于4 000 r/min 离心10 min。取上清液,采用3,5-二硝基水杨酸法(DNS 法)测定葡萄糖含量[8]。淀粉水解率为一定消化时间内被水解的淀粉占初始淀粉含量的百分比,葡萄糖释放量为一定消化时间内每100 g 淀粉释放的葡萄糖质量。根据下列公式计算淀粉水解率及葡萄糖释放量。


式中,Si——初始淀粉量,mg;Gp——产生葡萄糖量,mg。
1.3.3 粒径测定 采用激光粒度仪对甘薯淀粉和马铃薯淀粉及其消化产物进行粒度测定。分散介质:蒸馏水;介质折射率为1.33。
管理职责的落实可以明确这件事由谁在负责做,从而使负责人能够认真对待,使这项工作得到有效开展。因此,基层行政事业单位在财务管理工作中要把各项财务管理工作落实到每个部门直至部门的每一个人身上,确保财务管理工作的有效开展。首先,基层行政事业单位要做好单位财务管理工作的细分工作,把财务管理工作科学合理的分成能够单独进行的若干项工作。其次,把这些工作落实到相应部门及个人,赋予相应的职责与权力,使其在执行时相关工作能够得到每一个干部职工的配合。最后,落实相关财务管理工作的监督考核措施,对出色完成工作的给予物质与精神奖励,反之给予批评甚至处罚,从而使财务管理发挥应有的作用。
1.3.4 直、支链淀粉含量测定 甘薯淀粉和马铃薯淀粉消化产物中直链淀粉、支链淀粉含量采用双波长比色法测定[9]。
1.3.5 消化物流变特性 在淀粉的模拟体外消化不同时间取出消化样品,沸水浴灭酶,冷却至室温,用旋转流变仪在温度37 ℃进行测试,黏度记录为剪切速率的函数,范围为0.001~100 s-1。
1.3.6 扫描电子显微镜 采用扫描电子显微镜观察甘薯淀粉和马铃薯淀粉及其消化产物的表面形态外貌,取少量样品涂于双面碳胶上,进行喷金处理后置于扫描电子显微镜下进行扫描拍照。
1.3.7 广角X 射线衍射(XRD) 将样品研磨,过200 目筛,采用X 射线衍射仪测定样品X 射线衍射图谱。利用X 射线衍射仪在40 kV 电压和40 mA 电流条件下观察甘薯淀粉和马铃薯淀粉及其消化产物在不同消化时间的结晶特性,X 衍射源特征线是Cu-Kα 辐射,衍射角的扫描区域是4°~40°,扫描速度为5°/min。
1.3.8 数据统计与分析 每组试验至少进行3次,采用SPSS 16.0 和Excel 2019、Jade 软件进行数据分析,P<0.05 表示差异显著,用Origin 8.0 进行图形绘制。
2 结果与讨论
2.1 体外消化淀粉水解率及葡萄糖释放量
以葡萄糖含量为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,得到方程为y = 0.0186x +0.0403,R2=0.996。
淀粉消化率取决于多种因素,淀粉水解率及葡萄糖释放量可以较直观地表示淀粉消化的快慢。图1显示了甘薯淀粉和马铃薯淀粉在模拟体外消化的水解率和葡萄糖释放量,甘薯淀粉和马铃薯在消化过程中淀粉水解率随着消化时间的变化趋势基本相同,在消化前60 min 淀粉水解率上升较快,后期淀粉水解程度增加速率逐渐变缓慢;甘薯淀粉水解率整体上略高于马铃薯淀粉,在消化180 min 时甘薯淀粉水解率达到58.78%,马铃薯水解率51.10%;整体上,甘薯淀粉葡萄糖释放量高于马铃薯淀粉消化;在相同消化时间内,甘薯淀粉的葡萄糖释放量高于马铃薯淀粉,说明马铃薯淀粉水解速率比甘薯淀粉缓慢;体外模拟消化过程中,葡萄糖释放量越高,说明此阶段淀粉水解越多,释放葡萄糖量也越多。陈露露[10]在高压微射流处理对甘薯淀粉和马铃薯淀粉的晶体结构和性质的影响一文中提到马铃薯淀粉的小颗粒和大颗粒的粒径都高于甘薯淀粉,说明马铃薯淀粉和甘薯淀粉相比,拥有较为疏松的内部结构,较易受到外力作用,易于糊化;而甘薯淀粉和马铃薯淀粉的这些基本理化性质可能影响淀粉的消化特性。
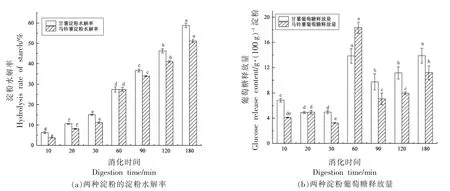
图1 甘薯淀粉和马铃薯淀粉消化率及葡萄糖释放量Fig.1 Digestibility and glucose release content of sweet potato starch and potato starch
2.2 消化产物粒度分布
粒径是监测消化过程的主要参数[11]。有研究表明,淀粉消化速率与其粒度大小有关,淀粉粒径越小消化越快。淀粉颗粒的消化包括3 个阶段:水解酶向底物的扩散、酶与淀粉颗粒的附着和催化作用。在消化过程中,酶随机扩散吸附在淀粉颗粒表面,酶解开始于酶-颗粒接触点,较小的颗粒比较大的颗粒水解的更快,因为其较大的比表面积更有利于酶的吸附[12]。图2显示了甘薯淀粉和马铃薯淀粉模拟体外消化的消化产物粒度分布,甘薯淀粉和马铃薯淀粉体外消化产物颗粒大小分布不均匀,在0~1 000 μm 范围内有多个峰值,甘薯淀粉在消化过程中,30 min 时约21.08 μm。随着消化时间延长,向更大尺寸转移,60 min 时约103.09 μm。当消化时间长于90 min(约109.22 μm)时,粒度分布没有明显变化。马铃薯淀粉在消化过程中,30 min 时约79.39 μm,随着消化时间延长,向更大尺寸转移。当消化时间长于120 min (约131.59 μm)时,粒度分布没有明显变化。由图2可知,马铃薯原淀粉粒径 (36.67 μm) 比甘薯原淀粉粒径(14.83 μm)大,故马铃薯淀粉水解率稍低于甘薯淀粉。在消化过程中,消化产物粒度分布向更大的尺寸转移,这可能由于淀粉经过糊化内部结构膨胀导致。Zheng 等[13]在不同结构、不同直链淀粉含量的淀粉凝胶的体外消化研究中也发现具有约24.5%直链淀粉的普通玉米淀粉凝胶和约70%直链淀粉的高直链淀粉淀粉凝胶在消化过程中粒度分布呈多峰分布且向更大的尺寸转移;约含100%支链淀粉的糯玉米淀粉凝胶其粒度分布呈单峰均匀分布。
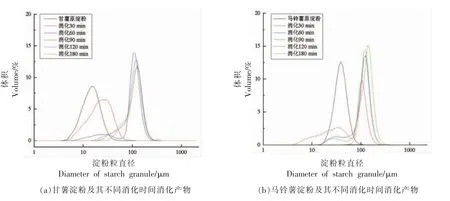
图2 甘薯淀粉和马铃薯淀粉及其不同消化时间消化产物粒径分布Fig.2 Size distribution of sweet potato starch,potato starch and their digestive products at different digestion times
2.3 消化过程中支、直链淀粉含量变化
Colonna 等[14]报道了中指出直链淀粉链具有线性结构,且比支链淀粉链更灵活,在蒸煮糊化后形成双螺旋结构,从而显示出比支链淀粉更高的对淀粉酶水解的抗性,故直链淀粉较难被水解消化。如图3所示,在消化过程中,随着消化时间的增加,两种淀粉中支链淀粉含量呈逐渐下降趋势,可能是由于在消化过程中,淀粉样品被淀粉酶水解,支链淀粉由于链分支较多而杂,水解较快;直链淀粉含量在消化过程中无显著变化,可能是由于支链淀粉在酶解期间淀粉分子链被酶解成新的直链淀粉或者从淀粉开始酶解过后剩下的直链淀粉比较抗酶解。马铃薯淀粉水解速率比甘薯淀粉水解速率低,可能是由于其直链淀粉含量(23.00 μg/mL)稍高于甘薯淀粉直链淀粉含量(20.13 μg/mL),通过糊化后经冷却产生更致密的凝胶网络,在消化过程中可减缓酶解作用。

图3 甘薯淀粉和马铃薯淀粉消化过程中直、支链淀粉含量变化Fig.3 Changes of amylose and amylopectin starch contents in sweet potato starch and potato starch during digestion
2.4 消化过程中消化物的黏度变化
由图4可知,经过糊化的马铃薯淀粉比糊化的甘薯淀粉黏度大;消化过程中甘薯淀粉和马铃薯淀粉的黏度随着消化时间的增加而降低,可能是由于消化过程中支链淀粉被分解,结构被破坏,导致黏度降低,与消化前的初始淀粉样品一致,显示出剪切稀化现象(随着所施加的剪切速率的增加,黏度降低)。两种淀粉样品在消化过程中黏度降低,这是由于消化液对淀粉消化物黏度的稀释作用以及淀粉分子被消化酶降解所致。马铃薯淀粉水解速率较慢可能与其本身的黏度比甘薯淀粉高有关。黏度越大,淀粉样品与酶解液之间的接触越少,淀粉消化速率越慢。Iqbal 等[15]发现消化物黏度会影响酶与消化物之间的接触,黏度大的消化样品可减少酶的随机扩散,降低酶与底物结合的可能性,从而降低底物水解的速率和程度。淀粉水解率与其流变学黏度呈负相关,较高的淀粉黏度通常会增加消化过程中淀粉样品的流动阻力,从而限制酶进入淀粉颗粒,降低淀粉消化速率。
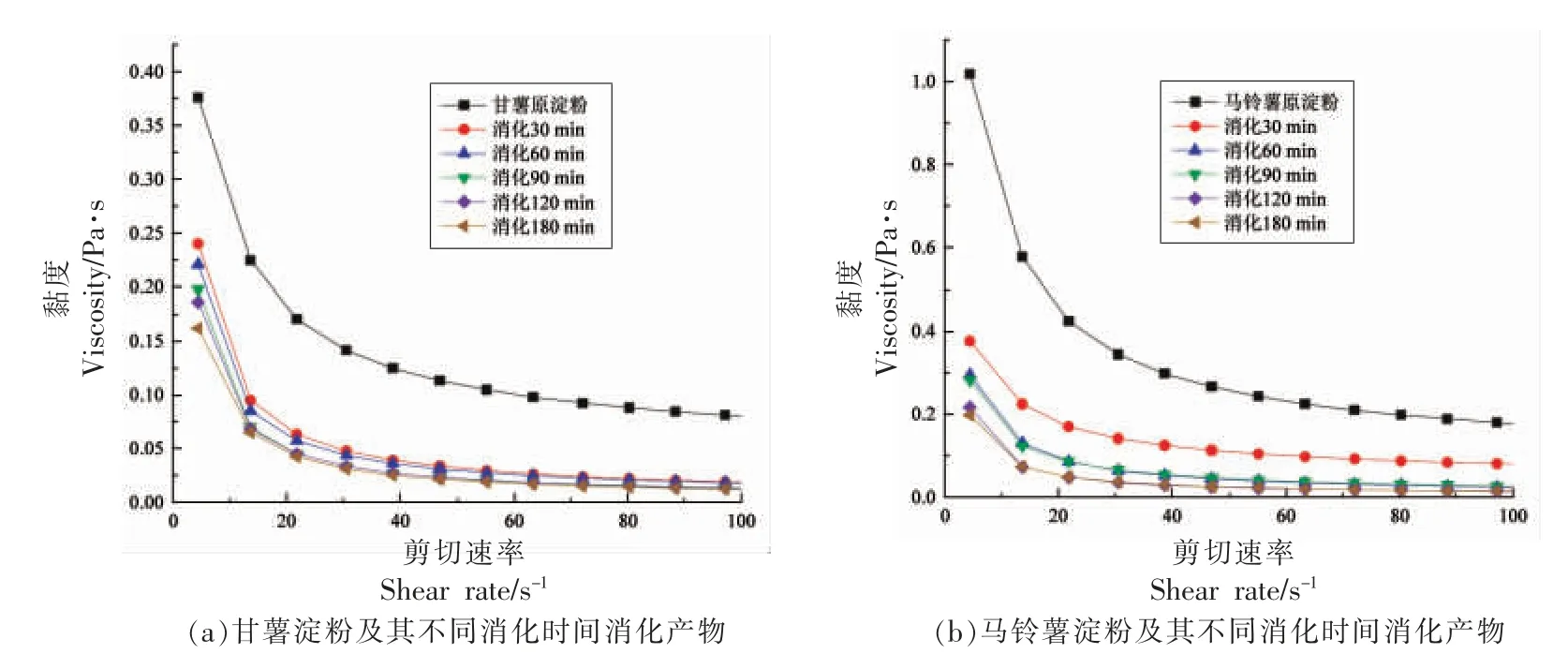
图4 甘薯淀粉和马铃薯淀粉及其消化产物黏度的变化Fig.4 Viscosity changes of sweet potato starch and potato starch and their digestion products
2.5 体外消化过程中淀粉形貌结构
图5显示了不同消化阶段甘薯淀粉和马铃薯淀粉的扫描电子显微镜。随着消化时间的增加,颗粒变得不规则,与原淀粉样品相比,它们的表面出现孔状,这可能是因为淀粉在消化前经过糊化,淀粉粒吸水溶胀,经过消化酶酶解后其表面的层状结构被逐渐分解。随着消化时间的增加,淀粉颗粒结构被进一步破坏,几乎所有的淀粉颗粒都被分解,相较于原淀粉来说,部分消化后的淀粉表面不光滑,结构不紧密,较为疏松。另外观察到甘薯淀粉和马铃薯淀粉在消化中存在大包裹形状。Lopez-Rubio 等[16-17]认为在体外消化过程中出现的小团簇形状是由消化过程中直链淀粉重新排列而形成;Loksuwan[18]在对改性木薯淀粉、天然木薯淀粉的研究中发现糊化淀粉也会通过形成微胶囊形状来进行分子重排。在甘薯淀粉和马铃薯淀粉消化期间出现大包裹形状是由糊化的淀粉样品经过酶解后产生的短链以有序的方式重新排列所致。可以观察到,马铃薯淀粉在消化过程中的团簇状比甘薯淀粉大,这可能就是甘薯淀粉水解率比马铃薯淀粉大的原因造成的。另外,淀粉链的重新排列会形成更抗酶解的结构,从而限制酶水解的程度[19]。

图5 甘薯淀粉和马铃薯淀粉不同消化时间SEM 图Fig.5 SEM of sweet potato starch and potato starch at different digestion times
2.6 消化物结晶特性变化
图6表示甘薯淀粉和马铃薯淀粉的X 射线衍射图,由图可以看出甘薯淀粉在15°,17°,23°出现主要衍射峰,属于A 型淀粉衍射模式,这与Waramboi 等[20]的结果一致。马铃薯淀粉在17°,20°,22°,24°出现主要衍射峰,属B 型淀粉衍射模式[21]。
一般来说,淀粉在消化期间,淀粉颗粒的无定形区更容易水解,结晶区较难水解。然而,在模拟消化初始,淀粉首先经过糊化阶段,淀粉颗粒具有的结晶区和非结晶区的结构已经被破坏;如图6所示,甘薯淀粉经不同时间消化后,在15°,20°,24°处出现衍射峰;马铃薯淀粉经不同时间消化后,在消化30 min 和60 min 时,衍射峰主要集中在13°,17°,21°。之后衍射峰在17°和21°处出现。甘薯原淀粉结晶度最高为22.70%,在模拟体外消化过程中结晶度大小为甘薯淀粉-180 min>甘薯淀粉-30 min>甘薯淀粉-120 min>甘薯淀粉-60 min>甘薯淀粉-90 min。在消化前期,甘薯淀粉的结晶区和非结晶区均发生酶解,在消化120 min后结晶度稍有上升,这可能是由于非结晶区酶解作用更强烈,同时淀粉链出现重排现象造成的;同样,马铃薯淀粉消化也出现的类似情况,马铃薯原淀粉结晶度最高,为21.98%;消化时间为90 min时最低,为4.52%;在消化后期结晶度上升,可能是由于淀粉经过酶解非结晶区消失而出现分子重排现象。淀粉结晶结构类型影响淀粉消化,A 型淀粉对淀粉酶的抵抗力低于B 型淀粉,A 型淀粉中存在较短的双螺旋和内部微晶更易受酶水解的影响[22]。周定婷等[23]发现豌豆抗性淀粉的结晶度是随着消化时间的增长而增加的;另外Zhang 等[24]在研究微波湿热芭蕉抗性淀粉时也发现消化过程中淀粉结晶度上升;不同的是,他们研究的是抗性淀粉的消化,而且在消化前并未经过糊化;Lopez-Rubio 等[16]发现在消化过程中直链淀粉链可重新排列成结晶度较高的抗酶结构。
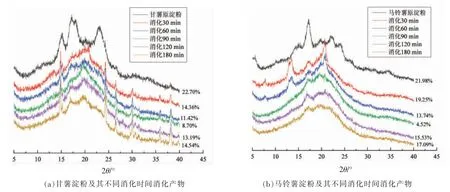
图6 甘薯淀粉和马铃薯淀粉及其不同消化时间消化产物X 射线衍射分析图Fig.6 X-ray diffraction analysis diagram of sweet potato starch,potato starch and their digestive products at different digestion times
3 结论
体外消化相同时间内甘薯淀粉水解率高于马铃薯淀粉;两种淀粉在消化期间,粒径呈多峰分布,且随着消化时间延长,消化产物的中值粒径向更大尺寸分布移动;随着消化时间的延长,两种淀粉消化产物中支链淀粉含量呈下降趋势,直链淀粉含量无显著变化。由于消化液的稀释作用和淀粉的酶解作用,两种淀粉在消化过程中黏度降低,在同样消化时间内甘薯淀粉黏度低于马铃薯淀粉黏度。甘薯淀粉和马铃薯淀粉由于消化酶的酶解,平整的表面出现不规则形状,且随消化时间的增长,孔状和旋涡状结构逐渐增多,出现小团簇。通过对甘薯淀粉和马铃薯淀粉及其消化产物的X-射线衍射分析可知,甘薯淀粉和马铃薯淀粉经体外消化后,其衍射峰的位置发生改变,结晶度在消化后期呈升高趋势。

