狂犬病毒M蛋白多克隆抗体的制备与鉴定
黎 强,丁 祎,刘高文,贾 亭,高媛媛,陈 芮,宋玉竹,韩芹芹,夏雪山,张金阳
(昆明理工大学 生命科学与技术学院,云南 昆明 650500)
0 引 言
狂犬病是由狂犬病毒感染神经系统引起的一种古老且缺乏有效治疗方法的人兽共患的一种病毒性传染病[1].该病一直是我国公共卫生关注的重点,一旦出现临床症状,死亡率几乎可达到100%[2].狂犬病患者一般是被含有狂犬病毒的动物咬到皮肤,唾液中的狂犬病毒进入到机体中引发感染.狂犬病的潜伏期较长,而患者发病后的前期临床症状会表现出精神不振,随着疾病的进程,患者逐渐出现神经症状不久因中枢神经衰竭而昏迷或死亡[3].根据WHO报道[4],每年因为狂犬病而死亡的人数约为5.5万至6万人.中国和一些发展中国家听从WHO的建议对人民进行狂犬病相关知识以及狂犬疫苗的普及,进而使狂犬病的患病人数减少,造成的社会经济损失也在减少.但是由于狂犬病的治疗没有特效药,使得每年因为狂犬病而死亡的人数也不少[5],是当前严重危害我国公共卫生的病毒性传染病.
狂犬病毒是一种单股负链不分节RNA病毒,全长基因组约为12 kb,从3’端到5’端编码5个结构蛋白,即糖蛋白(G)、核蛋白(N)、磷蛋白(P)、转录酶大蛋白(L)以及基质蛋白(M)[6].在这5个结构蛋白中,M蛋白的相对分子量最小,在病毒总蛋白中占11%[7].在狂犬病的整个生命周期中,M蛋白都扮演着一个至关重要的角色,同时很多学者已经广泛地研究和证实了M蛋白在病毒组装和形态发生以及包膜病毒颗粒出芽中所发挥的作用[8].最近,针对狂犬病病毒家族的成员狂犬病毒(RABV)进行的逆向遗传学实验发现,除了病毒装配以外,狂犬病病毒M蛋白还具有出乎意料的功能,即RNA合成的调控深刻影响复制以及复制的平衡[9].此外M蛋白与G蛋白之间发生相互作用去参与宿主免疫反应,以M蛋白为核心,G蛋白起协同作用[10].因此,通过对RABV-M的研究有助于去揭示RABV在宿主上的致病机理.当前,在对RABV的研究过程中,没有合适的的单抗或多抗就会严重阻碍研究步伐.因此,开发适宜的抗体已经成为我们进行相关研究的前提条件.
1 材料与方法
1.1 材料
小鼠神经瘤母细胞N2a,RABV CVS-11毒株,E.coliDH5α感受态细胞,E.coliRosetta(DE3)及原核表达载体pET-28a均由昆明理工大学分子诊断实验室保存.Balb/c小鼠购于昆明医科大学实验动物中心.
1.2 试剂及仪器
Trizol购于天根生物科技有限公司;蛋白高分子量预染Marker购于Thermo公司;DL2000 DNA Marker、T4 DNA连接酶和各种限制性内切酶均购自TaKaRa 公司;HiScript II 1st Strand cDNA Synthesis Kit、2×Taq Master Mix (Dye Plus)均购自Vazyme公司;质粒小提试剂盒和琼脂糖胶回收剂盒购自北京庄盟公司;IPTG和铝佐剂购自索莱宝公司; 考马斯染色液、脱色液由本实验室配置;镍柱购于武汉汇研公司.SDS-PAGE电泳仪和核酸电泳仪购于北京六一公司;上海跃进医疗仪器厂台式恒温培养箱;Sigma 高速离心机;FormaCO2细胞培养箱;Canon 倒置荧光显微镜等.
1.3 方法
1.3.1 目的基因M的扩增
根据GenBanK数据库中CVS-11毒株中的M基因序列(序列号:ADJ29910.1),设计M的引物,同时引入BamHⅠ,HindⅢ酶切位点(下划线部分).M正向引物为5′-CGCGGATCCATGAACGTTCTACGCAAGATAGTG-3′,反向引物为5′- CCCAAGCTTTAATTCTAGAAGCAGAGAAGAGTCTTTG-3′.Trizol 法提取CVS-11病毒感染N2A细胞的总RNA,以RNA为模板进行RT-PCR得到cDNA,再以cDNA为模板板扩增目的基因,50 μL 的 PCR 反应体系如下: 2×Taq Master Mix (Dye Plus) 25 μL、正反向引物各 2 μL;模板 DNA:3 μL、ddH2O 18 μL.反应程序为:95 ℃ 3 min 后,95 ℃ 15 s,56 ℃ 15 s,72 ℃ 1 min,共35个循环,最后 72 ℃ 5 min.PCR结束后,将产物以2%琼脂糖凝胶电泳鉴定.
1.3.2 原核表达载体的构建和鉴定
PCR产物按照北京庄盟生物的琼脂糖胶回收试剂盒里的操作说明书回收,用微量分光光度计测定回收后的DNA浓度.随后用限制性内切酶BamHⅠ和HindⅢ对M基因和原核表达质粒pET-28a进行双酶切(37 ℃,5 h).使用胶回收试剂盒回收双酶切产物,测定回收后的DNA浓度,将目的基因和pET-28a质粒的双酶切回收产物按照3∶1 的摩尔比混合,16 ℃ 过夜连接.连接产物转化至DH5αE.coli感受态细胞中,涂布于含 100 μg/mL 卡那抗性的 LB 固体平板上,37 ℃ 过夜培养 14 h.在LB 平板上随机挑取 5 个单菌落置于含 100 μg/mL 卡那抗性LB液体培养基中,200 r/min,37 ℃ 培养3~5 h,分别取菌液进行PCR鉴定,阳性克隆子送至擎科生物科技有限公司测序.
1.3.3 目的蛋白M的诱导表达和纯化
将测序正确无误的含重组质粒的菌液提取质粒 pET-28a-CVS-M(用质粒小提试剂盒).将提取出的重组质粒 pET-28a-CVS-M转化于E.coliRosetta(DE3)感受态细胞中,将转化菌接种于含卡那抗性的LB培养基试管中,37 ℃,200 r/min 培养3~5 h 后,然后将菌液按照1∶100接种至含卡那抗性的 300 mL 的LB培养基的 1 L 锥形瓶中,继续在 37 ℃、200 r/min 培养至OD值达到0.6左右时,加入IPTG 至终浓度为 1 mmol/L、4 ℃,50 r/min 诱导表达 12 h,收集菌液.同时设诱导前的菌体为对照.菌体蛋白经SDS-PAGE电泳后,观察M蛋白的表达.表达出来的M蛋白通过超声破碎后离心分为上清和沉淀,其上清为可溶性表达的M蛋白,直接通过Ni柱进行纯化,即非变性条件下纯化;而沉淀为以包涵体形式存在的M蛋白,用8 M尿素对其蛋白进行变性,使M蛋白暴露出来,再通过Ni柱进行纯化,即变性条件下纯化;纯化步骤参照Seitkamal等[11],并进行纯化产物的分析.纯化的M蛋白经BCA法测定蛋白质浓度于 -80 ℃ 保存备用.
1.3.4 M蛋白鼠多克隆抗体的制备
以重量为 20 g 雌性小鼠作为实验对象,将纯化后的重组M蛋白用PBS稀释后与不完全佐剂混合.每次取 100 μL 混合物 (含 30 μg 蛋白) 注射到皮下多位点免疫Balb/c小鼠,对照组注射 100 μL PBS 与不完全佐剂混合物,每次免疫间隔 14 d.小鼠免疫 28 d 后,每隔14天进行尾部静脉采血,用ELISA检测小鼠血清中M蛋白抗体效价.
1.3.5 ELISA 检测多克隆抗体的效价
用CBS将重组M蛋白稀释至 10 μg/mL、100 μL/孔、4 ℃ 包被过夜.次日,弃掉包被液,用PBST洗涤3次;5%脱脂奶 37 ℃ 封闭 2 h,200 μL/孔,PBST洗3次,至孔内没有洗液残留;加入5%脱脂奶倍比稀释(1∶100~1∶204 800)的多抗血清,100 μL/孔,37 ℃ 孵育2 h,PBST 洗5 次;加入用5%脱脂奶按 1∶10 000 稀释的HRP标记山羊抗鼠的IgG,100 μL/孔,37 ℃ 孵育 1 h, PBST洗3次;每孔加入 100 μL TMB显色液避光反应 20 min;50 μL/孔 的2 M H2SO4终止反应,测OD 450值,分析数据.
1.3.6 IFA法检测多克隆抗体的特异性
将N2A细胞消化铺96孔板培养,待细胞贴壁后,每孔 2 μL CVS病毒混合后加入到孔中,培养 48 h.细胞培养 48 h 后,回收病毒,使用预冷的固定液 -20 ℃ 静置 30 min,通风处风干96孔培养板.5%脱脂奶于 37 ℃ 封闭 2 h,PBST洗涤3次.加入5%脱脂奶倍比稀释的鼠多抗血清,37 ℃ 孵育 2 h,PBST洗涤5次.以 1∶1 500 稀释的FITC-山羊抗鼠IgG,100 μL/孔,37 ℃ 孵育 1 h,PBST洗涤5次,荧光倒置显微镜观察[12].
1.3.7 狂犬病毒M蛋白多克隆抗体的中和活性测定
将多抗血清放置于 56 ℃ 水浴锅中灭活 30 min 后,进行倍比稀释;取 50 μL 多抗血清与等体积含104TCID50/0.1 mL 的狂犬病毒CVS株进行混合,以正常小鼠血清为对照,37 ℃ 反应 2 h;然后接种到N2A细胞中培养,每个做三个平行;培养 48 h 后,固定细胞,以实验室前期制得的抗狂犬病毒N蛋白抗体1N1(1∶1 000)进行IFA检测,并与正常小鼠血清对比,根据Spearman/Karber 方法计算血清抗体效价[13].
2 结 果
2.1 PCR扩增 M 基因
从CVS-11病毒感染的N2A细胞中提取RNA,然后进行RT-PCR,产物经2%琼脂糖凝胶电泳检测,在500~750 bp 之间出现了一条特异条带,与目的基因M的理论值 609 bp 一致(见图1).
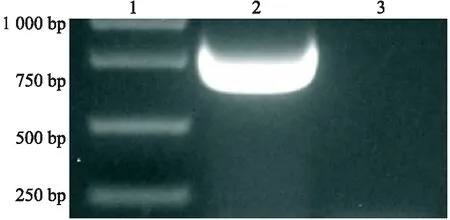
1.DL5000 DNA marker;2.PCR扩增的M基因;3.Negative control 图1 M基因PCR扩增 Fig.1 Amplification of M gene by PCR
2.2 pET-28a-CVS-M重组原核载体鉴定
取 1 μL 菌液作为模板进行 PCR 鉴定,将扩增出与目的基因大小相符的 DNA 片段的重组质粒菌液送擎科生物公司测序,测序结果经过NCBI上的BLASTn以及手工比对后显示,插入载体的片段与目的基因的相似度为100%,插入序列无发生突变,表明成功构建了重组质粒pET-28a-CVS-M(见图2).
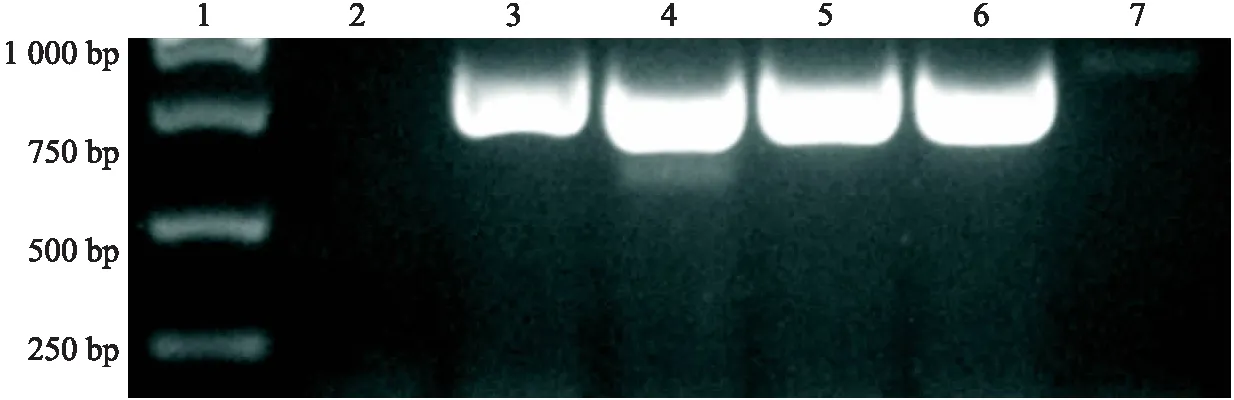
1.DL 5000 DNA marker;2.Negative control;3、4、5、6、7.随机挑取的5个单菌落.图2 重组质粒 pET-28a-CVS-M PCR鉴定Fig.2 PCR identification of recombinant plasmid pET-28a-CVS-M
2.3 重组M蛋白表达与纯化
重组表达质粒pET-28a-CVS-M成功转入大肠杆菌Rosetta(DE3)后,经过扩大培养与IPTG 诱导后,对于诱导前后的菌液进行 SDS-PAGE 分析.结果表明:重组表达菌在 IPTG 诱导下,大量表达相对分子量约为 28 kD 的目的蛋白,大小与预期相符(见图3).在Western blotting实验中,诱导表达出来的重组M蛋白与鼠源His-tag多克隆抗体发生反应,在约 28 kDa 处出现了一条特异性的蛋白条带,未进行诱导的菌体的蛋白没有(见图4),与SDS-PAGE的分析结果一致.表明含有His标签的重组M蛋白正确表达.上述结果证实,本研究已获得重组M蛋白,测定其浓度为 1 mg/mL.

1.非预染蛋白maker;2.未诱导菌体;3.诱导菌体超声破碎后的细胞沉淀;4.诱导菌体超声破碎后的细胞上清;5.纯化的重组M蛋白图3 重组蛋白纯化的SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant proteins
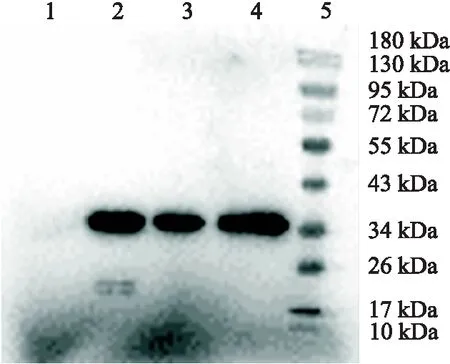
1.未诱导菌体;2.诱导后的菌体;3.非变性条件下纯化的重组M蛋白;4.变性条件下纯化的重组M蛋白;5.预染蛋白marker图4 重组蛋白纯化的Western bloting分析Fig.4 Western bloting analysis of recombinant proteins
2.4 CVS-M蛋白小鼠多克隆抗体具有较高的效价和较好的特异性
运用 ELISA 检测小鼠血清中CVS-M 抗体效价,结果显示蛋白与福式佐剂混合物能够诱导小鼠产生的抗体效价达 1∶204 800(见图5),表明重组M蛋白具有免疫原性.利用IFA法进一步鉴定所制备的多克隆抗体,结果显示,免疫了CVS-M蛋白的小鼠血清对于感染CVS病毒的细胞有阳性反应,小鼠血清对于未感染病毒的细胞则无反应(见图6),说明多抗血清能够在体外细胞中特异性识别CVS病毒,进而表明本研究制备的鼠抗CVS-M蛋白多克隆抗体可与CVS-M蛋白发生良好的免疫反应.
2.5 狂犬病毒M蛋白多克隆抗体的中和活性测定
结果显示,本文制备的狂犬病毒M 蛋白多克隆抗体没有明显的病毒感染抑制现象,无中和活性.
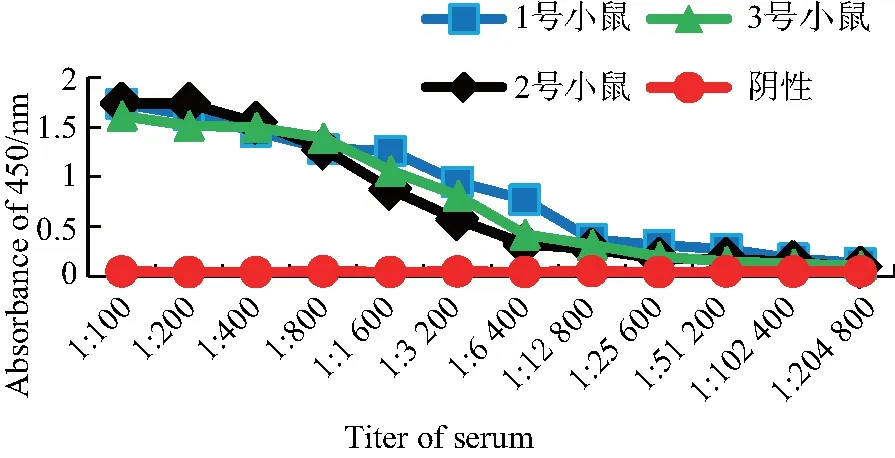
图5 鼠抗RABV M蛋白多克隆抗体效价测定Fig.5 Titer determination of mouse polyclonal antibodies against RABV M protein
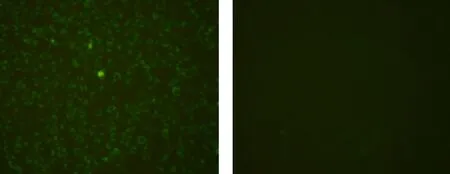
(a)感染RABV-CVS毒株N2A 细胞 (b)未感染RABV-CVS毒株N2A细胞图6 鼠抗RABV M蛋白多克隆抗体鉴定Fig.6 Identification of mouse polyclonal antibodies against RABV M protein
3 讨 论
狂犬病是一种神经系统疾病,该病对于所有温血动物来说都是非常致命的.感染狂犬病会引起神经性脑炎,最后会因为呼吸衰竭、无法吞咽而窒息死亡,对发展中国家人群健康造成严重威胁[14].RABV基因组编码N、P、M、G和L共5种结构蛋白.狂犬病毒M 蛋白是最小的RABV结构蛋白,也是一个发挥着多种功能的高丰度蛋白[15].M蛋白在整个狂犬病生命周期中扮演着一个必不可少的角色,它在病毒粒子的装配、出芽以及病毒形态的形成这些过程中发挥着重要作用,也可以调节病毒基因组的转录与复制之间的平衡,在宿主细胞蛋白合成过程中抑制蛋白质合成,诱导细胞凋亡[16-17].另外,街毒Nishigahara(Ni)株的M基因被Mita等替换成了Ni-CE株的M基因后,重组病毒使NA细胞产生了细胞病变(CPE);比较这两株病毒中的M蛋白后发现,Ni-CE株M蛋白的第95位氨基酸是细胞产生CPE的关键位点,且对病毒的致病性有一定的影响[18].Ito等也证实Ni-CE株M蛋白的第95位氨基酸在细胞病变中发挥着重要作用,而第29位氨基酸不能使细胞产生明显的CPE[19],进而说明M蛋白的第95位氨基酸在病毒致病过程中发挥着重要作用,Shimizu反向替换这两株病毒的M基因,发现Ni-CE株替换Ni株M基因后,重组病毒CE(Ni M)可致死成年小鼠[20].由此可以说明,M蛋白可以影响狂犬病毒的致病性.那么在狂犬病毒致病过程中,单独的M蛋白分子发挥着什么作用呢?基于此问题的研究对进一步探讨 M 蛋白在RABV致病性中的作用以及研究RABV的致病机制具有重要意义.本项研究诱导表达的RABV-M蛋白正好为研究M 蛋白对RABV致病性的影响以及研究RABV的致病机制提供一个有力的工具.
原核表达系统与真核表达系统的区别在于能否修饰表达的蛋白,但原核表达系统有成本较低、简便以及蛋白表达量高等优点,经常用来表达原核蛋白或者不用翻译后修饰的真核来源蛋白[21].而杆状病毒表达系统等方法成功表达RABV-M蛋白,但成本较高,操作繁琐,并且病毒侵染导致的细胞崩解会造成胞内蛋白降解[22].大肠杆菌原核表达系统,繁殖快、抗污染能力强,表达产量高、表达产物分离纯化较简单、稳定性好等特点[23].结合以上表达系统的优缺点,我们选择了大肠杆菌原核表达系统.因此,在本项研究中,通过分子克隆技术构建pET-28-CVS-M原核表达载体,成功实现了M蛋白的原核表达,但在蛋白的诱导表达过程中,M蛋白主要以包涵体形式存在.包涵体有聚集目的蛋白且能抵抗蛋白酶的降解作用,以及对宿主细胞毒性小的优点,但也有纯化出来的蛋白生物活性较低的缺点[24].因此在诱导表达过程中,我们可以通过降低诱导剂IPTG的浓度、诱导温度和转速等方法来提高蛋白的可溶性表达[25].在M蛋白的诱导过程中,我们尝试 1 mM IPTG、16 ℃、120 r/min 诱导 12 h,上清中的M蛋白表达量依然有限,可能与M蛋白的89-107疏水区有一定的关系[26].最终,选择 1 mM IPTG、4 ℃、50 r/min 诱导 12 h,此时M蛋白的表达量最高.在非变性条件下纯化出来的重组M蛋白与His-tag多克隆抗体进行间接ELISA反应时,结果不太理想;而在变性条件下纯化出来的M蛋白与His-tag多克隆抗体进行间接ELISA反应良好;但无论是非变性条件下还是变性条件下纯化出来的重组M蛋白与与His-tag多克隆抗体进行Western bloting反应时,条带单一且大小与预期值符合,说明诱导表达出来的蛋白就是我们需要的目的蛋白.因此,猜测可能在非变性条件下纯化重组M蛋白时,重组 M蛋白C末端的 His标签被折叠到重组 M 蛋白空间结构内部,或被其他空间结构掩盖住,所以重组M 蛋白的 C末端的 His 标签就无法暴露出来,所以重组M蛋白与His-tag多克隆抗体进行间接ELISA时,实验结果不太理想.而在变性条件下,几乎蛋白都失去其空间结构,肽链之间或肽链内部相互作用的化学键断开,肽链被展开,重组M蛋白C末端的 His 标签便裸露出来,所以与His-tag多克隆抗体进行反应时,结果比较理想[22].
当前,对于狂犬病毒的检测主要包括抗原检测和抗体检测.其中抗原检测方法包括病原学检查、病毒分离、内基氏小体检查、琼脂扩散实验以及荧光抗体病毒中和试验(FAVNT)[27]等,而对脑组织和唾液等进行直接免疫荧光检测(FAT)[28]及乳鼠脑内接种实验(MIT)[29-30]、聚合酶链式反应检测[31]、酶联免疫吸附实验(ELISA)、快速酶免疫诊断(PREID)[32-33]、免疫组织化学等方法;针对抗体的检测方法包括血清和细胞病变中和实验检测.而在上述的检测方法中,酶联免疫吸附实验(ELISA)相较于其他检测方法,操作方法更加简便,检测周期更短,不需操作复杂的仪器以及对周边环境要求较低等优点,采用间接ELISA的检测方法时,酶标二抗更可放大抗原抗体的结合效果,提高了灵敏性,更适用于实验室以及医院临床检测[34].因此,本研究成功制备了RABV-M蛋白的多克隆抗体,且制备的鼠抗M多克隆抗体具有良好的反应原性,为研制基于M蛋白的RABV间接ELISA抗体检测方法奠定基础.
4 结 论
本文通过原核系统成功制备了重组M蛋白,以纯化后的M蛋白作为抗原制备相应的多克隆抗体,获得以下主要结论:
1)通过PCR、双酶切和测序鉴定,获得pET-28a-CVS-M原核表达载体.
2)重组表达菌株在 4 ℃、 1 mM IPTG和 50 r/min 条件下诱导表达出M蛋白,纯化后蛋白浓度为 1 mg/mL.
3)重组M蛋白免疫Balb/c小鼠获得多克隆抗体,ELISA和IFA检测确定抗体具有较高的效价和良好的特异性.

