CRISPR/Cas9在β-地中海贫血治疗中的研究进展
贺 静,吴柳娇
(1. 昆明理工大学 医学院,云南 昆明 650500; 2. 云南省第一人民医院 医学遗传科,云南 昆明 650032)
0 引 言
地中海贫血又称为海洋性贫血或珠蛋白生成障碍性贫血,是一种威胁人类健康的致死、致残的常见遗传性疾病,主要分布在疟疾高发的热带和亚热带地区.β-地中海贫血(地贫)在我国主要分布于长江以南的广大地域,其中广西、广东、海南和云南为高发地区.其基因突变具有高度的异质性,不同种族人群的基因突变类型不同.β-地贫的临床症状轻重不一,可分为轻型、中间型、重型[1],其致病原因是由于β-珠蛋白基因的点突变或微小缺失而影响基因的转录、剪接或翻译,导致β-珠蛋白链的生成减少患者红细胞中过多的α-珠蛋白链沉淀、氧化应激、红细胞过早死亡,骨髓中无效红细胞生成和红系扩张,最终导致贫血[2].到目前为止,已经在HBB基因的三个外显子、剪接位点和其他调控元件中发现了200多个突变.对于重型β-地贫患者临床上主要采取长期规范输血、成分输血等方法进行对症治疗,这些短效的治疗方法无法根治,且长期反复输血和无效红细胞的生成会导致铁负荷过高、脾肿大、骨骼改变、生长迟缓、纤维硬化和肝硬化、心力衰竭、内分泌疾病等,还可能会引发感染和过敏反应,甚至导致死亡[3].
目前,造血干细胞移植是唯一治愈β-地中海贫血的方法,但是,由于移植物抗宿主疾病和缺乏免疫匹配的供者,这种移植技术受到了限制[4].对于缺乏供者的患者来说,移植自体的、经过基因矫正的造血干细胞是一种潜在的替代选择[5].CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins9,CRISPR/Cas9)是一个基因组编辑工具,它的出现为治疗人类疾病,特别是遗传疾病提供了一条较好的途径.近年来,利用CRISPR/Cas9技术对β-地贫患者的诱导多能干细胞(Induced Piuripotent Stem Cells, IPSCs)进行基因矫正,矫正后的IPSCs可正常用于造血分化,并恢复HBB基因的表达,或通过重新激活γ-珠蛋白基因的表达而减轻β-地中海贫血的临床症状,从而为β-地中海贫血的治疗提供了一个潜在的选择.
1 CRISPR/Cas9的作用机制
CRISPR/Cas9系统包括sgRNA(single-guide)和Cas9核酸酶两部分,是一种细菌免疫系统,可以裂解噬菌体或质粒DNA,使特定基因组DNA位点的插入或缺失成为可编辑的靶点[6].
CRISPR/Cas9介导的序列特异性靶标识别首先依赖于碱基对PAM序列的识别,然后依赖于sgRNA的20个核苷酸的延伸与DNA目标位点之间杂交,在靶位点产生双链断裂(Double Strand Break,DSB),CRISPR/Cas9产生的DSB将触发细胞DNA修复过程,包括非同源末端连接(Non-Homologous End Joining,NHEJ)介导的易错DNA修复和同源重组修复(Homology Direct Repair,HDR)介导的无错DNA修复,NHEJ介导的DNA修复可以快速连接DSB,但在目标位点产生少量插入和缺失突变,这些突变可以帮助我们破坏或取消靶基因或基因组元件功能.HDR介导的无错DNA修复比NHEJ介导的DNA修复更为复杂,且无错DNA修复需要一个含有同源性的供体DNA序列作为修复模板[7].
2 CRISPR/Cas9技术与其他基因编辑技术的比较
基因编辑技术已经成为操纵基础研究和基因治疗中基因表达的强大工具,锌指核酸酶(Zinc-Finger Nucleases,ZFN)、转录激活因子样效应物核酸酶(Transcription Activator-Like Effector Nucleases,TALENS)和CRISPR/Cas9是过去十年中基因编辑中最常用的三种工具,在这三种技术中,CRISPR/Cas9技术是该领域最新的参与者;ZFN是第一个也是最成熟的基因编辑工具,其有两个结构域:锌指DNA结合区和DNA裂解区,DNA结合域识别并结合特定的目标DNA序列,这种结合使切割结构域能够断裂双链DNA,从而通过非同源末端连接或同源重组修复来触发DNA的修复过程,该方法需要不同的锌指核酸酶的组合来确保基因编辑的序列特异性,且ZFN在设计和成本方面要求很高.TALENS中的DNA结构域是由33~35个氨基酸模块组成的TAL效应器,每个模块识别单个核苷酸,与ZFN类似,TALEN也使用Fork1来切割目标DNA,由于TALEN的分子比ZFN大得多,它可能会影响分子进入细胞的效率,TALEN需要制造许多对来测试它们的切割效率,此外,DNA的甲基化和组蛋白乙酰化可能会影响它们的效率[8].
与ZFN和TALENS相比,CRISPR/Cas9有几个优点,ZFN和TALENS是建立在蛋白质引导的DNA切割基础上的,这需要复杂和耗时的蛋白质工程、选择和验证;相比之下,CRISPR/Cas9技术只需要一个较短的可编辑的gRAN来进行DNA的靶向,相对便宜,易于设计和制造,通过使用Cas9和几个不同的靶点的gRNA,CRISPR/Cas9能够同时诱导多个独立位点的基因组修饰[7].基于CRISPR/Cas9基因编辑系统的有效性,它是治疗地中海贫血的一种有前途的、可行的和安全的方法[9].许多的研究报告表明,CRISPR/Cas9技术比ZFN和TALENS具有更好的靶向效率,但其效率仍因细胞类型和研究实验室而异.
3 CRISPR/Cas9技术在β-地中海贫血中的应用
3.1 诱导胎儿血红蛋白的表达
3.1.1 HPFH突变诱导胎儿血红蛋白产生
正常成人在出生后HBG基因表达逐渐关闭,表现为胎儿γ-珠蛋白表达减少,而成人β-珠蛋白表达增加,对于β-地中海贫血患者来说使血红蛋白完成胎儿到成人的转换,可以结合患者体内过多的α-珠蛋白链,地贫的症状就会得到缓解.例如,在遗传性胎儿血红蛋白增高症(Hereditary Persistence of Fetal Hemoglobin,HPFH)中,这是一种良性的遗传条件,HPFH包括大量的基因突变,这可能是由于γ-珠蛋白基因上游启动子区域的小片段缺失或点突变破坏或重新创造了一些调节因子的结合位点,或者是破坏了β-珠蛋白基因的启动子.突变会重新激活体内HBG基因的表达,导致Hb F在体内高水平表达,常见的HPFH突变如图1所示,HPFH与β-地中海贫血相关基因突变共遗传可减轻地贫的临床表现[10].
对于如何应用CRISPR/Cas9技术来实现HPFH突变而减轻地贫的临床症状,在TRAXLER等人[10]的研究中,进行了CRISPR/Cas9介导的基因组编辑技术,以突变HBG1和HBG2基因启动子中存在的13个核苷酸序列(HBG1和HBG2转录起始点的-114至-102位),从而诱导了自然发生的HPFH相关突变,编辑后的祖细胞产生Hb F水平升高的红细胞,为β-地中海贫血的基因组编辑介导的治疗确定了一个潜在的DNA靶点.但在未来的研究中还需优化HGB1和HBG2 CCAAT box-DR位点在人类造血干细胞中的定位,并将潜在有害的靶外突变降至最低.在Ye等人[11]的研究中,利用CRISPR/Cas9技术,在正常的造血干细胞和祖细胞中删除了13kb的β-珠蛋白位点,以模拟自然发生的HPFH突变,在细胞内的靶向缺失达到了31%,与未缺失的细胞相比,γ-珠蛋白的表达显著增加,且没有检测到任何的脱靶效应.在Liu等[12]的研究中,发现TGACCA序列的突变能够诱导HPFH的发生,BCL11A可以通过锌指结构域识别序列TGACCA,通过编辑TGACCA序列可阻止BCL11A结合并重新激活γ-珠蛋白的表达.
3.1.2 靶向调控激活胎儿血红蛋白表达的调节因子
增加γ-珠蛋白的表达可以改善输血依赖型的β-地中海贫血,γ-珠蛋白是一种与α-珠蛋白构成异位四聚体胎儿血红蛋白,在β-地中海贫血中,γ-珠蛋白的表达可以替代其缺失的功能,因此,提高γ-珠蛋白的表达具有较大的治疗意义.有几种转录因子和顺式作用元件调节胎儿到成人的血红蛋白的转换过程,包括BCL11A、ZBTB7A、KLF1、DNMT1、MYB、HRI,在这些元件中,BCL11A和ZBTB7A已经被证明是小鼠模型和人类细胞中γ-珠蛋白基因沉默的主要调节因子.调节机制如图2所示[13].
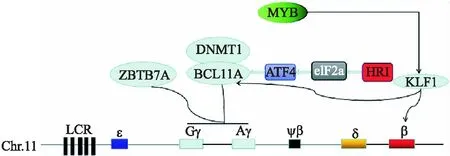
图2 γ-珠蛋白表达的相关调控机制Fig.2 Related regulation mechanism of γ-globin expression
BCL11A通过与其他已知的γ-珠蛋白抑制物结合来抑制胎儿血红蛋白的表达,并能与β-珠蛋白基因位点控制区LCR的相互作用,因此,通过敲除BCL11A来治疗β-地中海贫血是一种潜在的有效策略,BCL11A在造血干细胞的自我更新、B淋巴细胞的成熟和中枢神经系统的发育中起着重要的作用,真正具有挑战的是仅抑制BCL11A在红系细胞中的表达,因为阻断BCL11A具有超出珠蛋白控制的关键生理作用;重要的是,发现了一个红系增强子序列,该增强子的失活只在红系细胞中导致BCL11A的抑制和γ-珠蛋白的诱导[13].
以往的研究证据表明,对BCL11A基因外显子2编码区的基因组修饰并不是一种实用的治疗方法,因为它在淋巴发育和造血干细胞功能中发挥着重要的作用.针对这一问题的研究表明,针对性的灭活BCL11A红系特异性增强子可能是一种替代性的策略,Khosravi等人的研究中,在第二个内含子的BCL11A增强子中,基于CRISPR/Cas9的一个小的基因组缺失,也能够激活成人到胎儿血红蛋白的反向转换和胎儿血红蛋白的合成.在Huang等人[14]的研中,发现γ-珠蛋白基因的沉默需要红系特异性的elF2α激酶HRI,并确定了一个转录因子ATF4,是一个受HRI调节的蛋白,是一种新的γ-珠蛋白调节因子,通过与其增强子结合直接刺激γ-珠蛋白转录抑制因子BCL11A的转录,但其中值得注意的是,在该研究中,HRI缺陷小鼠表现出正常的BCL11A水平,这表明了具有物种选择性调节.在Niu等人[15]的研究中,一名β-地中海贫血患者接受了CTX001治疗,CTX001是针对患有严重β-地中海贫血患者采用CRISPR/Cas9技术编辑的针对同一BCL11A增强子的自体CD34+细胞的造血干细胞疗法,在进行治疗一年后,患者的骨髓和血液中的等位基因编辑水平都很高,胎儿血红蛋白含量增加,输液独立,消除了血管闭塞发作.但在患者输注CTXOO1后,患者出现了不良事件,包括中性粒细胞减少的肺炎、脓毒症、腹痛等,还观察到了淋巴细胞减少的非严重不良事件,原因可能是导致了淋巴细胞恢复的延迟;且在该项研究中,这些结果对于其他患者的普适性还有待研究.
3.2 纠正珠蛋白基因的表达
在β-地贫患者中发现了200多种不同类型的Hb基因突变,这种突变可能位于DNA片段中的任何位置,其中包含三个外显子、剪接位点和其他调节元件,治愈β-地贫等遗传性疾病的理想方法是纠正导致这种疾病的突变.近年来,利用CRISPR/Cas9技术在特定位点来制造特定的DSB和HDR以纠正特定的基因突变已经成为首选的方法.在人类的多能干细胞中,同源重组基因打靶尤为困难,CRISPR技术的最新发展为提高同源重组率提供了新的途径,使用ssODNs代替供体载体修复HBB基因突变,并插入带有Cas9基因的选择标记,这避免了使用供体载体作为HDR模板时遇到的问题.ssODNs对HDR更有效、细胞毒性更低[15].
Cai等人[16]的研究为利用CRISPR/Cas9技术来纠正各种Hb突变成为一种通用的策略提供了原理证明,在其研究中使用了两个有效的引导RNA和一个DNA模板,该研究证明了这种通用的方法能够纠正各种Hb基因突变,恢复β-珠蛋白的产生.对β-地中海贫血患者体内的IPSCs进行基因编辑可以为治疗这种疾病提供一条新的途径,纠正IPSCs的致病突变可以恢复正常功能,并为移植提供了丰富的来源.在Xie等人[17]的研究中,利用了CRISPR/Cas9技术,有效地纠正了患者来源的IPSCs中的HBB突变,且在矫正的基因中没有检测到非靶点效应,细胞保持了完全的多能性,并显示出正常的核型,从而证明了未来基于干细胞的基因治疗在单基因疾病中的应用迈出了关键的一步.在Niu等人[15]的研究中,设计了针对HBB基因CD41/42突变的CRISPR/Cas9,证明了ssODNs与CRISPR/Cas9结合能够纠正β-地中海贫血IPSCs中的HBB基因CD41/42突变.重要的是在该项研究中,根据全外显子测序,没有在矫正的IPSCs的外显子中检测到高突变负荷,这对未来的临床应用是必不可少的,这为那些骨髓与潜在捐赠者不匹配的人提供了一种新的治疗选择.
3.3 抑制α-珠蛋白基因的表达
基于α-珠蛋白链与β-珠蛋白链不平衡所致的无效红细胞生成和溶血的β-地贫的病理生理,当α-地贫合并β-地贫时,过多的游离的α-珠蛋白就会大大的减少,从而在很大程度上减轻了患者的临床症状[18],在Mettananda等人[18]的研究中,利用CRISPR/Cas9技术对原代人类造血干细胞进行基因编辑,删除了MCS-R α-珠蛋白的增强子,并导致α-地中海贫血,当编辑的CD34+细胞分化为红系细胞时,观察到α-珠蛋白表达的预期减少和β-地贫患者细胞中病理性珠蛋白链失衡的纠正,异种移植后的CD34+细胞中有一部分是长期再生造血干细胞[19],这表明了这种方法有可能转化为治疗β-地贫的方法.
4 CRISPR技术应用于地贫治疗存在的问题
在CRISPR技术应用于临床之前,必须满足许多条件,它的编辑效率和递送效率必须足够大,才能达到临床上有意义的结果,且永久性的非预期变异所产生的不良事件应该最小化[20].
4.1 脱靶效应
脱靶效应(off-target effect)是目前CRISPR/Cas9面临的最大问题,即在基因组的非目标位置产生非必要的突变.目前已经有关于CRISPR/Cas9应用在血液病学中基因治疗,并取得里程碑式的研究进展,但伴随其脱靶效应等问题,依然是CRISPR/Cas9系统应用于临床的一个障碍[21].非靶标突变是一个主要的安全问题,基因修改是永久性的,如果突变发生在重要的位点,将会产生毁灭性的后果.
有研究表明,通过改变它们的长度、二级结构或化学成分,通过延长双链长度来修改sgRNA结构,并将胸腺嘧啶连续序列中的第四个胸腺嘧啶突变为胞嘧啶或鸟嘌呤,可以显著提高细胞的基因敲除效率[22-23].近年来,许多改良的广泛靶向性的工程化Cas9蛋白已被开发出来,例如Cas9切口酶或Fok1与降解的sgRNA融合来执行ssDNA的断裂,这可以显著的降低WT Cas9变体的脱靶效应.同时也可以通过改变CRISPR/Cas9核酸酶的PAM识别位点而不损失靶向特异性来增加CRISPR/Cas9核酸酶的靶向能力,具有改变PAM靶向性的Cas9核酸酶的不同变体,如VQR和VRER变体在人类细胞中表现出更强的特异性,其他的变体还包括xCas9,它可以识别比自然Cas9更广泛的PAM序列[24].在Xie等人[25]的研究中,为解决CRISPR/Cas9技术的脱靶效应,使用了最新的高保真的SpCas9-HF1来靶向特定患者的IPSCs.Gehrke等人[26]利用工程化的人APOBE3A(eA3A)结构域来减少非靶向突变,该结构域根据TCR>TCY>VCN层级优先使特定基序中的胞苷脱氨基,与人类细胞中广泛使用的碱基编辑器3(BE3)融合相比,eA3A-BE3融合在TC基序中对胞苷的活性相似,但在其他序列背景下对胞苷的编辑大大减少,eA3A-BE3纠正β-地贫启动子突变的精度比BE3高得多(>40倍),并且eA3A-BE3在已知的BE3非靶点上显示出较低的突变频率.
4.2 递送效率
基于CRISPR/Cas9的治疗转化为活体应用是不小的壮举,在临床上有效使用CRISPR/Cas9系统仍然是主要的障碍.将Cas9蛋白导入胞浆和细胞核是CRISPR系统应用的主要障碍,到目前为止,CRISPR/Cas9系统已在体内和体外成功地应用于质粒DNA、mRNA或功能性的蛋白复合物中.
在许多的研究中,腺相关病毒(Adeno Associated Virus, AAV)是体内常用的递送载体,不同的AAV血清型为特定细胞类型提供了更高的传递效率,从而允许组织/器官靶向.由于AAV引起的免疫反应可能会限制其应用.但AVV还可以驱动转基因的长期表达,并可能导致转基因整合的发生率较低,这促进了组织中持久的基因编辑,因此有很高的偏离目标突变发生的风险,这需要长期灭活Cas9活性的方法,以防止体内长期引入双链断裂,并降低染色体异常的风险.根据体外编辑的干细胞类型,基因编辑机制可以通过电穿孔、显微注射、细胞穿透肽和纳米颗粒等化学方法以及基于病毒的载体来进行传递[27].
到目前为止,基于编辑最具挑战性的方面是它的传递性、特异性和有效性,体外的方法可以在受控的环境中进行,易于使用多种方法进行有效的设计,这可能是将精确的基因编辑药物带入临床的更直接的方式,体内的方法将面临不受控制的目标外事件的挑战,如果使用持续表达Cas9的策略可能会带来长期处于基因编辑中的风险,从而增加脱靶效应的风险.在这种背景下,选择合适的递送工具,高度特异性的基因定位工具是一个防止意外变异和减少潜在的免疫反应的一个潜在方法[19,28].
5 结语与展望
CRISPR/Cas9技术用于地中海贫血的治疗主要包括以下几个方面:
1)通过诱导γ-珠蛋白基因上游启动子区域的小片段缺失或点突变以及删除β-珠蛋白基因的启动子来诱导Hb F升高,从而减轻地贫的临床症状;
2)通过调节胎儿血红蛋白的转录因子或顺式作用元件如BCL11A、ZBTB7A、KLF1、DNMT1、MYB、HRI等,从而诱导γ-珠蛋白的表达来替代β-地中海贫血中的功能缺失;
3)在特定位点来制造特定的DSB和HDR,以纠正特定的基因突变;
4)通过删除α-珠蛋白基因的增强子来减少过多游离α-珠蛋白基因的表达,从而减轻因α-链和β-链不平衡所致β-地贫患者的临床症状.
β-地贫是一种给我国带来巨大公共卫生负担的遗传性疾病,因此,探索新方法来治疗疾病,改善患者的生活质量成为了迫切的需要.近年来,CRISPR/Cas9技术在地贫中的应用为β-地贫的治疗打开了一扇新的大门,该技术能够用于治疗β-地贫,缓解β地贫患者的临床症状,但是由于该技术存在一系列的脱靶效应和递送效率的问题,在未来的研究当中,基于低脱靶效应和高递送效率的CRISPR/Cas9技术与干细胞技术的结合,为β-地贫的治疗带来了更多的希望.

