强脉冲光治疗上下睑对睑板腺功能障碍患者眼表及视觉质量的影响
张奥 肖风琪 顾正宇 叶敏捷 廖荣丰
睑板腺功能障碍(meibomian gland dysfunction,MGD)是一种以睑板腺终末导管阻塞和(或)睑酯分泌的质或量异常为主要特征的慢性、弥漫性睑板腺病变[1],这种改变常导致泪膜脂质含量异常,引起泪液蒸发过快以及泪膜稳定性降低,导致进入眼球的光线出现散射和像差的变化,进而影响视觉质量[2,3]。世界范围内,MGD发病率约为3.5%~70%,其中亚洲人的发病率较高[4]。目前,治疗MGD的方法包括睑缘清洁、热敷、睑板腺按摩、人工泪液、局部或口服抗生素等。2002年,Toyos偶然发现,在接受强脉冲光(intense pulsed light,IPL)治疗的面部酒渣鼻患者中,MGD和相关干眼症状得到缓解[5],随后IPL作为一种新型物理治疗方法逐渐应用于中重度MGD患者中。IPL设备内部强光源可以释放500~1200 nm高强度宽光谱,其热效应使睑酯软化易于排出,封闭睑板腺周围扩张的毛细血管从而减少了局部炎性反应因子的释放。此前,IPL的作用部位多位于下睑,但有报道称,一些患者在多次IPL治疗后,眼表症状和体征没有明显改善[6]。此外,IPL的高费用进一步限制了其在临床实践中的广泛应用。因此,优化IPL治疗的部位对于IPL的合理科学应用至关重要。此外,临床上关于中重度MGD患者治疗后的视觉质量改变的研究较少。因此本研究采用Oculus Keratograph分析仪以及双通道视觉质量分析系统Ⅱ,观察强脉冲光治疗中重度睑板腺功能障碍患者的疗效,为临床上睑板腺功能障碍的诊疗提供新的思路。
资料与方法
一、研究对象
前瞻性随机双盲自身对照研究。选取2020年12月至2021年7月就诊于安徽医科大学第一附属医院眼科中重度MGD患者33例(66只眼),13例患者门诊失访,本研究最终纳入20例(40只眼)。受试者双眼分为上下睑组和对照组(根据随机数字表区分)。纳入标准:(1)裂隙灯检查显示睑板腺开口阻塞,或睑板腺分泌物异常;(2)中重度MGD的诊断依据《我国睑板腺功能障碍诊断与治疗专家共识(2017年)》[7];(3)年龄≥18岁,性别不限;(4)均为首次诊断为MGD患者。排除标准:(1)有除MGD外的眼部疾病及外伤、手术史;(2)有糖尿病、高血压、Steve-Johnson综合征、慢性移植物抗宿主病等影响泪膜稳定性的系统性疾病;(3)2周内有角膜接触镜佩戴史者;(4)6个月内使用过影响眼表微环境的药物。参与本研究所有受试者均已签署知情同意书。本研究通过安徽医科大学第一附属医院伦理委员会批准,并在中国临床试验注册中心注册(注册编号:ChiCTR2100043840),本研究遵循《赫尔辛基宣言》。
二、检查方法
1.常规检查:所有入选者均进行病史询问,裸眼及矫正视力检查,眼表裂隙灯检查,眼底检查。评估患者是否符合入组标准。
2.眼表疾病评分指数(ocular surface disease index,OSDI)问卷调查:所有入选者均在同一医生指导下完成OSDI问卷的填写,该问卷由(international Dry Eye Workshop)制定,包括3个分量表,共12个问题,分值0~100分。其判定标准为:0~12分为无症状,13~32分为轻、中度症状,33~100分为严重症状[8]。
3.Keratograph 5M眼表综合分析仪检查:使用K5 M眼表分析仪采集入选者非侵入平均泪膜破裂时间(non-invasive mean tear film break up time,NI-BUTave)数据以及上下睑睑板腺形态,所有检查和数据采集均按照标准步骤进行两次并记录平均值,所有操作由同一位眼科医生完成。
4.视觉质量检查:使用OQASⅡ(西班牙,Visiometrics公司)检测视觉质量相关参数。所有入选者均在暗室条件下,由同一位操作者依据标准操作程序进行OQAS连续泪膜质量评价检查:受试者在最佳矫正视力的状态下进行测量,测量时嘱受试者遮盖非受检眼,平视注视目标,每项检查前嘱受试者眨眼两次,两项检查之间嘱受试者闭眼以保持泪膜完整。采集的参数有:(1)平均客观散射指数(mean object scatter index,mean OSI):指视网膜的周边光强度与中央峰值光强度的比值,是包括泪膜在内的所有屈光介质的散射指数,记录20 s。(2)调制传递函数截止频率(modulation transfer function cutoff,MTF cutoff),指在人眼MTF曲线上达到分辨率极限时的空间频率值,是目前反映视觉质量的常用指标,其值越大,视觉质量越好。
三、治疗方法
(1)结膜囊内滴入盐酸丙美卡因滴眼液1滴,共两次。(2)将涂布氧氟沙星眼膏的Jaeger盖板(苏州名仁医疗设备有限公司,中国苏州)置于结膜囊内,充分遮盖角膜及巩膜。(3)IPL治疗由同一位经验丰富的眼科医师完成,治疗过程为:①清洗患者面部并擦干;②嘱患者在整个治疗过程中处于闭眼状态;③参数设计:选择脉冲模式、脉冲时间6 ms、脉冲间隔50 ms,能量密度11~16 J/cm2,对照眼上睑治疗能量为0 J/cm2;④治疗区域涂抹耦合凝胶,将面积为35 mm×15 mm的光导晶状体贴近皮肤,先应用低于期望能量2个焦耳的参数进行1~2个点的测试,注意避开面部毛发浓密处及色素痣,测试无异常反应后开始治疗,操作医生将激光探头垂直于皮肤表面,接触目标皮肤部位,包括上睑及下睑自颞侧至鼻侧共12个治疗域,再次重复上述操作。(4)IPL治疗后,去除耦合凝胶,将丙美卡因滴眼液滴于患者结膜囊内,用睑板腺按摩器对患者上下眼睑进行睑板腺按摩。(5)受试者共接受3次上述治疗,每次治疗间隔14 d,治疗后停用其他眼部用药,改为双眼应用0.3%玻璃酸钠滴眼液,4次/d。(6)术后随访:均由同一位眼科医生于基线,每次治疗前,及最后一次治疗术后2周进行随访,共4次,随访内容按以下顺序:OSDI评分,眼表分析仪,双通道视觉质量分析系统(OQAS)。
四、统计学分析方法
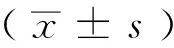
结 果
一、一般情况
共20例患者,其中男性4例,女性16例,年龄(38.20±13.52)岁(18~59岁)。随访期间未发现患者出现眼部及皮肤不良反应。
二、评价指标对比
基线时上下睑组的OSDI(34.79±16.47)与对照组(33.85±16.42)之间差异无统计学意义(P>0.05)。上下睑组与对照组的OSDI值在治疗后的2、4、6周与基线相比显著减少(均P<0.001)。在治疗后的2、4、6周,上下睑组的OSDI值与对照组之间差异无统计学意义(均P>0.05)。基线时上下睑组的NI-BUTav(9.49±4.85)与对照组(11.20±5.13)之间差异无统计学意义(P>0.05),上下睑组的NI-BUTave在治疗后2、4、6周与基线相比显著增加(P<0.017,<0.01,<0.0001),对照组在治疗后4、6周NI-BUTave显著增加(P<0.0001,<0.001)。在治疗后的2、4周,上下睑组NI-BUTave与对照组无统计学差异(P>0.05),而在6周时上下睑组显著高于对照组(P<0.05)。基线时上下睑组的mean OSI (3.01±1.46)与对照组(2.24±1.15)之间差异无统计学意义(P>0.05),上下睑组的mean OSI在治疗后的2、4、6周显著降低(P<0.001,<0.001,<0.0001),而对照组在治疗后的第6周mean OSI明显改善(P<0.01)。在治疗后的2、4、6周,上下睑组mean OSI与对照组无统计学差异(P>0.05)。见表1,图1。
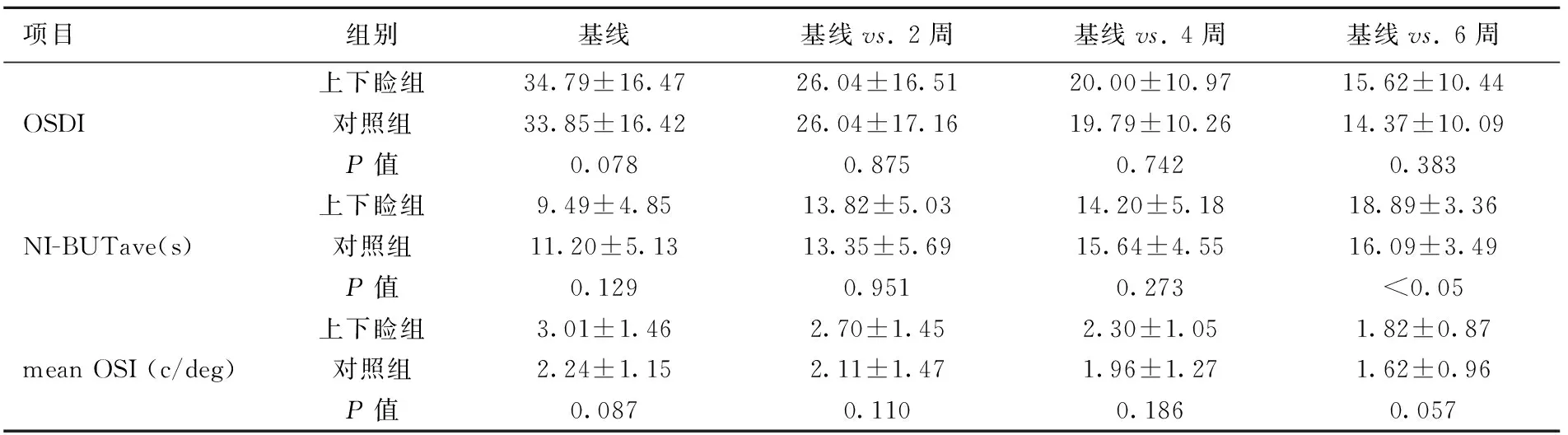
表1 治疗前后不同时间点评价指标变化
三、安全性评价
本研究中所有受试者未见不可逆眼睑皮肤损伤,最佳矫正视力未见明显变化。未见高眼压、虹膜脱色素等并发症。上下睑组有1例出现上睑少量睫毛脱落;对照组无不良事件。
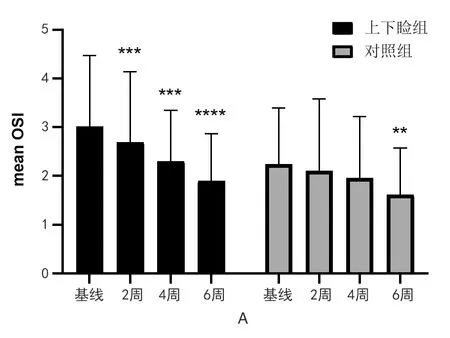
图1 上下睑组与对照组治疗前后各时间点指标的变化趋势(与基线对比,*示P< 0.017,**示P<0.01,***示P<0.001,****示P<0.0001)
讨 论
近年来MGD相关干眼患者明显增多。近期的文献强调了炎症在MGD发病机制中的作用[9],因为炎症可以自我延续和放大,所以需要抗炎治疗来停止这个过程,进而扭转对眼表造成的损害。IPL疗法广泛应用于皮肤科,目前已在眼科用于干眼症治疗20年,可抑制不同程度干眼症患者的慢性炎症损害。该疗法最主要的机制被认为是选择性光热解作用[10],MGD患者睑缘长期暴露于炎症,睑缘毛细血管扩张,因为眼周皮肤是全身最薄的皮肤之一,易于IPL穿透,通过光热解使这些异常的血管闭塞会减少炎症介质的释放,从而减轻眼表炎症反应。
从以往报道的研究来看,研究者大多使用IPL治疗下睑[11,12]。上下睑的睑板腺在数量、形态、分泌能力上都有很大不同,上睑睑板腺腺管数量为25~40(平均31),而下睑为20~30(平均26),上睑分泌睑脂的能力约为下睑的两倍[13]。所以IPL同时治疗MGD患者上下睑相较于仅治疗下睑是否可以达到更好的治疗效果?
通过分析两组治疗前后各项指标,我们发现两组患者在治疗后的OSDI评分明显下降,说明患者主观不适症状均得到了有效的改善。NI-BUTave作为反映泪膜稳定性最常用的指标[14],两组在治疗后均明显延长,说明治疗后两组患者泪膜稳定性均有效改善。目前临床上检测视觉质量较多使用的是对比敏感度测量仪、波前像差测量仪等,对比敏感度特异性较差,并且容易受亮度,屈光不正等因素的影响。波前相差忽略了眼内散射对视觉质量的影响,往往过高评价视网膜的成像质量。OQAS以其双通道技术,直接采集点光源在视网膜的成像可以得到包括泪膜在内的所有屈光介质光学成像质量的信息,并进行综合分析处理,得到mean OSI、MTF等数据,从而更加准确客观地反映患者的视觉质量[15,16]。上下睑组的mean OSI在治疗后的不同时间点均显著降低,而对照组在治疗后6周时出现明显改善,说明治疗后两组视觉质量得到不同程度地提高;另外,我们发现相较于对照组,上下睑组的mean OSI更早的出现明显改善,这说明IPL同时照射上下睑治疗中重度MGD疗效更加显著且相比仅照射下睑起效更快。
有趣的是,我们发现在治疗后6周,两组的OSDI评分均得到有效改善,但上下睑组与对照组在不同时间点的OSDI评分并无区别。我们分析这可能有两个原因:(1)OSDI问卷为主观调查,并且本研究为双盲研究。除此之外我们发现,Craig等[17]报道的IPL治疗MGD与安慰剂对照研究结果相似,所以MGD的症状与相关干眼之间可能存在着复杂的联系,心理因素可能也有影响。(2)IPL仅治疗下睑本身就可以有效缓解MGD患者的眼表不适症状。但目前,这一发现还很难解释,需要进一步大样本的研究。
安全性方面,本研究中所有受试者未见不可逆眼睑皮肤损伤,最佳矫正视力未见明显变化。未见高眼压、虹膜脱色素等并发症。上下睑组有1例患者在第二次治疗后出现上睑少量睫毛脱落,考虑系取出结膜囊金属垫板时牵拉掉落。
综上所述,MGD的治疗方法众多,但仍存在效率低、依从性差等问题。IPL治疗应用于上下睑治疗MGD是安全的,有效的,通过改善睑板腺分泌功能,增加泪膜破裂时间,改善眼表症状及视觉质量。因此,IPL同时照射上下睑为MGD的治疗提供了一种相对快速,有效的新选择。

