肝细胞癌半肝切除术后门静脉压力变化及其临床意义
龚文锋 陆战 张杰 齐鲁楠 陈祖舜 钟鉴宏 李川 马良 向邦德
作者单位:530021 南宁 广西医科大学附属肿瘤医院肝胆胰脾外科;广西肝癌诊疗工程技术研究中心
肝部分切除术是肝细胞癌(hepatocellular carcinoma,HCC)重要的治疗方法,但因手术直接结扎离断肿瘤附近的血管及肝脏组织,因此减少了肝脏流入道及流出道的血流,从而增加门静脉压力(portal vein pressure,PVP)。PVP增高及门静脉血流的再分配使残余肝营养物质充足,这是术后肝再生的主要因素[1]。同时,肝脏血流灌注以及门静脉血流的动力学改变也会导致PVP增高,并在术后腹水的产生、肝再生及术后肝功能衰竭(posthepatectomy liver failure,PHLF)的发生发展过程中起着关键性作用[1]。既往研究[2-3]显示,术后门静脉高压与术后肝再生、肝功能不全以及预后密切相关。还有研究报道,肝切除术后可导致PVP增高,而增高的PVP可促进术后肝再生,但是由于术后残余肝体积的减少以及残余肝脏突然遭受过度灌注的门静脉血流引起的PVP增高会导致严重的血管内皮损伤,最终导致PHLF的发生[4-5]。肝静脉压力梯度(hepatic venous pressure gradient,HVPG)是指经颈静脉插管测定肝静脉锲入压与游离压,两者之差即为HVPG,可反映PVP大小。多项研究已报道PVP及HVPG增加是肝切除术后肝再生及PHLF的主要影响因素[6-7]。但是目前的研究主要集中于观察术后1周PVP的变化情况,然而随着时间的延长以及术后肝体积再生及门静脉侧支循环的建立,术后PVP会持续改变,但后续变化的相关研究鲜见报道。本研究拟通过分析HCC患者肝切除术后不同时间段的HVPG变化情况以及术后HVPG增高的影响因素,并进一步探讨HVPG与术后肝再生及PHLF的相关性,为制定HCC患者围手术期管理策略提供依据。
1 资料与方法
1.1 临床资料
收集2016—2020年于广西医科大学附属肿瘤医院行半肝切除术的125例HCC患者的临床资料。纳入标准:⑴术前乙型肝炎表面抗原(HBsAg)阳性;⑵术后经病理证实为HCC。排除标准:⑴曾接受经肝动脉化疗栓塞、门静脉栓塞术或其他抗HCC治疗;⑵术后随访期间肿瘤复发或进展;⑶临床资料不完整。本研究经本院伦理委员会批准(伦理号:LW2022096),所有患者均签署知情同意书。
1.2 观察指标及评估标准
收集患者的一般人口学资料及临床资料,包括患者年龄、性别、体质指数(BMI)、肝硬化情况(参照《病毒性肝炎防治方案》中慢性的病毒性肝炎组织学分级和分期标准[8]诊断)、巴塞罗那(BCLC)分期、肿瘤直径、手术方式、HBV-DNA情况、抗病毒治疗情况、PLT计数、手术时间、术后并发症如PHLF(参照“50-50标准”[9]诊断)等。其中术前及术后1周、5周、9周、13周分别行CT扫描并测算肝脏总体积(total liver volume,TLV)、功能性肝体积(functional liver volume,FLV)、残余肝体积(remnant liver volume,RLV)、切除的肝脏体积(resected liver volume,rLV)、肿瘤体积(tumor volume,TV)、脾脏体积(spleen volume,SV)以及术后1周、5周、9周、13周增生后的残余肝体积(future liver remnant volume,FLRV),主要观察指标为以上指标的术后变化情况。同时计算术后1周肝再生率(liver regeneration rate,LRR),公式为LRR=[(FLRV-RLV)/RLV]×100%;术后1周HVPG,公式为HVPG=17.37-4.91×ln(RLV/SV)+3.8[如果存在肝周腹水];肝切除术后第1周HVPG的增高值(ΔHVPGpow1),公式为Δ HVPGpow1=HVPGpow1-HVPGpre。
1.5 统计学方法
采用SPSS 19.0软件进行统计分析。连续性变量的计量资料采用中位数(最小值,最大值)或者均数±标准差表示,数据符合正态分布,组间差异的比较采用t检验;数据不符合正态分布,则采用Mann-Whitney U检验进行组间差异的比较,前后比较采用配对t检验,多重比较采用Bonferroni检验。计数资料用百分数表示,组间差异比较采用χ2检验。采用多因素logistics回归分析影响术后HVPG增高的因素。肝再生率与ΔHVPG的相关性采用Pearson相关性分析。绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)及其敏感度和特异度,评估ΔHVPG预测术后PHLF的效能。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 纳入患者的基本特征
共纳入125例HCC患者,中位年龄47岁;实施右半肝切除术72例;经术后组织病理学诊断为肝硬化43例;术后发生PHLF 13例,其中1例术后第90天死亡。125例患者的其余临床病理特征见表1。

表1 HCC患者的临床病理特征Tab.1 Clinical characteristics of HCC patients
2.2 术后HVPG的变化情况
术前及术后1周、5周、9周、13周,HVPG中位数分别为 8.41 mmHg(范围:2.85~13.65 mmHg)、13.04 mmHg(范围:4.91~19.83 mmHg)、10.99 mmHg(范围:5.03~17.39 mmHg)、11.09 mmHg(范围:5.36~18.76 mmHg)、10.93 mmHg(范围:5.37~18.39 mmHg),其中术后1周与术前及术后5周比较,差异均有统计学意义(均P<0.001),而术后9周分别与术后5周和术后13周比较,差异均无统计学意义(P=0.323,0.172),见图1A。术后1周、5周、9周、13周,ΔHVPG分别为4.86 mmHg(范围:-0.18~10.08 mmHg)、2.30 mmHg(范围:-0.77~7.28 mmHg)、2.37 mmHg(范围:-0.78~6.19 mmHg)、2.35 mmHg(范围:-1.21~6.80 mmHg),其中术后1周与术后5周比较差异有统计学意义(P<0.001),术后9周分别与术后5周和术后13周比较差异均无统计学意义(P=0.182,0.241),见图1B。
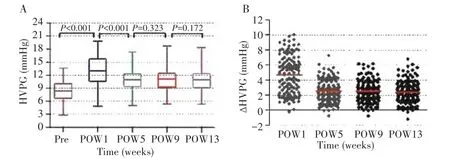
图1 半肝切除术后HVPG的变化趋势图Fig.1 Variation tendency of HVPG after hemihepatectomy
2.3 术后1周HVPG增高的单因素和多因素分析
单因素分析显示,性别、MELD评分、肝硬化、BMI、rLV与术后1周HVPG增高有关(P<0.05),见表2。多因 素 分 析 显示,rLV>820 cm3(OR=4.424,95%CI:1.106~17.692,P=0.035),RLV<601 cm3(OR=3.415,95%CI:1.183~14.271,P=0.029)、肝硬化(OR=84.843,95%CI:20.175~356.788,P<0.001)是HCC患者行半肝切除术后HVPG增高的危险因素,见表2。

表2 半肝切除术后HCC患者HVPG增高的单因素和多因素分析Tab.2 Univariable and multivariable analysis of increased HVPG in HCC patients after hemihepatectomy
2.4 术后1周ΔHVPG与肝再生及PHLF的相关性
以术后1周ΔHVPG中位数4.86 mmHg为截断值,分为ΔHVPG>4.86 mmHg组和ΔHVPG≤4.86 mmHg组。术后1周,ΔHVPG>4.86 mmHg组的肝再生率高于ΔHVPG≤4.86 mmHg组[(31.48±22.09)%vs(21.25±19.51)%,P=0.007],相关性分析显示肝再生率与ΔHVPG呈正相关(r=0.283,P=0.002),见图2A~B。术后1周,PHLF组的肝再生率高于无PHLF组[(42.6±21.1)%vs(22.3±18.5)%,P<0.001],ΔHVPG也高于无PHLF组[(7.02±1.44)mmHgvs(4.44±2.43)mmHg,P=0.001],见图2C。ROC曲线分析显示,当术后Δ HVPG截断值为5.83 mmHg时,其诊断PHLF的AUC为 0.813(95%CI:0.729~0.892),敏感度为0.923,特异度为0.723,见图2D。

图2 术后1周ΔHVPG与肝再生及PHLF的关联性分析Fig.2 Correlation analysis of ΔHVPG with liver regeneration and PHLF at 1 week post-hemihepatectomy
3 讨论
肝部分切除术在HCC治疗中占据着重要地位,即使肝硬化合并门静脉高压也不是手术的绝对禁忌征,但需严格筛选病例[10-11]。HVPG是测定PVP的“金标准”,但HVPG测定属于高难度、高风险的有创性操作,术前及术后使用HVPG反复测定PVP难以在临床上实现。因此,本研究纳入125例行半肝切除术的HCC患者,根据术前及术后不同时期患者的肝脏体积及SV大小,计算术前以及术后1周、5周、9周和13周的HVPG,旨在间接评估术前及术后不同时间的PVP。本研究发现,HCC患者实施半肝切除术后1周、5周、9周及13周HVPG均较术前增加,且术后1周HVPG增加最显著,但术后5周、9周、13周HVPG逐渐下降且保持相对稳定,说明半肝切除术可引起HVPG增高。本研究结果与国内外研究结果相似,如王在国等[12]纳入63例HCC患者并测定其术中、术后门静脉自由压,也发现肝部分切除术可引起门静脉自由压增高,其中以术后3~7 d最显著,术后7 d门静脉自由压增高了5.3 cm H2O(约4.08 mmHg),而术后7 d至1个月门静脉自由压逐渐下降。CARRAPITA等[7]纳入30例HCC手术患者也发现肝切除术可导致PVP增高。可能原因是肝部分切除术后由于结扎和切断了肿瘤及其区域的血管分支,容易导致肝内血流流出通道减少、大量肝窦塌陷致肝窦出口括约肌小叶静脉收缩引起流出道阻力增加、肾素-血管紧张素系统活化引起内脏血管扩张使入肝血流显著增加、动静脉短路开放等,同时由于术后1周内侧支循环尚未建立,因此PVP显著性增加;而1周后随着侧支循环的逐渐形成及开放,PVP有下降趋势。此外,尽管手术导致的门静脉-肝静脉短路开放间接减少了流出道的阻力,但是由于术后流出道的损失永久存在,因此术后1周PVP显著增高后即使会逐渐下降并保持稳定,但无法恢复到原先水平。
本研究还发现切除的肝脏体积>820 cm3、RLV<601 cm3以及合并肝硬化是HCC患者半肝切除术后1周HVPG增高的危险因素,且术后1周ΔHVPG>4.86 mmHg的患者肝再生率明显升高,说明肝切除术后HVPG增高到一定程度可能有助于促进肝再生发生。肝部分切除术后的肝再生与门静脉栓塞术促进肝再生相似,肝血流动力学在其中起关键作用。肝部分切除术后门静脉血流被重新分布至残肝较小的血管床,使残余肝的血流灌注较术前显著增加,由此产生剪切应力,加上激素、生长因子和细胞因子的应用,共同触发并维持了残肝内部的再生反应。
PHLF是肝切除术围手术期死亡的最主要原因,目前多项临床研究[5,7,13]表明肝部分切除术后PVP增高会增加PHLF的发生风险。BOGNER等[5]报道肝大部分切除术后PVP增加,肝动脉血流量显著减少,而门静脉血流量轻微减少,多因素分析也显示PVP增高是PHLF发生的独立危险因素。CUCCHETTI等[13]也报道,HVPG不仅是肝切除术后PHLF发生的危险因素,还可用于术前预测PHLF。本研究也发现,发生PHLF的患者术后1周的ΔHVPG较未发生PHLF的患者明显升高,当ΔHVPG截断值为5.83 mmHg时,其预测PHLF表现出良好的效能,AUC达0.813,敏感度为0.923,特异度为0.723,与上述研究结果相似。
本研究尚存在以下不足:⑴HVPG的测定的结果是参照公式间接获得,并非通过标准的有创检查方法获得,因此与实际数据可能存在一定偏差;⑵本研究主要集中于切除肝体积方面的研究,缺乏对再生的肝脏功能及储备功能相关研究;⑶本研究为回顾性、单中心的临床研究,缺乏基础性的交叉研究,因此有关结论仍需进一步验证。
综上所述,HCC患者接受半肝切除术后1周HVPG增高明显,之后逐渐下降,且切除的肝脏体积>820 cm3、RLV<601 cm3及肝硬化是 HVPG 增高的危险因素。在临床意义方面,本研究发现,术后1周HVPG增高与肝再生率和PHLF发生相关,其中ΔHVPG>4.86 mmHg可促进肝再生发生,而以5.83 mmHg为截断值时ΔHVPG在预测PHLF中表现出良好的效能。

