lncRNA BCYRN1在结外NK/T细胞淋巴瘤糖酵解激活中的作用及其机制研究
傅芮莹 刘辛迪 梁远征 刘雪琳 王亮
作者单位:100730 北京 首都医科大学附属北京同仁医院血液内科
结外NK/T细胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTCL)是一种与EB病毒(epstein-barr virus,EBV)密切相关的恶性淋巴瘤,在我国占所有类型淋巴瘤的5%~10%[1]。早期ENKTCL的5年生存率达80%以上,但初治晚期及复发难治患者预后仍较差,有待探索新的治疗靶点[2-3]。糖酵解代谢活跃是恶性肿瘤显著的特征之一,既往研究表明,在ENKTCL患者中,治疗前空腹血糖(fasting blood glucose,FBG)水平较高的患者治疗缓解率较低,生存状况更差[4],而这可能与淋巴瘤细胞内的Warburg效应密切相关[5]。长链非编码RNA(long non-coding RNA,lncRNA)是重要的基因表达调控因子,近年来研究证实lncRNA与肿瘤发生发展密切相关,其中多种lncRNA介导肿瘤糖酵解通路的激活[6-7]。本团队前期研究发现,lncRNA BCYRN1过表达与ENKTCL患者预后不良密切相关,且干扰BCYRN1可显著抑制淋巴瘤细胞增殖和诱导细胞凋亡[8]。但BCYRN1是否通过激活ENKTCL糖酵解而促进肿瘤增殖目前尚未明确。基于此,本研究通过构建过表达及干扰BCYRN1的ENKTCL细胞株,并检测其葡萄糖的摄取水平、乳酸生成水平以及与糖酵解通路相关分子的表达水平,同时初步探索BCYRN1促进糖酵解激活的可能机制,以期为靶向代谢重编程治疗ENKTCL提供理论基础。
1 材料与方法
1.1 主要材料与试剂
1.1.1 细胞及试剂耗材 人ENKTCL细胞株SNK-6由中山大学肿瘤防治中心贝锦新教授馈赠。RPMI-1640培养基、胎牛血清购自北京细工生物科技有限公司,IL-2购自Sigma-Aldrich公司,谷氨酰胺、100 U/mL青霉素、100 U/mL链霉素购自美国Gibco公司;蛋白合成抑制剂放线菌酮(Cycloheximide,CHX)购自阿拉丁试剂(上海)有限公司,溶酶体抑制剂Leupeptin和溶酶体激活剂6-Aminonicotinamide(6-AN)购自MedChem-Express公司;Screen QuestTM比色法葡萄糖摄取检测试剂盒、乳酸检测试剂盒购自南京建成生物工程研究所;反转录及qRT-PCR试剂盒购自天根生化科技(北京)有限公司,SYBR Green qPCR SuperMix购自南京诺唯赞生物科技股份有限公司,定量PCR仪(ABI PRISM®7500 Sequence Detection System)、转录试剂盒(MEGAshortscriptTMT7)购自Invitrogen公司,PierceTMRNA 3′端生物素化试剂盒、M-PERTM哺乳动物蛋白抽提试剂购自Thermo Scientific公司;RNA结合蛋白免疫沉淀(RIP)试剂盒购自广州吉赛生物科技股份有限公司;抗PKM(1∶1 000)、HIF1A(1∶800)、SLC2A1(1∶1 000)、LDHA(1∶1 200)、PDK1(1∶1 000)、pAKT1(1∶800)、山羊抗兔IgG抗体等均购自武汉博士德生物技术公司,GAPDH抗体(1:10 000)购自Abcam公司。
1.1.2 临床资料 收集2010—2021年于首都医科大学附属北京同仁医院住院的236例初治ENKTCL患者信息。所有患者均根据造血与淋巴组织肿瘤WHO分类(2016年版)[9]确诊为ENKTCL,临床资料完整,并接受以门冬酰胺酶为基础的化疗方案治疗。其中,男性166例,女性70例;中位年龄46(12~86)岁;Ann-Arbor分期Ⅰ~Ⅱ期156例,Ⅲ~Ⅳ期80例;按照列线图修正版风险指数(nomogram-revised risk index,NRI):低危42例,低中危28例,中高危70例,高危62例,极高危34例。所有患者均有FBG数值。选取32例早期初诊患者的石蜡包埋组织(FFPE)用于后续实验。本研究获首都医科大学附属北京同仁医院伦理委员会批准(文件编号为TRECKY2020-022),因本研究全部采用匿名处理,不暴露患者隐私信息,故免除患者的知情同意。
1.2 方法
1.2.1 SNK-6细胞培养 SNK-6细胞用含10%胎牛血清、80 ng/mL IL-2、2 mmoL/L谷氨酰胺及1%双抗(100 U/mL青霉素、100 U/mL链霉素)的RPMI-1640培养基,置于37℃,5%CO2细胞培养箱培养,隔日更换新鲜培养液,待细胞融合率达到80%~90%时传代。收集对数生长期细胞进行后续实验。
1.2.2 质粒构建及细胞转染BCYRN1基因(NR_001568.1)序列由苏州泓迅生物科技股份有限公司合成,5′端添加 HindIII酶切位点,3′端添加 XhoI酶切位点,并将合成序列链接到pcDNA3.0载体,命名为OE-BCYRN1;以pcDNA3.0空载作为对照质粒,命名为OE-CTRL。设计合成BCYRN1干扰序列5′-TAAGCGTAACTTCCCTCAAAG-3′,通过发夹结构,在 5′端添加AgeI酶切位点,3′端添加EcoRI酶切位点,并将合成序列链接到pLKO.1-puro载体,命名为shBCYRN1;以pLKO.1-puro空载作为对照质粒,命名为shCTRL。SNK-6细胞分别转染BCYRN1过表达质粒(OE-BCYRN1组)、BCYRN1干扰质粒(shBCYRN1组)以及相应空白质粒(OE-CTRL组和shCTRL组),以不做任何处理的细胞作为空白对照组(Control组)。转染步骤依据LipofectamineTM2000试剂盒说明书进行。
1.2.3 葡萄糖摄取检测及乳酸生成量检测 采用Screen QuestTM比色法葡萄糖摄取检测试剂盒进行葡萄糖摄取检测。转染72 h后,调整各组细胞密度为5×104/孔,接种于96孔培养板6 h后,每孔加入葡萄糖摄取缓冲液90 μL,孵育1 h;每孔加入10 μL的2-脱氧葡萄糖(2-DG)溶液,孵育40 min后去培养上清,加入25 μL的酸性裂解液,孵育20 min后加入50 μL的2-DG摄取工作液,室温下避光孵育1 h,然后采用荧光酶标仪在570 nm/610 nm处测定吸光比值。
采用乳酸检测试剂盒进行乳酸生成量检测。不同处理组细胞培养48 h后收集上清。在空白管加入0.02 mL双蒸水、1 mL酶工作液和0.2 mL显色剂;在标准管加入3 mmol/L标准品、1 mL酶工作液和0.2 mL显色剂;在测定管加入待测样品、1 mL酶工作液和0.2 mL显色剂。混匀后于37℃水浴锅中反应10 min,然后加入2 mL终止液,在波长530 nm处测定光密度(OD)值,计算绝对OD值=样品测定OD值-空白OD值,然后代入由6 mmol/L的乳酸标准品绘制的标准曲线,计算样品的乳酸量。
1.2.4 qRT-PCR检测基因表达水平 采用TRIzol试剂盒提取ENKTCL组织及SNK-6细胞中的总RNA。根据逆转录试剂盒说明书合成cDNA,按照qRT-PCR试剂盒说明书进行反应。PCR反应条件如下:95℃5 min,95 ℃ 15 s,60 ℃ 32 s,40 个循环;融解曲线分析:60~95℃。每个样本重复3次。引物序列如表1所示。以GAPDH作为BCYRN1基因的内参,β-actin作为PKM2、HIF-1α、SLC2A1、LDHA、PDK1基因的内参。采用2-△△Ct法计算目的基因的相对表达量。

表1 检测基因的引物信息以及片段大小Tab.1 The primer information and fragment size for genes detected
1.2.5 Western blot检测蛋白表达水平 收集各组SNK-6细胞,提取总蛋白,BCA试剂盒测定蛋白浓度。每个样品上样20 μg蛋白进行SDS-PAGE凝胶电泳、转PVDF膜,5%脱脂奶粉-TBS封闭,分别加入相关一抗,4℃孵育过夜;次日25 mL TBST洗涤PVDF膜3次,每次5 min,加入二抗山羊抗兔IgG抗体(1∶20 000),室温孵育40 min,25 mL TBST洗涤PVDF膜3次,每次7 min,然后显影、拍照。以GAPDH作为内参,用Image-Pro Plus 6.0软件测定蛋白灰度值。
1.2.6 RNA pull-down实验 BCYRN1正义链和反向互补序列逆转录后,纯化RNA并进行生物素标记。采用蛋白抽提试剂提取蛋白。将上述生物素标记的RNA(50 pmoL)、无生物素标记的RNA(50 pmoL)与链霉亲和素磁珠(50 μL)在室温下搅拌孵育15~30 min后,置于磁力架,收集磁珠。在磁珠中添加10 μL的10×蛋白-RNA结合缓冲液,30 μL的50%丙三醇,15 μL的活性蛋白(2 mg/mL)以及45 μL的无核酸酶纯水,于4℃、10 r/min旋转反应过夜。收集磁珠,弃上清液。采用100 μL漂洗液清洗磁珠2~3次,加入50 μL洗脱液,涡旋混匀,37℃孵育30 min。反应结束后,置于磁力架,收集上清,进行Western blot检测。
1.2.7 RIP实验 实验分为shCTRL组和shBCYRN1组。转染48 h后,每组收集1×107个细胞加入1 mL裂解液冰上裂解10 min,离心取上清。取100 μL上清作为阳性对照。剩余900 μL上清加入100 μL蛋白A/G磁珠,反应10 min后置于磁力架并取上清。取200 μL蛋白A/G磁珠,洗涤后加入1 mL裂解液,充分混匀,然后分为2份,每份500 μL,分别标记为RIP管和IgG管。向RIP管中加入5 μg PKM2抗体,IgG管中加入5 μg IgG抗体,反应后收集磁珠。分别往RIP管和IgG管中加入350 μL裂解液和450 μL细胞裂解液,反应结束后收集磁珠并将上述处理好的样品,包括阳性对照、RIP管以及IgG管样本,采用离心柱法提取总RNA。洗脱纯化的RNA采用qRT-PCR进行检测。
1.3 统计学方法
计量数据均以平均值±标准误表示,平均值来自至少3个独立的实验结果。呈正态分布的两组计量资料比较采用独立样本t检验。多组比较采用单因素方差分析,若差异有统计学意义,则采用tukey检验进行多重比较。检验水准为α=0.05。生存数据采用SPSS 20软件进行分析,采用log-rank检验其统计学差异。图像处理采用GraphPad Prism 5。对于ENKTCL患者,无进展生存(progression-free survival,PFS)时间从诊断之日开始计算,直至疾病进展、死亡或末次随访日期。
2 结果
2.1 FBG及BCYRN1表达水平与ENKTCL患者预后密切相关
根据文献[4],将FBG>5.6 mmol/L定义为高血糖组,FBG≤5.6 mmol/L定义为正常血糖组。入组的236例初诊ENKTCL中,根据基线FBG水平,高血糖组49例,正常血糖组187例,两组患者的基线资料具有可比性(P>0.05)。Kaplan-Meier生存曲线显示,正常血糖组5年PFS率高于高血糖组(63.7%vs32.1%,log-rankP<0.001),见图1A。根据32例早期ENKTCL患者病理组织中BCYRN1的表达水平进行排序,选择中位值1.72作为截断值,并分为BCYRN1高表达组(>1.72)及BCYRN1低表达组(≤1.72),每组16例。两组患者的性别、年龄等基线资料具有可比性(P>0.05)。Kaplan-Meier生存曲线显示,BCYRN1高表达组3年PFS率低于低表达组(26.1%vs82.5%,log-rankP=0.014),见图1B。上述结果提示FBG水平与ENKTCL患者预后相关,BCYRN1高表达与患者预后较差相关。
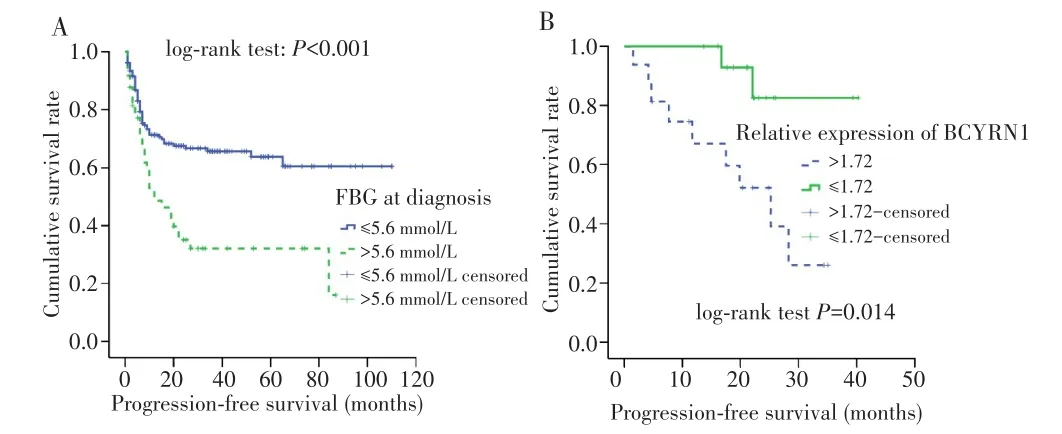
图1 ENKTCL患者的生存曲线Fig.1 Survival curves of ENKTCL patients
2.2 BCYRN1表达影响SNK-6细胞对葡萄糖的摄取和乳酸生成的水平
与Control组和shCTRL组比较,shBCYRN1组SNK-6细胞对葡萄糖的摄取量显著降低(均P<0.05),见图2A;乳酸生成水平也显著降低(均P<0.05),见图2B。提示BCYRN1参与了ENKTCL对葡萄糖代谢的途径,尤其是糖酵解途径。

图2 干扰BCYRN1表达对SNK-6细胞葡萄糖摄取和乳酸生成能力的影响Fig.2 Effects of interference with BCYRN1 expression on glucose uptake and lactate production of SNK-6 cells
2.3 BCYRN1表达影响ENKTCL糖酵解通路关键分子的表达水平
采用qRT-PCR检测糖酵解通路常见关键分子的表达情况,结果显示,OE-BCYRN1组SNK-6细胞中BCYRN1表达量较Control组和OE-CTRL组显著增高(均P<0.001),而shBCYRN1组表达量较Control组和shCTRL组显著降低(均P<0.001),见图3A,提示细胞转染成功。如图3B-F所示,与Control组及OE-CTRL组或shCTRL组比较,糖酵解关键分子PKM2、HIF-1α、SLC2A1、LDHA和PDK1的基因表达量在OE-BCYRN1组中显著升高(均P<0.05),而在shBCYRN1组中显著降低(均P<0.01),提示过表达BCYRN1可显著上调糖酵解通路相关分子的基因表达水平。

图3 qRT-PCR检测SNK-6细胞中BCYRN1及糖酵解关键分子的基因表达水平Fig.3 Gene expression levels of BCYRN1 and key glycolysis molecules in SNK-6 cells detected by qRT-PCR
在蛋白表达层面,Western blot检测结果如图4所示,OE-BCYRN1组中PKM2、HIF-1α、SLC2A1、LDHA、PDK1、p-AKT蛋白表达水平均显著高于Control组和OE-CTRL组(均P<0.01),而shBCYRN1组各分子的蛋白表达水平则显著低于Control组和shCTRL组(均P<0.05),提示过表达BCYRN1可显著上调糖酵解通路相关分子的蛋白表达水平。
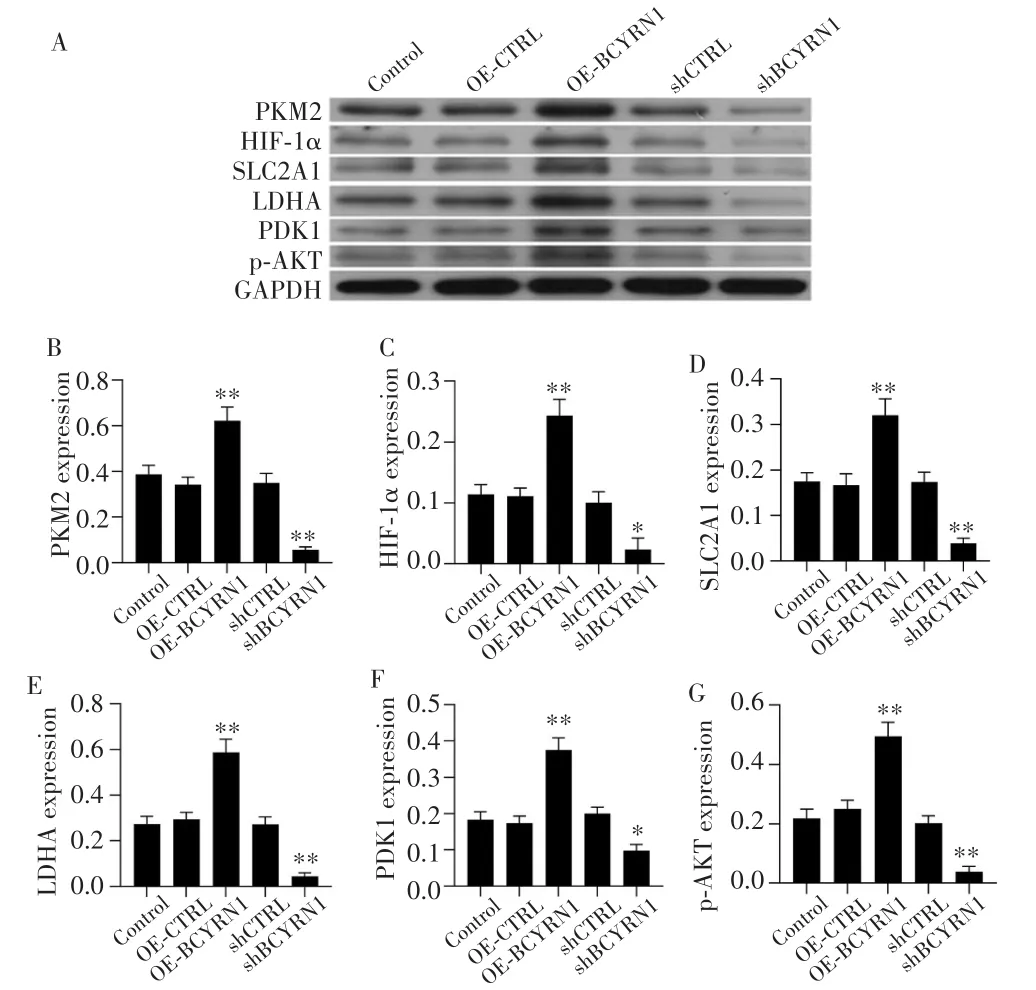
图4 Western blot检测SNK-6细胞中糖酵解关键分子的蛋白表达水平Fig.4 Protein expression levels of key glycolysis molecules in SNK-6 cells detected by Western blot
2.4 BCYRN1可减少溶酶体对PKM2的降解而增强PKM2蛋白的稳定性
应用蛋白合成抑制剂(CHX)分别处理不同组别 SNK-6细胞0 h、3 h、6 h,然后采用Western blot检测PKM2的蛋白表达水平。如图5A,C所示,在0 h时,PKM2在OE-BCYRN1组中的蛋白表达量高于OE-CTRL组,而在shBCYRN1组中的表达量低于shCTRL组;经CHX处理3 h或6 h后,所有组别PKM2的蛋白表达量均较0 h明显降低,提示在抑制蛋白合成后,现存PKM2蛋白会通过某种途径发生降解。如图5B,D所示,与各自对照组相比,OE-BCYRN1组中PKM2的降解比例显著降低(均P<0.05),而shBCYRN1组中PKM2的降解比例显著升高(均P<0.05),提示BCYRN1可减少PKM2的降解,从而起到稳定PKM2蛋白的作用。
在shBCYRN1组中添加溶酶体抑制剂(Leupeptin)、OE-BCYRN1组添加溶酶体激活剂(6-AN)分别处理0 h、4 h、8 h。结果显示,处理4 h和8 h后,shBCYRN1+Leupeptin组PKM2蛋白的降解比例均较shBCYRN1组明显下降(均P<0.01),见图5E~F;OE-BCYRN1+6-AN组PKM2蛋白的降解比例均较OE-BCYRN1组显著增加(均P<0.001),见图5G~H,提示PKM2蛋白通过溶酶体途径进行降解。
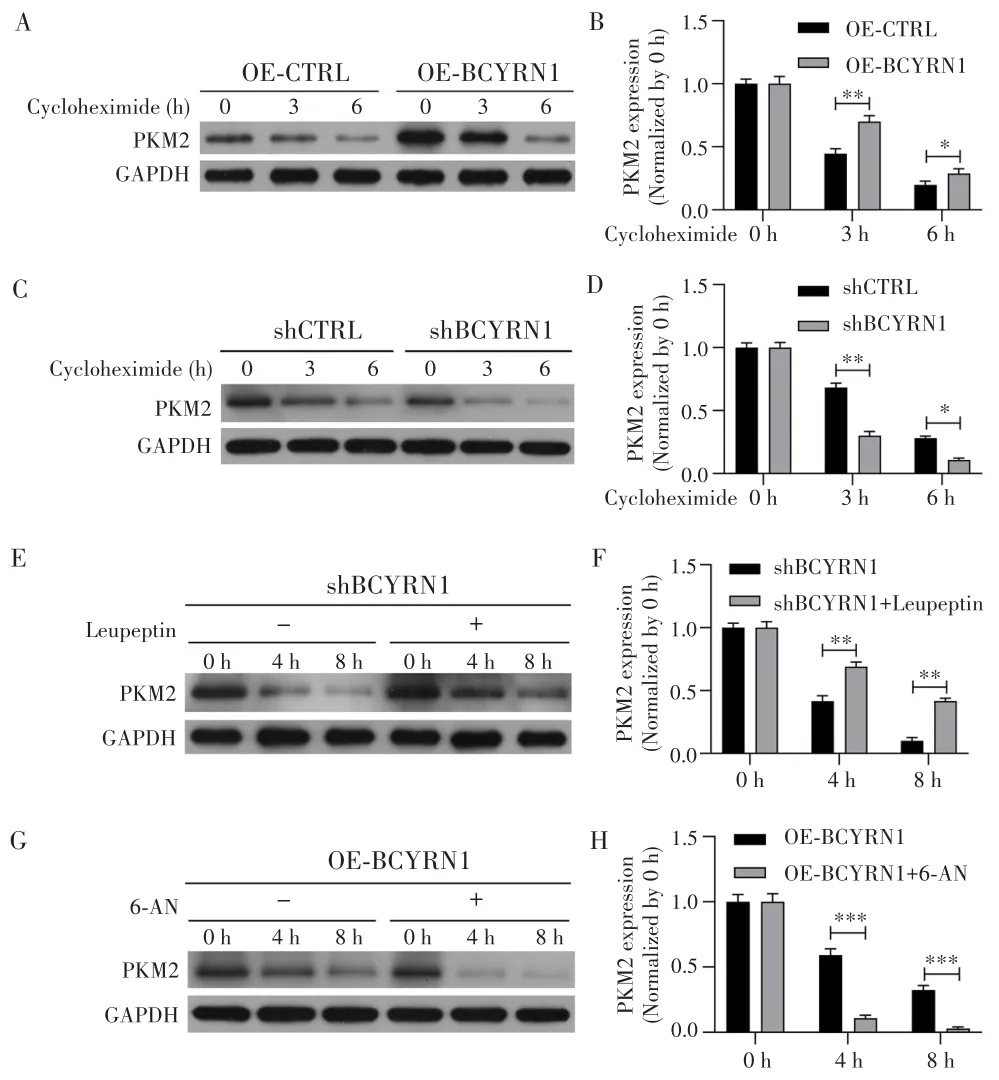
图5 BCYRN1通过减少溶酶体对PKM2的降解而增强PKM2蛋白稳定性Fig.5 BCYRN1 enhanced PKM2 protein stability by reducing lysosomal degradation of PKM2
2.5 BCYRN1通过与PKM2蛋白直接相互作用调控其蛋白稳定性
采用RNA pull-down实验验证PKM2蛋白是否与正义或反义BCYRN1基因相结合。Western blot检测结果显示,PKM2蛋白与正义BCYRN1基因相结合,与反义BCYRN1基因不结合;干扰BCYRN1表达后,相结合的PKM2蛋白相应减少(P=0.006),见图6A~B。进一步采用RIP实验验证BCYRN1基因与PKM2蛋白的直接相互作用。qRT-PCR检测结果显示,经PKM2抗体沉淀下来的基因可检测到BCYRN1的存在,在干扰BCYRN1表达的SNK-6细胞中,RIP实验检测到的PKM2水平也显著降低(P=0.007),见图6C。上述结果提示,BCYRN1基因可与PKM2蛋白发生直接相互作用。
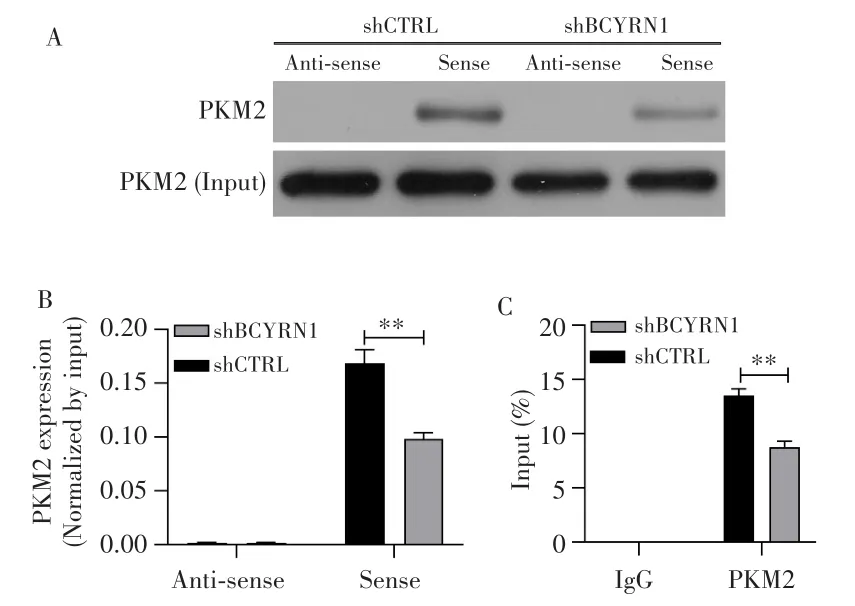
图6 RNA pull-down和RIP实验证实BCYRN1与PKM2蛋白直接相互作用Fig.6 RNA pull-down and RIP experiments confirmed direct interaction between BCYRN1 and PKM2 protein
3 讨论
恶性肿瘤无论氧气充足与否均选择糖酵解途径,消耗大量葡萄糖并生成乳酸,这一现象被称为Warburg效应或有氧糖酵解[10]。研究表明,干扰肿瘤细胞的Warburg效应能显著抑制细胞增殖和侵袭转移效应[5]。与既往研究[4]结果相似,本研究亦在236例ENKTCL患者中证实了高水平FBG与不良预后的相关性,且其机制可能与淋巴瘤细胞内的Warburg效应密切相关。因此,揭示ENKTCL发生发展过程中调控Warburg效应的关键分子,不仅有利于寻找ENKTCL演变过程中关键的分子标志,为早期诊断提供帮助,也可为ENKTCL的预防和治疗开辟新的途径。
大量研究已证实lncRNA与肿瘤发生发展密切相关[11-12]。本团队前期研究发现lncRNA BCYRN1在耐药ENKTCL组织中高表达且与不良预后显著相关,且可通过促进自噬进而介导ENKTCL对门冬酰胺酶化疗耐药[8]。本研究在32例早期初诊ENKTCL组织中同样证实了BCYRN1高表达水平与较差的PFS密切相关,说明BCYRN1可能是ENKTCL潜在的预后生物标志物和治疗靶点。然而,BCYRN1促进ENKTCL增殖及介导耐药的机制较复杂,既往有研究显示lncRNA可介导肿瘤细胞糖酵解激活[6-7]。为了进一步探索BCYRN1是否影响ENKTCL的糖代谢,本研究首先将SNK-6细胞分别转染空白质粒和shBCYRN1质粒,然后检测不同组别SNK-6细胞的葡萄糖摄取能力及乳酸生成能力,结果发现在干扰BCYRN1的SNK-6细胞中葡萄糖的摄取能力降低,乳酸生成能力也显著受影响,提示BCYRN1可能参与了ENKTCL的糖酵解激活作用。
在上述实验中观察到BCYRN1影响ENKTCL糖代谢后,本研究进一步探索BCYRN1是否影响糖酵解通路常见关键分子PKM2、HIF-1α、SLC2A1、LDHA和PDK1的表达。丙酮酸激酶(pyruvate kinase,PK)是糖酵解过程中的关键酶,作为PK最常见的两个亚型之一,PKM2在肿瘤细胞中高表达[13]。PKM2是肿瘤代谢的关键酶,特异性地表达于多种肿瘤细胞系,抑制PKM2表达可降低肿瘤细胞摄取葡萄糖的能力,同时增加氧气的消耗,以及降低乳酸的生成水平[14]。PKM2还可与HIF-1α结合并在转录水平活化SLC2A1、LDHA、PDK1等糖酵解相关基因的表达[15]。本研究在探讨BCYRN1与PKM2等糖酵解关键酶的相关性中发现,SNK-6细胞过表达BCYRN1后,无论是基因层面还是蛋白表达层面,与糖酵解相关的关键酶PKM2、HIF-1α、SLC2A1、LDHA及PDK1等表达均上调;相应地,在干扰BCYRN1后,这些关键酶表达下调,这一结果提示BCYRN1可能介导了ENKTCL的糖酵解激活。翻译后修饰对肿瘤细胞内PKM2的表达水平和活性亦具有调节作用。既往研究显示,乙酰化酶pCAF可乙酰化修饰PKM2的K305位点,该位点乙酰化修饰后可抑制PKM2的激酶活性,进而通过溶酶体途径进行降解[16-17]。此外,PKM2的多个位点发生磷酸化能改变其稳定性[18-19]。本研究采用CHX抑制细胞内的蛋白合成后,发现PKM2呈现时间依赖性降解,而过表达BCYRN1后能减慢PKM2蛋白的降解速度,提示BCYRN1可以稳定PKM2蛋白。后续的溶酶体抑制及激活实验也证实PKM2通过溶酶体途径进行降解。因此推测,BCYRN1可能通过减少溶酶体对PKM2的降解而起到稳定PKM2蛋白的作用。此外,本研究通过RNA pull-down和RIP实验证实BCYRN1基因与PKM2蛋白直接结合而发挥稳定PKM2蛋白的作用。
近年来肿瘤微环境(tumor microenvironment,TME)在肿瘤发生发展中的作用受到高度重视[20]。细胞毒性T细胞等效应T细胞的增殖和细胞因子的产生高度依赖于糖酵解,因此在较低葡萄糖水平和高乳酸浓度条件下这些细胞并不活跃。Treg细胞较少依赖糖酵解,主要依赖氧化磷酸化产生能量[21-22]。因此,TME中较高浓度的乳酸可降低效应T细胞功能而不影响Treg细胞功能。本研究发现,表达BCYRN1的SNK-6细胞较shBCYRN1组对葡萄糖的摄取更高,且产生更高水平的乳酸,这可能造成TME中葡萄糖的相对缺乏及酸性环境,从而抑制机体的抗肿瘤免疫,最终造成免疫逃逸。PKM2通过其在Warburg效应中的作用调节免疫细胞的代谢和功能。在肿瘤细胞中,PKM2二聚体可以移位到细胞核中稳定HIF-1α并诱导糖酵解基因的表达[14]。PKM2还可进入到线粒体中,介导BCL-2的磷酸化和稳定化,进而促进癌细胞适应氧化应激[23]。此外,PKM2通过诱导趋化因子,如CCL8、CCL2和CXCL1等因子的释放,促进肿瘤相关巨噬细胞和髓源性抑制细胞向TME募集[24]。这些细胞通过诱导Treg细胞和抑制NK细胞功能发挥免疫抑制功能,从而创造肿瘤免疫抑制微环境。本研究发现BCYRN1可以通过多种途径上调PKM2的表达并增强PKM2蛋白的稳定性,因此靶向BCYRN1或许可以通过调节糖酵解代谢改善机体的抗ENKTCL免疫,从而增强化疗敏感性。
综上所述,本研究发现BCYRN1过表达可以在一定程度上降低溶酶体对PKM2的降解,从而起到增强PKM2蛋白稳定性的作用并最终促进PKM2激活ENKTCL糖酵解途径。但是BCYRN1如何稳定PKM2蛋白,BCYRN1与PKM2相互作用的具体位点以及ENKTCL过表达BCYRN1的具体作用机制等仍有待进一步阐明。
利益冲突:所有作者均不存在利益冲突。

