髓外病变和调节T细胞对多发性骨髓瘤嵌合抗原受体T细胞治疗疗效的影响
王佳 翟志敏 葛健 王兴兵 董毅
作者单位:230601 合肥 1安徽医科大学第二附属医院血液科;230032 合肥 2安徽医科大学第一附属医院血液科;230001 合肥 3中国科学技术大学附属第一医院血液科
靶向B细胞成熟抗原(B cell mature antigens,BCMA)的嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T)疗法在复发难治性多发性骨髓瘤(relapsed/refractory multiple myeloma,RRMM)治疗中取得了较好的应答率,总体缓解率(overall remission rate,ORR)为73%~98%,完全缓解(complete remission,CR)率为31%~69%[1-3]。但是也有研究发现,部分多发性骨髓瘤(multiple myeloma,MM)患者尽管体内的CAR-T细胞持续存在,但最终依然会复发[4]。目前,影响这部分患者缓解持久性的因素尚未明确。既往研究显示,多种因素均可影响CAR-T的治疗反应及其耐药,包括细胞制备前T细胞的特征、CAR-T细胞相关特征、CAR-T细胞的丢失、肿瘤细胞表面抗原表达的丢失导致获得性抵抗治疗以及削弱T细胞活性的免疫抑制微环境有关克隆的出现等[4-5]。本课题组前期研究发现髓外病变(extramedullary diseases,EMD)和调节T细胞(regulatory T cells,Tregs)是复发难治急性淋巴细胞白血病患者CAR-T治疗的预后不良因素[6]。基于此,本研究进一步探索EMD及Tregs对BCMACAR-T细胞治疗RRMM疗效及预后的影响,以期为BCMA-CAR-T疗法的优化提供参考依据。
1 资料与方法
1.1 研究对象
回顾性分析2019年6月至2021年9月在安徽医科大学第二附属医院血液科、安徽医科大学第一附属医院血液科、中国科学技术大学附属第一医院血液科收治的RRMM患者的临床资料。纳入标准:⑴至少接受3线治疗或对免疫调节剂和蛋白酶体抑制剂耐药;⑵年龄≥18岁;⑶符合国际骨髓瘤工作组(international myeloma working group,IMWG)2016诊断标准。排除标准:⑴肝肾功能异常,伴心脏疾病(包括超声心动图EF<50%),心功能不全(心功能分级NYHA:Ⅲ/Ⅳ)者;⑵患有其他脏器恶性肿瘤者;⑶乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)及结核病患者活动期,人类免疫缺陷病毒(HIV)阳性患者;⑷合并未控制的严重感染或代谢性疾病者;⑸不能理解或不遵从研究方案者。本研究通过伦理委员会批准(伦理号:PJ-YX2019-015)并在中国临床试验注册中心注册(注册号:ChiCTR2000040368),患者均签署知情同意书。
1.2 治疗方案
所有患者经预处理化疗后均采用BCMA-CAR-T细胞制剂治疗。预处理化疗方案:氟达拉滨(30 mg/m2,静脉注射,每天1次,连续3 d)联合环磷酰胺(300 mg/m2,静脉注射,每天1次,连续3 d);预处理化疗结束后的第2天静脉输注BCMA-CAR-T细胞制剂,输注平均剂量为3.5×106个CAR阳性T细胞/kg。输注28 d后进行骨髓形态学、免疫固定电泳等检查,评估缓解状态;第30~180天,每月监测血常规、肝肾功能、电解质、乳酸脱氢酶、β2-微球蛋白、免疫球蛋白定量、血清免疫固定电泳、尿免疫固定电泳、血清游离轻链、骨髓形态学及骨髓病理,之后每3个月检测1次。随访期间,若发现可疑的复发症状,立即检查并给予相应挽救治疗。
1.3 信息收集及定义
通过住院及门诊病历收集患者的临床和实验室相关资料,包括年龄、性别、化疗线数、复发次数、预后危险分层、ECOG评分、骨髓原幼浆细胞比例、Tregs、EMD等基线特征。EMD定义为骨髓外异常浆细胞浸润,通过磁共振成像或正电子发射计算机断层扫描确定病变部位,并通过细胞学或病理活检检测肿块中的浆细胞。Tregs检测方法:所有患者进行CAR-T细胞治疗前均抽取2~5 mL外周血,肝素化管抗凝,4 h内检查;取100 μL外周血,与特异性单抗(FITC-CD25-单抗、PE-CD127-单抗、PC5.5-CD4单抗)于25℃下孵育15 min,红细胞被裂解后,用流式细胞仪FC-500快速评估,并使用CXP 2.0软件分析。同期收集10名健康人的Tregs,其正常值范围为4.29%~6.17%。当Tregs水平大于正常值上限时定义为Tregs水平异常增高组,否则定义为Tregs水平正常或较低组。
1.4 疗效和安全性评价
MM的疗效评估参考2016年IMWG疗效标准[7],分为CR、非常好的部分缓解(very good partial remission,VGPR)、部分缓解(partial remission,PR)、疾病稳定(steady disease,SD)、疾病进展(progression disease,PD)、复发;ORR为CR、VGPR及PR的率的总和。根据2014年IMWG的预后评估体系进行危险分层[8],其中低危指国际分期系统(international staging system,ISS)Ⅰ或Ⅱ期且没有t(4;14)或17p13-和1q21+,中危指不符合低危及高危标准,高危指ISS分期Ⅱ/Ⅲ期且t(4;14)或17p13-。采用美国国立癌症研究院通用毒性标准(CTCAE 3.0)评估不良事件,分为1~5级;根据美国血液与骨髓移植学会2018年发布的共识分级系统[9]对细胞因子释放综合征(cytokine release syndrome,CRS)和免疫效应细胞相关的神经毒性综合征(immune effector cell-associated neurotoxicity syndrome,ICANS)进行诊断和分级(1~4级)。
1.5 随访
通过电话、门诊复查进行随访,随访截至2021年12月。主要观察指标为患者持续缓解时间(duration of response,DOR)、无复发生存期(relapse-free survival,RFS)和总生存期(overall survival,OS)。DOR定义为自评估为CR、VGPR或PR至第一次评估为PD或因任何原因死亡的时间,RFS定义为从接受BCMA-CAR-T细胞开始至疾病复发或因疾病进展死亡的时间,OS定义为从接受BCMA-CAR-T细胞开始到末次随访或因任何原因死亡的时间。
1.6 统计学分析
采用SPSS 22.0软件进行统计分析。患者特征采用描述性统计,分类变量组间比较采用Fisher精确概率法,DOR、RFS及OS采用Kaplan-Meier方法进行评估,采用Cox回归模型对临床及实验参数进行单因素分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 患者基本特征
共33例RRMM患者符合标准纳入研究,其中6例患者因培养失败未进行细胞输注,3例患者放弃治疗,最终纳入24例。24例RRMM患者中位年龄为62岁(范围:35~70岁),其中男性14例,女性10例;原发难治性3例、曾接受自体造血干细胞移植2例、曾使用CD38单抗1例;高危15例;治疗线数大于3次11例;有EMD 5例,其中浆细胞白血病2例,侵犯中枢神经系统1例,同时累及多部位浸润2例;外周血Tregs水平高于正常值上限15例,其余9例Tregs水平正常或较低。24例RRMM患者的基线资料详见表1。

表1 24例RRMM患者的基线特征[n(%)]Tab.1 Baseline characteristics of the 24 RRMM patients[n(%)]
2.2 EMD和Tregs对缓解率的影响
输注BCMA-CAR-T细胞2个月内,所有患者的ORR为87.5%,CR为50.0%,VGPR为29.2%,PR为8.3%。有EMD患者的ORR及CR明显低于无EMD患者,差异有统计学意义(χ2=4.318,P=0.038;χ2=2.460,P=0.014);Tregs水平异常增高患者的ORR及CR与Tregs水平正常或较低患者比较,差异均无统计学意义(均P>0.05)。见表2。
2.3 EMD和Tregs对患者DOR的影响
BCMA-CAR-T细胞治疗后RRMM患者的缓解程度与DOR存在相关性,其中达到CR、VGPR及PR患者的中位DOR分别为16.6个月、7.8个月及3.5个月,不同缓解程度患者的DOR比较差异有统计学意义(χ2=25.323,P=0.001),见图1。有无EMD患者的中位DOR分别为5.333(95%CI:1.359~9.307)个月和13.611(95%CI:10.600~16.622)个月,差异有统计学意义(χ2=8.318,P=0.004);Tregs水平异常增高患者与Tregs水平正常或较低患者的中位DOR分别为8.917(95%CI:6.849~10.984)个月和18.250(95%CI:13.438~23.062)个月,差异有统计学意义(χ2=11.479,P=0.001),见图2。

图1 患者缓解深度对持续缓解时间的影响Fig.1 Effects of depth of remission on duration of response
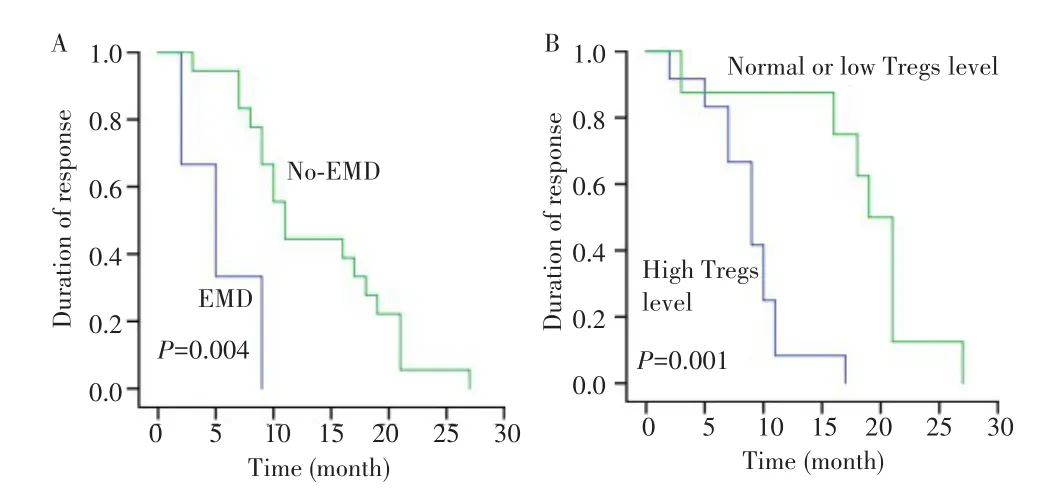
图2 EMD和Tregs对患者持续缓解时间的影响Fig.2 Effects of EMD and Tregs on duration of response
2.4 EMD和Tregs对患者OS及RFS的影响
随访截至2021年12月,中位随访15.2个月(范围:2.1~29.0个月),总体OS率为79.2%,RFS率为54.2%。有无EMD患者的OS率分别为60.0%、84.2%,差异有统计学意义(χ2=6.187,P=0.013),见图3A;Tregs水平异常增高患者与Tregs水平正常或较低患者的OS率分别为73.3%、88.9%,差异无统计学意义(χ2=3.128,P=0.077),见图3B。有无EMD患者的RFS率分别为40.0%、57.9%,差异有统计学意义(χ2=7.397,P=0.007),见图4A;Tregs水平异常增高患者与Tregs水平正常或较低患者的RFS率分别为40.0%、77.8%,差异有统计学意义(χ2=6.478,P=0.011),见图4B。

图3 EMD和Tregs对患者总生存的影响Fig.3 Effects of EMD and Tregs on overall survival

图4 EMD和Tregs对患者无复发生存的影响Fig.4 Effects of EMD and Tregs on relapse-free survival
进一步采用单因素Cox回归分析接受BCMACAR-T细胞治疗患者的基线特征与OS、RFS的关系,结果显示,有无EMD患者的OS和RFS差异均有统计学意义(HR=8.465,95%CI:1.150~62.315,P=0.036;HR=5.569,95%CI:1.332~23.285,P=0.019),Tregs水平异常增高患者与Tregs水平正常或较低患者的RFS差异亦有统计学意义(HR=8.806,95%CI:1.088~71.282,P=0.017)。
2.5 安全性评价
所有患者总体耐受性良好,不良反应以血液学毒性反应为主,包括中性粒细胞减少症(83.3%)、贫血(41.7%)和血小板减少症(45.8%)。发生CRS 19例(79.2%),神经系统毒性反应2例(8.3%),未见因不良反应死亡病例。有无EMD组及Tregs水平高低组患者在BCMA-CAR-T细胞治疗中总体不良事件的发生率差异无统计学意义(均P>0.05),见表3。

表3 有无EMD及Tregs水平高低患者的不良反应发生情况[n(%)]Tab.3 The adverse reactions of patients with or without EMD and Tregs level[n(%)]
3 讨论
BCMA-CAR-T疗法在RRMM患者中显示出良好的疗效,但也有部分患者无效或持久性较差,而患者特殊的临床特征如EMD、Tregs、基线肿瘤负荷、ISS分层高危等可能是其中原因之一[1,10]。当克隆浆细胞生长在远离骨髓的解剖部位,或生长在突破皮质骨的骨病变附近时,称为EMD。EMD是MM的一种罕见表现,其特征是累及单个或多个器官,包括皮肤、肝脏、淋巴系统、胸膜和中枢神经系统等。在新诊断的MM患者中,EMD发病率为3%~5%,而在复发MM患者中EMD发病率高达20%[11]。既往研究显示,EMD的存在与MM更具侵袭性的表型、血清乳酸脱氢酶升高和高危细胞遗传学如17p缺失、t(4;14)、t(14;16)有关[12]。EMD治疗方案通常遵循高危MM的治疗方案,但预后很差,仅接受化疗患者4年OS率和无进展生存(progression-free survival,PFS)率分别为54%和29%;单次自体移植作为巩固治疗并没有明显改善患者生存,但接受双次自体移植后OS率和PFS率分别为83%和52%,该策略可能会克服不良预后[13]。关于BCMA-CAR-T细胞疗法,有研究报道部分合并EMD的RRMM患者可在短期内受益于BCMA-CAR-T细胞疗法,为桥接造血干细胞移植、放疗和其他治疗提供了时间[14]。也有研究显示,有无EMD的RRMM患者接受人源化抗BCMA-CAR-T细胞治疗后ORR和短期内的PFS及OS无明显获益,但是随着时间延长伴EMD患者的PFS和OS率低于无EMD患者[15]。本研究也发现,有EMD的RRMM患者ORR、DOR以及RFS率和OS率均较无EMD患者明显降低,与上述文献[15]报道相似,提示EMD可能是RRMM患者BCMA-CAR-T细胞治疗预后不良的指标。BCMA-CAR-T细胞治疗不能改善EMD患者的结局,提示BCMA-CAR-T细胞治疗可能不能改善这部分患者的复发问题。因此,对于高Tregs水平患者如何改善其免疫重建,优化CAR-T设计,是需要考虑的问题[16-17]。目前,对于伴EMD的患者,建议通过优化CAR设计、增强持久性和活性的组合方法、优化预处理方案、采用双抗原靶向以防止抗原逃逸、减少化疗线数、早期应用CAR-T细胞治疗等途径提高CAR-T细胞治疗效力[18-19]。
免疫损伤是MM的一个重要特征,骨髓微环境高度免疫抑制涉及体液和细胞免疫系统,包括未受影响的免疫球蛋白水平降低和功能失调的T细胞反应,同时也与MM患者发病、复发甚至死亡相关。肿瘤微环境中的Tregs在抑制肿瘤细胞的抗肿瘤免疫反应中发挥重要作用,高Tregs水平能促进免疫逃逸和肿瘤生长,致使预后不良[20],同时Tregs细胞亚群对CAR-T细胞治疗恶性肿瘤疗效的影响及可能机制也已有初步探讨[6,10,21]。但目前 Tregs与BCMA-CAR-T细胞治疗疗效的关系鲜见报道。为了明确Tregs对BCMACAR-T细胞疗效的影响,本研究进一步分析Tregs水平异常增高以及Tregs水平正常或较低患者的近期疗效,结果发现Tregs水平高低并不影响患者的总体缓解率,但Tregs水平异常增高患者的DOR明显缩短,总体RFS率也明显降低,表明高水平Tregs患者接受BCMA-CAR-T细胞治疗后,Tregs可能影响CAR-T细胞在体内进一步扩增及作用的持久性,提示高水平Tregs患者的复发风险较高。
血液学毒性是BCMA-CAR-T细胞治疗最常见的不良反应,本研究中CRS发生率为79.2%,ICANS为8.3%,与文献[22]报道结果(CRS为 80.3%,ICANS为10.5%)相似。进一步分析有无EMD以及高低Tregs水平患者的不良反应发生率情况,也未发现其差异性,同时均未见治疗相关死亡事件,说明BCMA-CAR-T疗法在RRMM患者治疗中具有良好安全性,EMD及高Tregs水平并未增加CAR-T细胞治疗的不良反应风险。
综上所述,本研究发现EMD及Tregs水平可影响RRMM患者的BCMA-CAR-T细胞治疗疗效,合并EMD患者近期疗效及生存较差,Tregs水平异常增高可能是其复发的危险因素,但两者并不影响BCMA-CAR-T疗法的不良反应。但本研究纳入的病例数以及随访时间有限,且为回顾性研究,因此有关结论仍需进一步验证。

