环氧化物水解酶2在肝细胞癌中的表达水平与功能作用
张文桃, 胡艳芬, 吴 昊, 刘 铭, 李 莉, 杜根来, 朱剑军
(山西医科大学基础医学院医学细胞生物与遗传学教研室,太原 030001)
肝癌是全世界常见恶性肿瘤之一,发病率位居所有恶性肿瘤第6位,死亡率位居第3位。肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌类型之一[1, 2]。肝细胞癌的发生是一个多基因参与、多步骤的复杂过程,与多种危险因素有关,主要包括乙型肝炎病毒、丙型肝炎病毒、黄曲霉毒素、酒精以及非酒精性脂肪性肝病等[3, 4]。大多数肝细胞癌患者首诊较晚,因此预后较差[4]。目前,已发现多种癌基因、抑癌基因及多种信号途径与肝细胞癌的发生发展有关,例如受体酪氨酸激酶信号通路、RAS丝裂原活化蛋白激酶(RAS/RAF/MAPK)信号通路等[5]。但是,截止目前为止,肝细胞癌早期诊断、预后判断等方面仍无理想的肿瘤标志物,且肝细胞癌的分子发病机制仍不清楚。因此,继续寻找与肝细胞癌早期诊断及预后判断有关的肿瘤标志物具有重要的临床意义。
研究报道,线粒体功能异常和肝细胞癌的发生发展密切相关。到目前为止,MitoCarta数据库显示,人类线粒体中共包括1 136种蛋白质。基于此,我们推测呈差异表达的线粒体相关基因可能在肝细胞癌发生发展过程中发挥重要作用。花生四烯酸是一种人体必需脂肪酸,已有大量研究报道,花生四烯酸与多种恶性肿瘤的发生与发展紧密相关,包括肝细胞癌、胆管癌和卵巢癌等[6,7]。环氧化物水解酶2(epoxide hydrolase 2,EPHX2)基因位于8号染色体(8p21.12),其mRNA由19个外显子组成,所编码的蛋白质由555个氨基酸残基组成[6]。可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)是由EPHX2基因编码的多功能蛋白质,定位于线粒体,是花生四烯酸代谢途径中的一种关键酶[7]。sEH可将环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)代谢为二羟基二十碳三烯酸(dihydroxyeicosatrienoic acid,DHET)[8]。已有研究报道,与正常肝组织相比,sEH在肝癌组织中的表达水平显著下调[9]。sEH在精原细胞瘤、胆管癌和进展期卵巢癌中表达水平升高[10]。基于EPHX2在肝细胞癌中的研究较少,本文利用GEO、TCGA、MitoCarta等公共数据库,全面分析EPHX2在肝细胞癌中的表达水平、功能作用及预后意义,以期望为后续实验性研究及肝细胞癌的早期诊断和预后判断提供潜在的分子靶标和理论指导。
1 材料与方法
1.1 材料
TRIzol Reagent(Invitrogen公司),PrimeScriptTMRT Master Mix(Perfect Real Time)反转录试剂盒(TaKaRa公司),TB Green®PremixExTaqTMⅡ(Tli RNaseH Plus)(TaKaRa公司)。肝癌细胞株MHCC-97 H、HCCLM3(LM3)和正常肝细胞株QSG-7701为本实验室保存细胞株。扩增引物由生工生物工程(上海)有限公司合成(Table 1)。

Table 1 Primer sequences
1.2 公共数据获取
GDC官网下载癌症基因组数据库(The Cancer Genome Atlas,TCGA)中肝细胞癌转录组数据和临床信息数据。通过limma包筛选差异表达基因。筛选差异表达基因的条件为:logFC>1,P<0.01,且具有完整的临床信息及随访信息。纳入本研究的肝细胞癌样本340例,正常样本50例。GEO官网搜索GSE101728,GSE45050,GSE84598和GSE121248肝癌数据集,通过GEO2R在线平台筛选肝癌组织和癌旁组织中的差异表达基因,筛选条件为logFC>1,P<0.05。其中,GSE101728包括7例肝癌样本,7例癌旁样本;GSE45050包括6例肝细胞癌样本,3例正常肝组织样本;GSE84598包括22例肝癌样本,22例正常肝组织样本;GSE121248包括70例肝癌样本,37例癌旁样本。
1.3 筛选肝细胞癌中线粒体相关差异表达基因
筛选上述4个GEO数据集中的共有差异表达基因。通过MitoCarta3.0下载线粒体相关基因,并与上述差异表达基因再取交集,筛选肝细胞癌线粒体相关差异表达基因。
1.4 基因表达水平分析
整理TCGA肝细胞癌RNA转录组数据。分析EPHX2及本研究筛选获得的差异表达基因在肝癌组织和正常肝组织中的表达水平,并分析EPHX2表达水平与肝癌患者临床病理特征的关系。
1.5 蛋白质互作网络和基因集富集分析
基于UALCAN数据库下载EPHX2相关基因及相关系数,运行R包(enrichplot和ggplot2)进行基因功能分析。基因功能分析主要包括GO分析和KEGG信号通路分析。下载基因集富集分析(gene set enrichment analysis, GSEA)软件并安装。以EPHX2在肝癌样本中的中位表达水平的值为分界线,将肝细胞癌患者分为EPHX2低表达组和EPHX2高表达组。上传EPHX2高表达组和低表达组全部基因表达矩阵,Gene sets database选择c2.all.v7.4.symbols.gmt[curated],运行GSEA。基于STRING和Cytoscape完成蛋白质互作网络分析。
1.6 生存预后分析
根据TCGA转录组数据,以EPHX2表达水平的中位值为标准,将肝癌患者分为EPHX2低表达组和EPHX2高表达组。运行R包(survival和survminer)绘制Kalpan-Meier生存曲线。
1.7 组织样本收集
肝癌组织及对照癌旁组织标本21例,来源于山西医科大学附属第一医院。肝癌诊断均经病理证实,自身对照癌旁组织(距肿瘤边缘>5 cm)经病理检查未发现癌细胞。收集组织标本后立即转移至液氮中保存。本研究已通过山西医科大学科学研究伦理审查,病人和家属均签署知情同意书。
1.8 细胞培养
常规培养肝癌细胞和正常肝细胞。用含10%胎牛血清的DMEM培养液培养细胞。
1.9 RNA提取、反转录及实时荧光定量PCR
取组织50~100 mg,按照Trizol说明书提取组织RNA。按照PrimeScriptTMRT Master Mix反转录试剂盒说明书将RNA反转录为cDNA。根据TB Green®PremixExTaqTMⅡ试剂盒说明书配制PCR反应体系,应用StepOnePlus Real-Time PCR System进行PCR扩增。两步法PCR扩增程序为:第一步预变性,95 ℃ 10 min,1个循环;第二步PCR反应,95 ℃ 15 s,60 ℃ 1 min,40个循环。基因表达水平以2-ΔCт进行定量。Β肌动蛋白为内参照基因。每个样本重复3次,每次3个复孔。
1.10 统计学方法
采用 SPSS16.0软件分析。实验数据以数值±标准差表示,采用配对t检验检测EPHX2在肝细胞癌组织和癌旁组织中的表达差异。P<0.05 被认为差别具有统计学意义。
2 结果
2.1 筛选获得15个肝细胞癌中的线粒体相关差异表达基因
在线运行分析肝细胞癌数据库GSE101728、GSE45050、GSE84598、和GSE121248,分别筛选获得5 310个、661个、1 154个和952个在肝细胞癌组织中呈差异表达的基因。Fig.1为HCC中差异表达基因的维恩图分析。对以上差异表达基因取交集,筛选获得140个在上述4个肝细胞癌数据集中均呈差异表达基因(见Fig.1A)。于Human MitoCarta3.0网站下载得到1 136个线粒体相关基因,与上述140个差异表达基因取交集,最终筛选获得15个在肝细胞癌中呈差异表达的线粒体相关基因(见Fig.1B)。
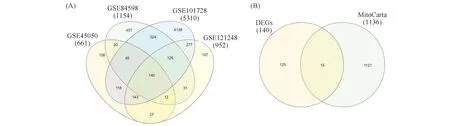
Fig.1 Venn diagram analysis of differentially expressed genes in HCC (A)Venn diagram analysis of differentially expressed genes in four HCC GEO databases.(B)After taking the intersection of 140 DEGs from the above four GEO databases and mitochondrion-related genes from MitoCarta, 15 mitochondrion-related DEGs were identified in this study.DEGs, differentially expressed genes
2.2 15个线粒体相关差异表达基因在肝细胞癌中的表达水平
利用TCGA数据库,分析15个线粒体相关差异表达基因在肝细胞癌中的表达水平。结果表明,与正常肝组织中相比,溶质载体家族25成员47(solute carrier family 25 member 47,SLC25A47)、犬尿氨酸-3-单加氧酶(kynurenine 3-monooxygenase,KMO)、氨基乙二酸转氨酶(aminoadipate aminotransferase,AADAT)、谷胱甘肽S-转移酶ζ1(glutathione S-transferase zeta 1,GSTZ1)、氧化戊二酸脱氢酶L(oxoglutarate dehydrogenase L,OGDHL)、酰基辅酶A合成酶中链家族成员5(acyl-CoA synthetase medium chain family member 5,ACSM5)、4-羟基-2氧化戊二酸醛缩酶1(4-hydroxy-2-oxoglutarate aldolase 1,HOGA1)、乙酰辅酶A羧化酶β(acetyl-CoA carboxylase beta,ACACB)、脱氢酶/还原酶1(dehydrogenase/reductase 1,DHRS1)、酰基辅酶A脱氢酶短链(acyl-CoA dehydrogenase short chain,ACADS)、酰基辅酶A合成酶长链家族成员1(acyl-CoA synthetase long chain family member 1,ACSL1)、溶质载体家族25成员18(solute carrier family 25 member 18,SLC25A18)、EPHX2和甘氨酸脱羧酶(glycine decarboxylase,GLDC)在肝细胞癌组织中的表达水平均显著降低(均P<0.01);与在正常肝组织中相比,线粒体外膜转位酶40(translocase of outer mitochondrial membrane 40 like,TOMM40L)在肝细胞癌组织中的表达水平显著升高(P<0.01)。Fig.2为肝癌HCC中15个线粒体相关差异表达基因的表达水平。

Fig.2 Expression levels of the 15 mitochondria-related differentially expressed genes in HCC The expression of the 15 mitochondria-related differentially expressed genes was analyzed using TCGA database(including 340 tumor tissues and 50 normal tissues).** P<0.01, compared with the normal group
2.3 环氧化物水解酶2在肝细胞癌中呈低表达
EPHX2是花生四烯酸代谢途径中的一个关键酶,且花生四烯酸代谢紊乱与多种恶性肿瘤的发生发展紧密相关。本研究利用TCGA-RNA测序数据,分析EPHX2在340例肝细胞癌组织中的表达水平。Fig.3为肝细胞癌组织中EPHX2的表达水平。结果表明,与正常肝组织中相比,EPHX2在肝细胞癌组织中表达水平显著降低(6.203 ± 0.074vs8.171 ± 0.059,P<0.01)(Fig.3A)。研究结果进一步表明,EPHX2在晚期肝癌患者(Ⅲ+Ⅳ期)中的表达水平显著低于其在早期肝癌患者(Ⅰ+Ⅱ期)中的表达水平(5.880 ± 0.160vs6.314 ± 0.082,P=0.011)(Fig.3B)。EPHX2在女性肝癌患者中的表达水平显著低于其在男性肝癌患者中的表达水平(5.923 ± 0.143vs6.333 ± 0.085,P=0.010)(Fig.3C)。随肿瘤级别升高,EPHX2表达水平逐渐降低(6.847 ± 0.154vs6.309 ± 0.093vs5.831 ± 0.139,均P<0.01)(Fig.3D)。EPHX2在肝癌组织中的表达水平与患者年龄、T分期、N分期、M分期等因素无关(均P>0.05)(Table 2)。
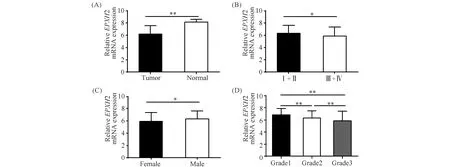
Fig.3 The expression level of EPHX2 in HCC (A)The expression level of EPHX2 in 340 HCC and 50 normal tissues.(B)The expression level of EPHX2 in 253 early stages and 87 advanced stages of tumor tissues.(C)The expression level of EPHX2 in the tumor tissues of 108 female and 232 male HCC patients.(D)The expression level of EPHX2 among 46 cases in grade 1, 167 cases in grade 2 and 127 cases in grade 3 tumor tissues in HCC.*P<0.05,** P<0.01

Table 2 The correlation of EPHX2 with HCC patient characteristics
2.4 环氧化物水解酶2低表达与肝细胞癌患者不良预后有关
生存结果表明,EPHX2高表达组的总生存期高于EPHX2低表达组,且差异具有统计学意义(P<0.01, Fig.4)。

Fig.4 Survival analysis of EPHX2 in HCC The mRNA expression data of EPHX2 in 340 HCC samples and survival information were extracted from TCGA(https://portal.gdc.cancer.gov/).HCC patients in this study were divided into low(n=170)and high expression groups(n=170)by the mean expression level of EPHX2 in HCC tissues.Comparison of the difference between the two groups was based on the Log-rank test
2.5 环氧化物水解酶2及共表达基因的功能富集分析
功能富集分析结果显示:生物过程方面主要与小分子代谢过程、有机酸代谢过程等相关。在细胞组成方面主要与线粒体基质、过氧化物酶体等相关;分子功能方面主要与含硫化合物结合、氧化还原酶活性等相关。信号通路富集结果显示:EPHX2主要与补体途径,脂肪酸降解等信号通路相关(Fig.5)。GSEA基因集富集结果显示,EPHX2低表达组肝癌增殖基因簇水平升高(NES =4.558),肝癌复发基因簇水平升高(NES = 3.991)(Fig.6A)。EPHX2高表达组肝癌肿瘤增殖活性基因簇水平降低(NES =-5.041),肝癌复发相关基因簇水平降低(NES =-4.226)(Fig.6B)。

Fig.5 The functional analysis of EPHX2 and its co-expressed genes GO and KEGG pathway enrichment analysis was performed on EPHX2 and its 335 co-expressed genes.(A)Go term analysis.(B)KEGG analysis.BP, Biology process, CC, cellular component, MF, molecular function

Fig.6 The GSEA findings of the c2 reference gene sets for the high expression of EPHX2 and low expression of EPHX2 groups (A)The EPHX2-lower expression group was mainly enriched in the gene sets labeled with Liver cancer subclass proliferation up, Liver cancer recurrence up and HCC progenitor Wnt up.(B)The EPHX2-higher expression group was mainly enriched in the gene sets labeled with Liver cancer subclass proliferation down, Liver cancer recurrence down and Liver cancer poor survival down.NES, normalized enrichment score
2.6 环氧化物水解酶2及相关蛋白质的蛋白质互作网络
利用STRING数据库构建蛋白质-蛋白质互作网络。正如图7所示,EPHX2与羟基酸氧化酶1(hydroxyacid oxidase 1,HAO1)、丙氨酸乙醛酸转氨酶(alanine-glyoxylate aminotransferase,AGXT)、酰基辅酶A氧化酶1(acyl-coenzyme A oxidase 1,ACOX1)、谷胱甘肽S-转移酶κ1(recombinant glutathione S transferase κ 1,GSTκ1)、固醇转运蛋白(sterol carrier protein-2,SCP-2)、过氧化氢酶(catalase,CAT)以及细胞色素P450酶家族成员有相互作用(Fig.7A)。相关性结果表明,EXPH2与CAT相关性系数高达0.6,EXPH2与ACOX1相关性系数为0.56,EXPH2与HAO1相关性系数为0.55,EXPH2与SCP-2相关性系数为0.54(Fig.7B和Fig.7C)。以上结果高度提示,EPHX2可能与细胞内氧化还原稳态有关。

Fig.7 The analysis of protein-protein interaction and correlation for EPHX2 and its co-expressed genes in HCC (A)The protein-protein interaction network map representing the network of EPHX2 and its co-expressed genes.The network model was generated using Cytoscape, focused on EPHX2 and its top 10 co-expressed gene.(B)Correlation for the co-expressed genes was analyzed by GEPIA(http://gepia2.cancer-pku.cn/#correlation).(C)Heat map shows the expression profile of the co-expressed genes for EPHX2 in 340 HCC tissues and 50 normal tissues.Red indicates that the gene has a higher expression; green indicates that the gene has a lower expression level
2.7 验证环氧化物水解酶2在肝癌组织中呈低表达
利用实时荧光定量PCR验证EPHX2在肝癌组织和肝癌细胞株中表达水平。结果显示,EPHX2在9例肝癌患者癌组织中的表达水平较其在对照癌旁组织中显著降低(0.161 ± 0.061vs1.312 ± 0.480,P=0.03)(Fig.8A)。EPHX2在肝癌细胞株中的表达水平显著低于其在正常肝细胞中的表达水平(Fig.8B)。本研究利用GEO数据库,进一步验证EPHX2在肝细胞癌组织中的表达水平。结果表明,在GSE14520数据集中,与正常肝组织相比,EPHX2在肝细胞癌组织中表达水平显著降低(6.877 ± 0.089vs8.838 ± 0.044,P<0.01)(Fig.8C)。在GSE25097数据集中,与正常肝组织相比,EPHX2在肝细胞癌组织中表达水平显著降低(7.641 ± 0.257vs12.50 ± 0.225,P<0.01)(Fig.8D)。在GSE22058数据集中,与正常肝组织相比,EPHX2在肝细胞癌组织中表达水平显著降低(3234± 186.2vs5756 ± 126.3,P<0.01)(Fig.8E)。在GSE36376数据集中,与正常肝组织相比,EPHX2在肝细胞癌组织中表达水平显著降低(9.136 ± 0.071vs10.35 ± 0.039,P<0.01)(Fig.8F)。

Fig.8 Validation for the expression level of EPHX2 in HCC (A)The mRNA expression level of EPHX2 in 21 HCC tumors and peritumor tissues by RT-qPCR.(B)The mRNA expression level of EPHX2 in HCC cell lines and normal hepatic cell line by RT-qPCR.RNA was extracted from tissues or cell lines and reverse transcribed into cDNA.Quantitative PCR was used to amplify the target genes.β-Actin was used as an internal control.Data were expressed as mean ± SD(n=3).The expression level of EPHX2 between normal and HCC tumor tissues in GSE14520(C), in GSE25097(D), in GSE22058(E), in GSE36376(F).*P<0.05,** P<0.01
3 讨论
本研究通过GEO和MitoCarta数据集共筛选获得15个在肝细胞癌中呈差异表达的线粒体相关基因,包括SLC25A47、KMO、AADAT、GSTZ1、OGDHL、ACSM5、HOGA1、ACACB、DHRS1、ACADS、ACSL1、SLC25A18、EPHX2、GLDC和TOMM40L。近年来,EPHX2在多种恶性肿瘤中的表达水平已有报道,例如肝细胞癌、前列腺癌、胆管癌和乳腺癌等[9-11]。Gui等[9]报道,在HuH-7和HepG2肝癌细胞系中,sEH表达水平显著降低。Enayetallah等[10]报道,sEH在肝癌组织中表达缺失,且sEH在肾细胞癌组织中的表达水平也显著降低。Liu等[12]报道,EPHX2在前列腺癌组织中的表达显著降低。与上述研究结果一致,本研究结果显示,EPHX2在肝细胞癌中表达水平显著降低,且EPXH2低表达与肝细胞癌患者不良预后紧密相关,提示EPHX2可能能够作为肝细胞癌患者预后判断的肿瘤标志物。此外,本文的研究结果表明,EPHX2在晚期肝癌组织中的表达水平显著低于其在早期肝癌组织中的表达水平,提示EPHX2可能与肝细胞癌的发生进展有关。但也有研究报道,在胆管癌、精原细胞瘤中,sEH表达水平增高[10]。Wang等[11]报道,EPHX2在三阴性乳腺癌组织中的表达水平显著升高。我们推测,研究团队间结果不一致性,可能与肿瘤类型和各研究团队的恶性肿瘤患者纳入标准与研究方法不同等有关。
Khadir等[13]报道,在人原代前脂细胞和小鼠3T3-L1细胞分化过程中,EPHX2的表达水平升高。使用sEH抑制剂作用于分化的HT-29和Caco2细胞后,肠上皮细胞细胞分化标志物的表达水平明显降低[14]。Zhou等[15]报道,外源性的EET能够抑制血管紧张素Ⅱ诱导的血管外膜成纤维细胞分化。本研究发现,EPHX2在高级别肝细胞癌组织中的表达水平显著低于其在中-低级别肝细胞癌组织中的表达水平。功能富集结果表明,在细胞组成方面,EPHX2主要分布在线粒体、过氧化物酶体等部位;分子功能主要与含硫化合物的结合、铁离子的结合等有关;生物过程主要与有机酸代谢以及小分子代谢等有关。信号通路结果表明,EPHX2基因主要与补体途径,花生四烯酸代谢等相关。花生四烯酸代谢是参与细胞信号转导的一条关键途径,它可被环氧合酶、脂氧合酶和细胞色素P450(cytochrome P450,CYP450)环氧合酶途径代谢为具有生物活性的二十烷类化合物,其中CYP450途径可将花生四烯酸代谢为EETs。sEH是一种双功能酶,具有环氧化物水解酶和脂磷酸酶双重活性[13, 16, 17]。EETs主要由sEH代谢。Enayetallah等[10]研究发现,在肝癌组织中,sEH表达缺失。已有研究报道,抑制sEH后,14,15-EET水平升高,最终促进肿瘤的生长和转移[18]。基于已有文献报道和本研究生物信息学分析结果,本文推测,EPHX2于线粒体中参与花生四烯酸代谢,其表达水平异常降低导致花生四烯酸代谢紊乱,引发线粒体内脂代谢紊乱,最终导致线粒体功能异常,促进肝细胞癌的恶性进展。
本研究发现,细胞色素P450家族成员,包括CYP2C8,CYP2C9,CYP2B6,CYP2J2与EPHX2显著相关。它们属于花生四烯酸环氧酶,可将花生四烯酸代谢成4种具有生物活性的环氧二十碳三烯酸的区域异构体。EETs可被sEH水解形成二羟基二十碳三烯酸[19]。已有研究表明,在一些肿瘤中,细胞色素P450家族成员表达水平上调,EETs生成增多,通过促进血管生成,最终促进肿瘤生长[18];过表达CYP2J2或使用EET类似物升高EETs水平后,对高血压、心力衰竭、心肌梗死等多种心血管疾病具有保护作用[20]。本研究发现,在肝细胞癌中,CYP2C8、CYP2C9、CYP2B6、CYP2J2与EPHX2的mRNA表达水平相关,且CYP2C8、CYP2C9、CYP2B6和CYP2J2在肝细胞癌中表达水平异常。结果高度提示,表达水平异常的花生四烯酸代谢途径成员CYP2C8、CYP2C9、CYP2B6、CYP2J2和EPXH2,通过导致花生四烯酸代谢紊乱,最终导致肝细胞癌脂代谢紊乱。
综上,本研究发现,EPHX2在HCC中呈低表达,推测其可能通过导致EETs累积,促进肝细胞癌恶性发展,但具体的分子作用机制尚需进一步实验验证。此外,EPHX2高表达组肝癌患者预后较好,提示EPHX2可以作为HCC预后评估的潜在肿瘤标志物。

