几种椎间盘退变动物模型的建立和应用
陈明珏, 曹惠玲, 肖国芝
(南方科技大学医学院生物化学系,广东 深圳 518055)
下腰痛(low back pain, LBP)是世界范围内致残的主要因素之一,给社会带来了巨大的医疗和经济负担[1]。据流行病学调查,下腰痛的平均总患病率为31.0%[2],在伤残损失寿命年影响因素中排名第一[3]。虽然下腰痛的症状是短暂的并且通常症状会在6周内恢复,但复发率很高。下腰痛患者的原发性疼痛位置很难确定。实验和临床研究表明,近40%下腰痛的病例中,椎间盘退变是主要因素[4]。椎间盘退变性疾病患者通常会发生椎间盘高度的下降以及骨赘的形成,并伴随有典型的腰骶棘、骶髂关节持续腰痛病史,并向臀部和大腿后部放射,并且椎间盘退变的患者久坐和长时间走路会加重疼痛的发生[5,6]。目前,对椎间盘退变性疾病的治疗有非手术治疗和手术治疗两种方式。对于未达到手术标准的患者一般建议非手术治疗,并且手术治疗方法仍不能阻止椎间盘退变的继续进行,也不能恢复退变的椎间盘的生理功能[7]。因此对于椎间盘退变机制的探究极为重要。
尽管椎间盘退行性变可引起巨大的社会经济负担,研究者们对其发病和进展的潜在机制仍不完全了解。因此,对于早期临床诊断和新疗法的发展、疾病进展的中断或逆转,以及椎间盘退行性变机制的阐明和治疗策略的改进来说,动物模型的构建具有重要的意义。椎间盘退变是一个复杂的且尚未被完全阐明的多因素的过程,该过程受机械应力、结构损伤、基因表达、缺氧和血供受限导致的营养的改变等多种因素影响[8]。体外模型有助于理解单因素对椎间盘退变的影响,而对于同时包括多因素在内的复杂的椎间盘退变微环境,体内动物模型则能更好的对椎间盘退变过程进行模拟[9]。本文将对国内外报道的针对椎间盘退变机制研究构建的动物模型进行综述。
1 机械应力模型
生物力学是维持椎间盘稳态的重要组成部分之一。对于椎间盘机械负荷来说,生理的机械负荷是维持椎间盘细胞表型所必需的[10,11],而过度的机械负荷会导致椎间盘损伤和退变。过度负荷可由过重的体重[12]或外伤引起,并产生许多能通过组织学和放射学方法观察到的退变特征,例如椎间盘高度降低、骨赘形成、纤维环紊乱和髓核细胞被成纤维细胞所替代等。椎间盘退变的机械应力模型可以分为加压和失稳两种类型[13]。
1.1 加压模型
加压模型包括通过弯曲或轴向压缩加压等方法来增加对椎间盘的机械应力。大鼠尾椎间盘弯曲模型是诱导椎间盘退行性变的早期方法之一(Fig.1A)。在先前的研究中,研究者们发现,将大鼠的尾部固定成弯曲形态会诱导尾部凹侧椎间盘中细胞坏死增加,聚集蛋白聚糖基因表达降低[14],椎间盘纤维环发生退变[15]。随后的研究表明,将大鼠的尾部固定成弯曲形态不仅会对椎间盘产生额外的机械应力,还会导致椎间盘内压力发生再分配,当椎间盘最初受到压缩时,髓核的机械应力和纤维环的紧张度增加,当压缩负载持续维持直至机械应力超过髓核的膨胀压后,会使髓核随着时间变化而体积减小,髓核体积的损失又会反过来将压缩压力再分配到内纤维环上,最终导致纤维环退变[13]。
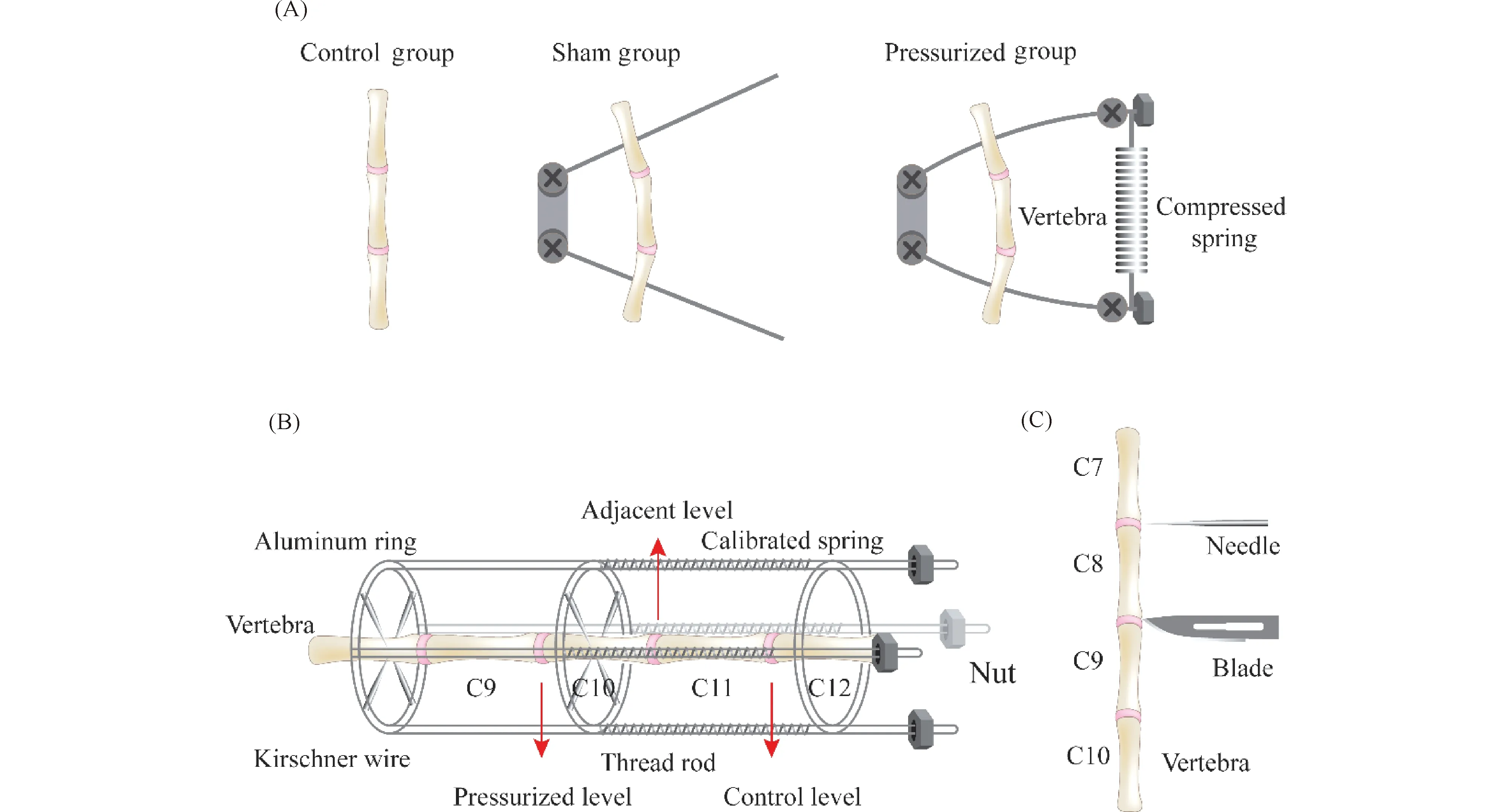
Fig.1 Schematic diagram of the IVD animal surgical model (A)Rat models of curved caudal disc.This model has three groups, including the control group, sham and pressurized group.The pressurized group applies pressure to the intervertebral disc by flexing the vertebrae with a compressed spring.(B)The rat caudal IVD compression model.In this model, the axial stress loaded from the distal side produces a compressive pressure onto C8-9 and C9-10 IVDs through tightening calibrated springs.(C)The puncture model of the tail intervertebral disc.This model is created by using a needle or blade to puncture the nucleus pulposus tissue or annulus fibrosus
对椎间盘施加静态或动态的轴向压缩压力诱导椎间盘退变,常被用于椎间盘退变机制的探究(Fig.1B)。Iatridis等[16]通过在大鼠尾椎上安装加压装置,构建了一种大鼠尾椎间盘轴向压缩动物模型,这种模型能够分离出轴向压缩力对椎间盘结构和功能的影响。结果表明,轴向静态加压组与假手术组相比椎间盘机械性能和化学成分变化更大,椎间盘退变程度更大。Kroeber等[17]通过向兔腰椎间盘上安装外部负载装置向椎间盘施加轴向压缩压力,构建兔腰椎间盘压缩模型。并将加压时间作为变量,探究了轴向动态加压1、14和28 d后椎间盘退变情况。结果显示, 加压14和28 d后椎间盘高度明显降低,纤维环结构紊乱。
Walsh等[18]探究了在0.1 Hz或0.0 1Hz下, 从0 MPa到峰值应力0.9 MPa或1.3 MPa的动态加载情况下与静态加载情况下,椎间盘退变程度的区别。结果表明,以较低的频率或较高的压力加载后,髓核细胞中蛋白聚糖含量增加,髓核和纤维环的细胞死亡也增加。因此,对于体内椎间盘细胞功能的调节,除了应力大小和持续时间外,频率也是重要的变量之一。
最近,Bian等[7]通过构建大鼠尾椎间盘轴向静态压缩模型,探究在机械应力作用下转化生长因子β(transforming growth factor β, TGF-β)活性对髓核细胞空泡的减少和细胞外蛋白聚糖增加的影响。并在尾椎间盘轴向静态压缩模型中注射TGF-β抗体。结果显示,注射抗体的实验组比对照组明显减弱椎间盘退化程度,实验组液泡形态的维持以及磷酸化Smad2/3蛋白阳性细胞明显减少,证明了TGF-β在椎间盘退变过程的分子机制中的重要作用,为新的治疗策略的发展奠定了基础。
1.2 失稳模型
维持脊柱正常的生理曲度主要依靠体内的动力平衡系统和静力平衡系统,动、静力平衡失调是发生脊柱生理曲度变化的主要因素,并进一步导致椎间盘退变的发生[19]。因此,存在许多动物模型是通过增加椎间盘运动节段的不稳定性来促进椎间盘退变。促使椎间盘失稳的方法有许多,包括手术切除椎间盘支持组织,例如椎间关节和棘突[20,21]以及脊柱相邻节段融合等[22]。Miyamoto等[21]证明,在小鼠模型中,分离椎旁肌肉后切除棘突、棘上韧带和棘间韧带后加速了颈椎间盘的退变。实验组手术12个月后出现了椎间盘髓核疝出,纤维环紊乱被破坏,纤维环中的成纤维细胞转化为软骨细胞,椎间盘高度下降并且形成了骨赘,椎间盘发生了进一步的退变。
最近的研究表明,Bian等[7]通过切除棘突、棘上韧带和棘间韧带构建了小鼠腰椎间盘失稳模型。通过该模型探究在机械应力作用下,TGF-β活性对髓核细胞空泡的减少和细胞外蛋白聚糖增加的影响。研究发现,在失稳椎间盘中,TGF-β被激活,上调椎间盘基质蛋白质合成的结缔组织生长因子(connective tissue growth factor,CCN2)基因和聚集蛋白聚糖表达提高,髓核细胞空泡减少,这说明TGF-β在椎间盘稳态中发挥重要作用。
Phillips等[22]报道了一种模仿手术脊柱融合的兔椎间盘退变模型。术后3个月观察到纤维环紊乱破坏,术后9个月椎间盘的正常结构转变为紊乱的纤维组织、纤维环撕裂、髓核组织的软骨细胞和脊索细胞丢失和蛋白聚糖含量减少。同时也观察到,与临床症状体征相符的椎间盘高度变窄、终板硬化和骨赘形成。脊柱融合消除了目标节段的运动,但也同时诱导了相邻节段的压力改变[23,24]。因此,由于脊柱融合导致的相邻节段机械应力的改变会使椎间盘失稳,并诱导进一步的椎间盘退变。这与人椎间盘切除术中的椎间盘退变特征相一致[25]。
2 结构损伤模型
结构完整是椎间盘行使正常生理功能不可或缺的重要因素之一。椎间盘退变常伴随结构性的损伤,椎间盘结构的破坏也会导致椎间盘发生退变。为了探究椎间盘的结构损伤与退变之间的关系,研究者们针对椎间盘的髓核组织、纤维环和软骨终板的3个组成部分分别构建了结构损伤模型。
2.1 髓核与纤维环损伤模型
针对纤维环和髓核组织构建椎间盘退变模型最常见的是椎间盘穿刺模型(Fig.1C)。椎间盘穿刺模型又分为纤维环浅层穿刺模型、纤维环全深度穿刺模型和髓核切除模型。最初,在大型动物例如狗、兔、山羊和猪中成功构建了椎间盘穿刺诱导退变模型[26-35],使用刀片刺入椎间盘中造成纤维环损伤以诱导椎间盘退变。结果显示一系列椎间盘退变表型,例如纤维环放射状和同心圆形撕裂、终板硬化、髓核细胞改变及其造成的细胞外基质的改变,例如蛋白聚糖和II型胶原含量下降等[36],这些表型与人年龄相关的椎间盘退变性疾病特征相一致。
最近的研究表明,Ashinsky等[37]在兔椎间盘退变模型中进行了浅层纤维环环形刺入手术,并加速了腰椎间盘的退变。术后通过组织学方法验证兔椎间盘发生了退变,并使用例如磁共振成像、原子力显微镜和二次谐波共振成像等新兴工具,对椎间盘在退变过程中的结构和功能变化进行了严格评估和定量分析,并与非入侵性的临床相关成像参数相关联,最终确定了兔纤维环损伤模型的椎间盘退变过程中椎间盘结构和功能之间关系的时间依赖性变化,以及退变严重程度与临床影像学参数的相关性。
Gullbrand等[38]在大型动物山羊中通过全髓核切除手术构建椎间盘退变模型,并通过磁共振成像、半定量组织学分级、显微计算机断层扫描和椎间盘生物力学特性的测量来评估椎间盘的退变性改变,结果显示,该模型概括了人椎间盘退变的结构和功能特性,可用于进一步对椎间盘修复的研究。
Bonnevie等[39]通过进行兔纤维环全深度穿刺手术构建了椎间盘退变模型,并探究了椎间盘内残余应变对于椎间盘退行性变的影响,表明残余应变的改变导致异常的机械应力,并进一步促进疾病的进展。Ji等[40]使用不同直径的针构建了穿刺诱导的小鼠尾椎间盘退变模型,针刺后在29、31和32 G穿刺组的髓核组织中检测到急性炎症因子,例如白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)和肿瘤坏死因子-α(tumor necrosis factor, TNF-α)。相比之下,在18、21和23 G针穿刺组中,IL-1β,IL-6和 TNF-α的表达水平较高。在28 G针穿刺组中,检测到较低的IL-1β,IL-6 和TNF-α表达水平。综上所述,使用较大直径的针穿刺会导致严重的损伤,并引起炎症发生最终导致椎间盘退变,使用较小直径的针穿刺则会导致异常的机械应力而不引起炎症发生。这表明,结构损伤后椎间盘退变的实质是机械应力的改变或炎症的发生。
此外,伴随着椎间盘结构完整性的破坏,神经与血管会通过撕裂的纤维环入侵髓核。有报道指出,这种神经血管的侵入与椎间盘退变患者的疼痛有关[41]。Lee等[42]通过小鼠腰椎间盘穿刺手术成功构建了椎间盘退变模型,并在术后4 d至12个月的不同时间进行神经分布和巨噬细胞浸润的表征。该研究发现,在穿刺手术后纤维环发生撕裂,髓核组织丢失,同时发现了退变的椎间盘中神经分布增加,疼痛神经纤维密度上升,轴向不适的行为征兆和放射状腿痛的征兆增加。结果表明, 在椎间盘退变过程会伴随神经血管的侵入并带来疼痛。
2.2 软骨终板损伤模型
椎间盘是脊椎动物体内最大的无血管神经的器官之一,营养物质从位于椎骨中的毛细血管通过软骨终板和外层纤维环渗透到髓核组织,代谢废物按照相反的方向移动。随着椎间盘退化,营养供应的减少一定程度上限制了细胞活性和生存能力[43]。因此,通过阻断终板血供减少椎间盘营养供应的方法构建的椎间盘退变模型,可用于进一步探究营养供应与椎间盘退变的关系。
Hutton等[44]向狗腰椎间盘的上终板下方注射骨水泥,阻断血供来诱导椎间盘退变,但未观察到椎间盘发生退变。随后,Kang等[45]在未成熟动物模型中探究了注射骨水泥阻断血供与椎间盘退变的关系,他们在未成熟仔猪的椎间盘终板中注射骨水泥成功诱导了椎间盘退变的发生。这些发现表明,营养途径对于椎间盘稳态的重要性。近年来,Wei等[46-48]通过向恒河猴、猕猴和兔腰椎间盘的软骨下骨中注射化学药物,例如博来霉素和平阳霉素阻断营养供应构建了椎间盘退变模型。结果表明,通过显微计算机断层扫描引导下的向软骨下骨中注射化学药物,可形成缺血性和缓慢进行性椎间盘退变模型,这种模型可较好地模拟人椎间盘退变的发生。
3 生物化学与化学诱导模型
椎间盘在退变过程中常伴随髓核细胞与蛋白聚糖的减少,并最终导致椎间盘高度的降低。起初人们发现,木瓜凝乳蛋白酶直接注射到椎间盘中可导致髓核细胞溶解,并将木瓜凝乳蛋白酶用于椎间盘突出导致的疼痛等病症的临床治疗[49]。随后,注射木瓜凝乳蛋白酶等生物化学试剂逐步发展为构建椎间盘退变动物模型的一种传统方法[50]。Sugimura等[51]和Lu等[52]先后在恒河猴和比格犬身上使用木瓜凝乳蛋白酶与软骨素酶ABC两种不同种类的酶,成功构建了椎间盘退变模型。Hoogendoorn等[53,54]报道,通过向山羊腰椎间盘中注射软骨素酶ABC成功构建了可重复的长期椎间盘退变大动物模型。在软骨素酶ABC注射12周后,研究者们通过磁共振成像、宏观和组织学评分分析对椎间盘退变参数进行评估。结果发现,在软骨素酶ABC注射12周后椎间盘发生退行性改变,在18周后表现出严重的椎间盘退变表型。研究者们同时证明了软骨素酶ABC注射诱导椎间盘退变模型具有显著的剂量依赖性。Imai等[55]报道,通过注射软骨素酶ABC构建了兔腰椎间盘退变模型,并发现了重组人成骨蛋白对于椎间盘退变的有效治疗作用。Borem等[56]通过向椎间盘中注射软骨素酶ABC成功构建了绵羊椎间盘退变模型。
此外,Greg Anderson等[57]通过将一段纤维连接蛋白片段注射到兔椎间盘中,诱导了骨赘形成、聚集蛋白聚糖下调及髓核和纤维环的正常结构的逐渐丧失,成功构建了兔椎间盘退变模型。Mao等[58]向兔椎间盘中注射聚甲基丙烯酸甲酯后发现,椎间盘高度明显降低,椎间盘内软骨组织转变为纤维化组织,证明椎间盘内注射聚甲基丙烯酸甲酯可诱导椎间盘退变。Haro等[59]向犬椎间盘中注射重组人基质金属蛋白酶7后,发现蛋白多糖和水分含量的降低以及椎间盘高度的降低,证明重组人基质金属蛋白酶7可诱导椎间盘退变的产生。
4 基因敲除模型
近年来,随着基因工程技术的发展,基因敲除技术给动物模型构建带来了新的可能性[50]。基因敲除模型分为全局敲除模型和条件性敲除模型。在条件性敲除模型中,Cre/LoxP技术是一种重要的遗传学工具,该工具能够以细胞类型特异性和时间特异性的方式敲除基因,为探究小鼠中各种基因的作用做出了重要贡献[60]。Zheng等[61]使用R26-mTmG荧光报告基因系统,分析了6种小鼠Cre品系在椎间盘组织中的细胞特异性和靶向效率。结果表明,这6种Cre品系均能够以不同的细胞类型特异性指导椎间盘组织中的重组。其中,Aggrecan-CreERT2品系能有效地指导椎间盘中包括纤维环、髓核和软骨终板在内的所有成分的重组。
本文总结了近年来椎间盘退变相关的基因敲除模型(Table 1)。Tessier等[62]报道,张力调节增强剂结合蛋白(tonicity-responsive enhancer binding protein, TonEBP aka NFAT5)缺陷小鼠可表现出与年龄相关的椎间盘退变,并伴有纤维环撕裂和髓核疝出。该结果表明,TonEBP对于椎间盘稳态至关重要,为先前提出的该蛋白质调控细胞渗透适应性等多种功能的假说提供了体内依据。椎间盘是脊椎动物内最大的无血管神经的器官之一,且髓核组织是高度缺氧的组织。在椎间盘髓核组织内存在缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)的稳定表达。在椎间盘退变过程中,当退变的恶性循环[63,64]建立后低氧张力会激活HIF-1α表达,该表达随后会进入缺氧诱导的HIF途径[65]。Merceron等[66]报道,在小鼠脊索细胞中,条件性敲除了Hif1α导致髓核细胞大量死亡并随后完全消失。同时发现,Hif1α敲除小鼠椎间盘的生物力学特性显著降低。这与人类椎间盘退变的特征相似,表明HIF-1α对于髓核的发展和体内稳态至关重要。Che等[67]通过敲除细胞周期蛋白依赖性激酶抑制剂2A(cyclin dependent kinase inhibitor 2A,Cdkn2a)基因探究细胞周期调节因子p16在椎间盘退变中的功能,发现在Cdkn2a基因敲除小鼠中p16缺失在较大程度上减弱了腰椎间盘高度的降低和基质蛋白质表达的减少。同时,p16缺失降低了炎症因子的蛋白质和mRNA水平。表明p16在椎间盘退变中发挥重要作用,p16是椎间盘退变防治的可能靶标之一。Tessier等[68]报道,在小鼠脊索细胞中条件性敲除肌动蛋白相关蛋白2/3复合体亚基2(actin related protein 2/3 complex subunit 2,Arpc2)基因后发现,Arpc2缺失小鼠表现出髓核组织高度纤维化和纤维环撕裂,表明Arpc2对于椎间盘的发育和稳态至关重要。Tang等[69]报道,诱导核因子(nuclear factor(erythroid-derived-2)-like 2,Nrf2)基因敲除小鼠产生椎间盘退变后自噬基因的表达降低,并证明了Nrf2基因敲除加重了椎间盘退变的症状。
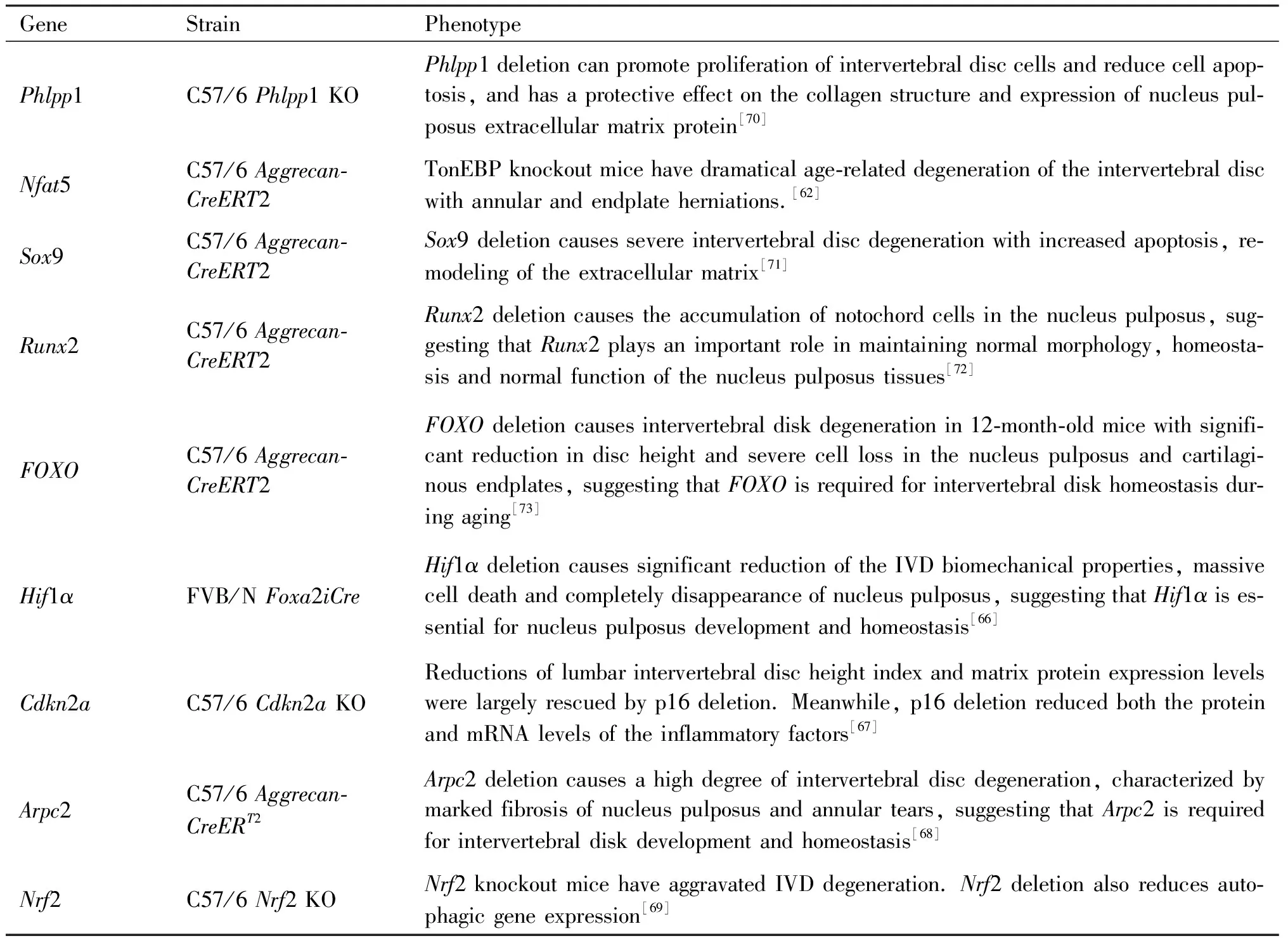
Table 1 Gene knockout models
5 问题与展望
椎间盘退变是下腰痛的主要原因。为了更好的探究椎间盘退变的机制,研究者构建了许多动物模型去模拟椎间盘退变。在文献中,生物力学和生物化学被认为是互相联系的椎间盘退变的主要诱发原因。在椎间盘退变过程中,生物化学受到的生物力学的影响贯穿椎间盘退变的始终,并造成级联反应,即机械应力过载、细胞合成分解代谢紊乱和细胞外基质重塑的恶性循环[63]。在该退变过程中存在机械应力、结构损伤、基因表达和血供受限等多种影响因素。因此,在该恶性循环中,以不同影响因素构建的椎间盘退变动物模型可最终导致相似的椎间盘退变症状,并具有了相当的可比性。本文结合当下的研究热点,总结了用不同影响因素构建的椎间盘退变动物模型,旨在为椎间盘退变的机制研究及治疗策略的改进提供理论基础。
不同影响因素导致的椎间盘退变有着异同点。机械应力模型是通过应用异常机械负荷来诱导椎间盘退变,其目的是模拟人体在过度负荷下椎间盘的退行性变化; 而结构损伤模型是模拟在椎间盘损伤情况下诱导的椎间盘退变。化学诱导模型则是通过注射化学试剂来模拟椎间盘退变过程中的细胞合成分解代谢紊乱,以探究椎间盘退变的生物化学变化机制。基因敲除模型则聚焦于在椎间盘退变过程中发挥重要作用的分子,在单一分子水平上探究椎间盘退变机制,并为椎间盘退变的靶向治疗带来新的可能性。
椎间盘退变是一个复杂的且尚未被完全阐明的多因素的过程,因此很难构建一个完整复制椎间盘退变性疾病过程的模型,目前已有的动物模型中仍有一定的局限性。1)除了山羊和绵羊之外,许多椎间盘退变模型的物种中都有脊索细胞存在到成年,而脊索细胞在人类幼时即成熟并消失,这使得许多模型与人类椎间盘退变存在本质上的区别[64,74]。2)椎间盘的大小也是椎间盘退变过程中的重要影响因素。椎间盘依靠扩散吸收营养并排除代谢废物,体积小的椎间盘或许会减少营养供给的挑战。人类的椎间盘比常见动物模型要大得多,这可能会加速人类的退化级联反应。而研究人员通过比较椎间盘比例(例如椎间盘高度、宽度、髓核大小)来分析常用动物椎间盘模型的几何形状与人类椎间盘的相似度。研究结果表明,小鼠腰椎间盘是在几何上与人类腰椎间盘最相似的动物模型[75,76]。3)针刺模型与注射模型中针的直径影响椎间盘退变模型构建的成功率,在不同动物中如何选择合适的针径对于模型构建至关重要。研究人员们针对这一问题进行了详尽的研究,为针径的选择提供了建议[77,78]。4)自发性模型由于建模周期长、变量大和效率低下等缺陷而使用受限。
总之,虽然现有的椎间盘退变模型有一定的局限性,但我们可以利用不同的模型来确立动物椎间盘退变模型和人椎间盘退变之间的相关性和可比性。在未来的研究中,对现有的动物模型进行进一步的改进与创新,将会为我们进一步探究椎间盘退变的机制及治疗策略的改进奠定更坚实的基础。

