谷胱甘肽还原酶在乙型肝炎病毒感染者肝损伤中的意义
黄琪
(监利市第二人民医院检验科,湖北 监利 433325)
乙型肝炎病毒(Hepatitis B virus, HBV)感染全球约有2.57 亿慢性HBV 感染者[1]。 中国慢性HBV感染者约7000 万例, 其中慢性乙型病毒性肝炎(Chronic Hepatitis B, CHB)患者约为2 000~3 000万例[2]。
目前研究表明,在CHB 患者体内,氧化损伤和抗氧化损伤的失衡状态在病毒性肝炎发展为肝细胞癌的过程中起重要作用[3]。 谷胱甘肽还原酶(gluathione reductase,GR) 是人体氧化还原体系中最为重要的酶之一, 是维持细胞中还原型谷胱甘肽含量的主要黄素酶。在NADPH 参与下,GR 可将氧化型谷胱甘肽转化为还原型谷胱甘肽。 还原型谷胱甘肽对防止血红蛋白的氧化分解、 维持巯基蛋白的活性、 保证巯基蛋白的还原性及细胞的完整性具有重要的作用[4]。
近年来,GR 在CHB 患者中的检测意义逐渐受到重视,被认为是肝功能检测的重要补充检测指标之一。 然而,GR 在病毒性肝炎或在动物肝损伤模型中的变化趋势存在争议[5-8]。
本研究调查血清GR 活性在表面健康人群与HBV 感染疾病中的分布差异, 以及与传统的肝功能指标的关联性及差异性, 为临床应用GR 评估HBV 感染性肝损伤提供依据。
1 资料与方法
1.1 一般资料 回顾性分析2019 年8 月至2019年12 月湖北省监利市第二人民医院消化科和感染科因HBV 感染就诊的肝脏疾病患者139 例(CHB 患者112 例,肝硬化患者12 例,肝细胞癌患者15 例),其中男性95 例,女性44 例,年龄范围19 岁~76 岁。 另外,选取本院体检中心表观健康体检者56 例,其中男性30 例,女性26 例,年龄范围20~60 岁。
健康人群的入选标准:(1)年龄≥18 岁;(2)HBV 血清学标志物全部阴性或仅HBsAb 阳性,丙型肝炎病毒血清抗体阴性;(3)传统的肝功能检测指标在正常范围内:天门冬氨酸氨基转移酶(AST)男性≤40 U/L,女性≤32 U/L; 谷丙转氨酶(ALT)男性≤41 U/L, 女性≤33 U/L; 总胆红素 (TBIL)男性≤26 mmol/L, 女性≤21 mmol/L; 直接胆红素(DBIL)≤8 mmol/L; 碱性磷酸酶(ALP) 男性10~71 U/L,女性6~42 U/L;γ-谷氨酰转肽酶(γ-GT) 男性10~71 U/L,女性6~42 U/L。 健康人群排除标准:有重大器质性病变者,肿瘤史,肝移植病史,口服药物者。 HBV 感染肝脏疾病患者入选标准:(1)年龄≥18 岁;(2)乙型肝炎病毒表面抗原HBsAg 阳性,丙型肝炎病毒血清抗体阴性。(3)进行HBV 核酸检测。 HBV 感染肝脏疾病排除标准: 肝功能衰竭、合并肝脏以外的疾病,肝移植病史。
1.2 仪器与试剂 GR 试剂盒 (江西乐成生物有限公司,紫外线酶法),参考区间33~73 U/L,检测仪器为贝克曼AU5800 全自动生化分析仪。 AST、ALT、TBIL、DBIL、ALP、γ-GT 采用贝克曼原装配套试剂。 乙型肝炎病毒五项及抗丙型肝炎病毒抗体采用雅培全自动免疫分析仪Architect i200sr 及其原装配套试剂。HBV-DNA 检测采用杭州安誉科技有限公司生产的AGS8830 实时荧光定量PCR 仪检测,检测下限为100 copies/mL。
1.3 方法 入选者静脉血4~6 mL 各3 管,1912×g离心10 min 分离血清。 若3 h 内来不及检测则冻存于-80 ℃度直至检测。 收集患者一般临床资料。
1.4 统计学处理 统计采用SPSS 16.0 软件。 Kolmogorov-Smirnov 检验对数据进行正态性检验。 呈偏态分布计量数据用中位数(四分位间距)表示,两组间比较采用Mann-Whitney U 检验。 相关性采用Spearman 秩相关分析。 P<0.05 为差异有统计学意义。
2 结果
2.1 乙型肝炎病毒感染肝病各组与对照组肝功能测定结果的比较 对分析人群的肝功能检测指标及年龄进行正态性检验,只有年龄呈正态分布(年龄,P=0.163), 肝功能各指标(GR,ALT、AST、ALP、GGT、TBil、DBIL)都呈偏态分布,故所有数据都采用中位数(四分位间距)表示,分析方法采用非参数检验。
对于本实验的健康人和各疾病组, 年龄构成有显著性差异(P<0.05)。对于传统的生化指标,AST、ALT 和γ-GT 随乙型肝炎病毒感染后肝脏疾病进展而升高,肝癌组显著高于肝硬化组,肝硬化组高于慢性乙型肝炎组; 慢性乙型肝炎组显著高于健康人;TBIL,DBIL 和ALP 在疾病组都分别显著高于健康对照, 肝硬化组和肝癌组都分别显著高于慢性乙型肝炎组, 但是在肝硬化和肝癌组间没有显著性差异;GR 在慢性肝炎组59.4(54.7~67.3)U/L显著高于健康对照组52.5 (47.7~55.2)U/L (P <0.001),肝硬化组73.1(57.3~96.7)U/L 显著高于慢性肝炎组(P<0.001),然而在肝癌组,GR 的浓度水平26.5 (14.2~47.9)U/L 显著低于其他三组(P 值分别都小于0.001)。 见表1。
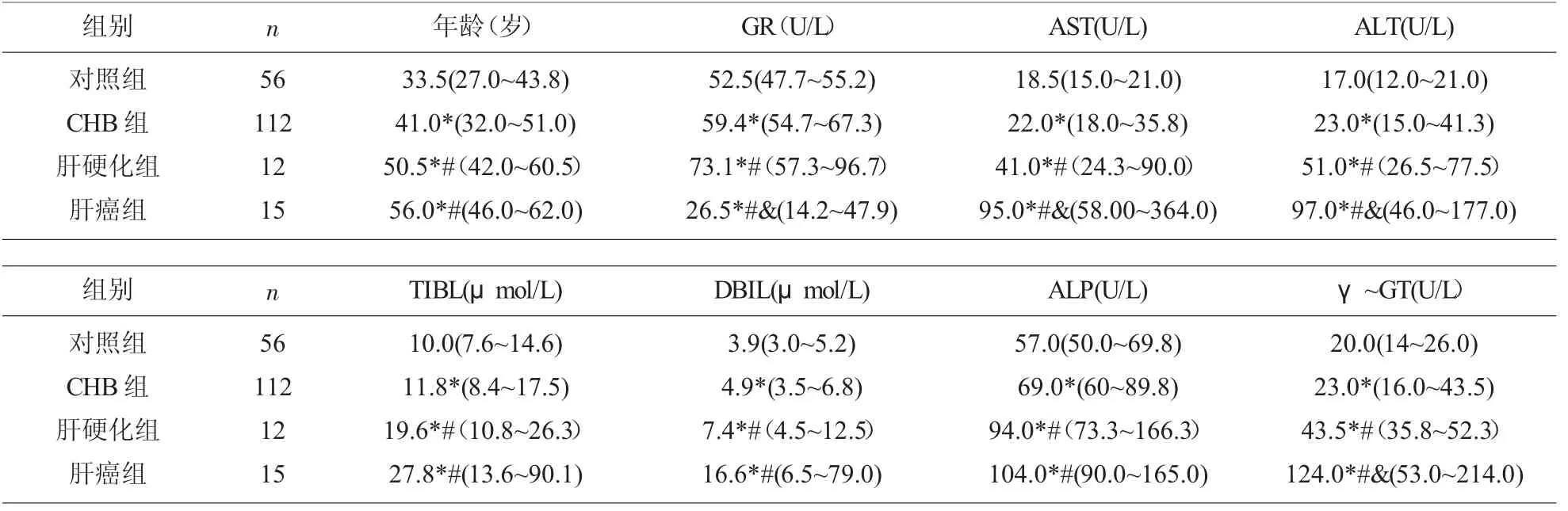
表1 慢性乙型病毒性肝炎患者与对照组肝功能测定结果的比较
2.2 GR 在慢性乙型病毒性肝炎各亚组中的比较由于肝硬化组和肝癌组样本例数太少,并且GR 的变化规律与其他指标不同, 现只对CHB 组做进一步分析。 按不同的标准将CHB 患者分成不同的亚组。
在CHB 患者中, 当其他肝功能检测指标都正常时,GR 显著高于健康对照,并且GR 有6 例超过参考区间上限,阳性率为8.2%(6/73)。 但是,与其他肝功能检测指标都正常的组相比,GR 在其他肝功能指标任一阳性组中,没有显著性变化。
将CHB 患者按照HBeAg 阳性或者阴性分组,除TBIL 外,其他各指标在这两个亚组中都分别显著高于健康对照组。 然而,只有ALP 在HBeAg 阳性的CHB 分组中高于HBeAg 阴性的分组。
将CHB 患者按照HBV-DNA 阳性或者阴性分组,各检测指标在DNA 阳性的分组中都显著高于健康对照组,而在DNA 阴性的分组中,只有GR,AST,ALP 显著高于健康对照组, 并且GR 在DNA阳性组中显著高于DNA 阴性组。 见表2。
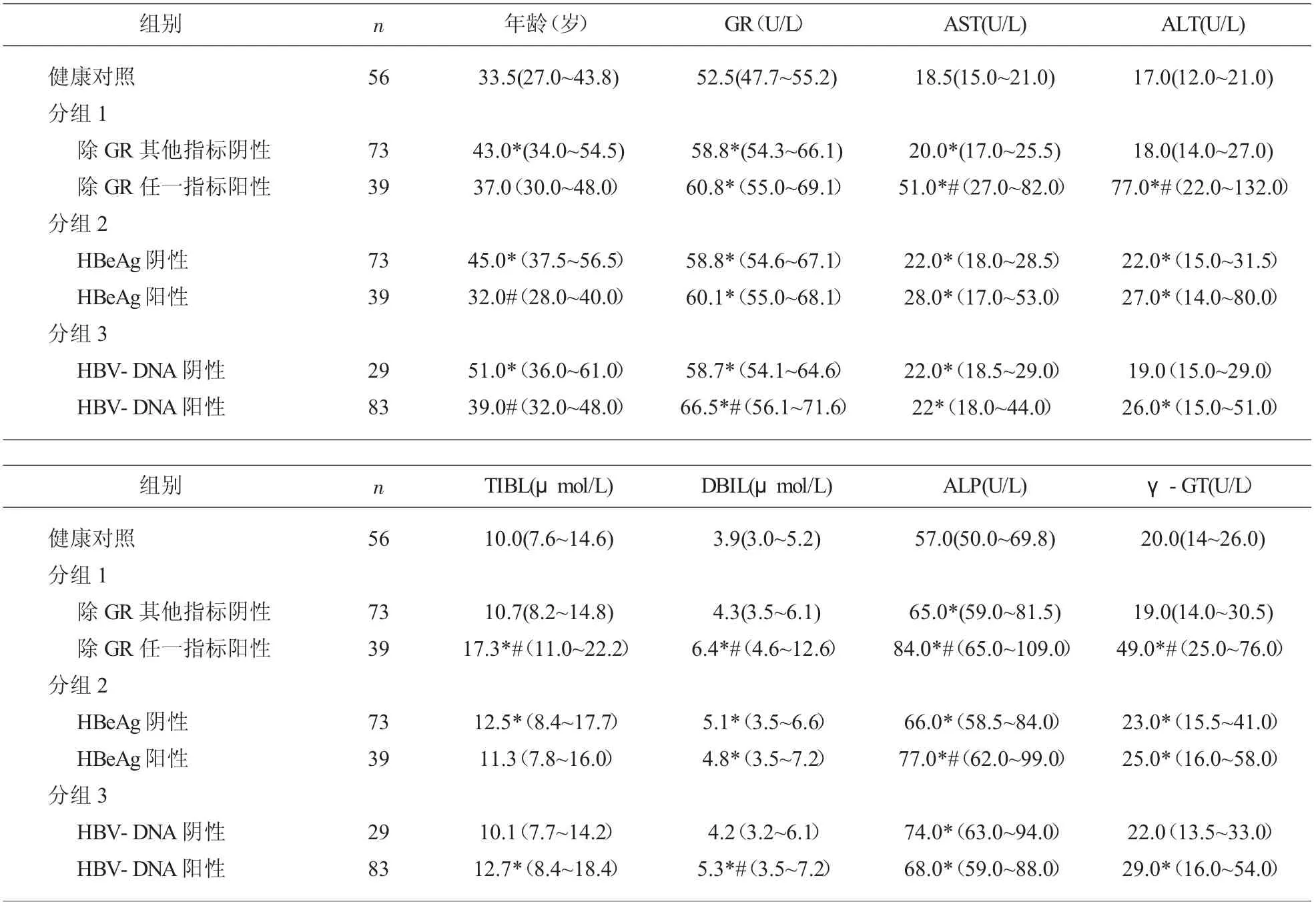
表2 慢性乙型病毒性肝炎患者各亚组肝功能检测指标比较
2.3 在慢性乙型病毒性肝炎GR 和其他指标的相关性 Spearman 相关性分析结果显示, 在CHB 患者中, 除DBIL 外,GR 与其他常规肝功能的指标(ALT、AST、TBIL、ALP、GGT)以及DNA 的含量(经lg 转换)呈显著的正相关关系。 见表3

表3 谷胱甘肽还原酶与其他指标相关性
3 讨论
肝细胞线粒体、 肝脏枯否细胞和炎症细胞都可产生活性氧(Reactive oxygen species, ROS)和自由基, 此外,肝脏亦能通过合成蛋白质的方式发挥抗氧化作用。 在乙型肝炎的发病机制中,存在广泛的氧化应激反应,这种氧化过程发生在各个层次,包括脂质、DNA 和蛋白质等[3]。 谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和GR 是谷胱甘肽(Glutathione,GSH)抗氧化系统的重要组成,可以清除ROS,修复氧化损伤[4]。 在本研究中,GR 在乙型病毒性肝炎中升高, 且早于传统肝酶谱及胆红素,在乙型病毒肝炎肝硬化的患者中进一步升高,在乙型肝炎病毒感染的肝癌中降低。 在已有的文献中,GR 在乙型肝炎病毒感染肝损伤中的变化规律不尽相同。 李淑丽等的研究表明,慢性乙型病毒性肝炎患者中,GR 水平升高[7],范玉琛等的研究表明,GR 在CHB 患者中降低[8]。 对于CHB 患者,本研究的结果与李淑丽等人[7]研究结果一致。 通过对传统肝功能检测指标的统计, 可得出本研究入选的CHB 患者,处于轻度肝功能不全的状态,本研究与李淑丽等[7]的研究入选人群转氨酶等肝功能指标远低于范玉琛等的研究[8]。 可能的机制是,在正常情况下,肝脏维持体内ROS 和抗氧化剂的平衡。当HBV 病毒感染人体后, 通过HBx 蛋白,HBsAg和HBcAg 等蛋白质触发机体产生氧化应激[9-11],机体通过增加GR 水平,将氧化型的谷胱甘肽还原为谷胱甘肽循环利用以改善体内有害环境[12]。 因此,GR 升高早于传统肝酶谱和胆红素的变化。 但是,当肝脏被连续的氧化损伤,ROS 的损害进一步增加,导致炎症和纤维化、再生结节和肝功能丧失[13-14]。 并且,当肝损伤进一步增加时,产生的ROS 过多,GR 代偿性增加低于消耗的量,从而导致GR 降低。 而对于肝癌患者,可能是在癌细胞中,GSH 微循环系统紊乱,导致GR 无法代偿性增加。然而,本研究中肝癌患者数量较少, 需要进一步扩大样本量验证该结论。
在本研究中,GR 与HBeAg 的阴阳性无关,而与HBV-DNA 的阴阳性有关,进一步分析表明,GR与HBV-DNA 呈正相关的关系(r=0.396,P<0.001),提示随着病毒载量的增加,氧化损伤进一步增加[15]。这一研究结果与Tianlu Zhou 等的研究[16]一致。 GR和HBV-DNA 的关系表明,GR 可能作为乙型肝炎病毒抗病毒监测的检测指标之一。
本研究存在一定局限性:(1)本研究统计结果表明GR 和年龄存在正相关的关系。本研究的对照组没有做到年龄性别相匹配。 (2)本研究肝硬化和肝癌的例数较少,有待扩大样本量进行验证。
4 结论
GR 在乙型肝炎病毒感染患者早期肝损伤中即可升高, 可作为传统肝功能检验指标的重要补充, 亦可作为乙型肝炎病毒抗病毒治疗是否有效的监测指标。

