上皮细胞黏附分子增强细胞间紧密连接促进乳腺癌细胞耐药
牛亚楠, 高 宇, 何倚帆, 李克敏, 李瑞涵, 张文龙, 张轩萍, 师锐赞*
(1)山西医科大学基础医学院药理教研室,山西 榆次 030000;2)山西医科大学第一临床医学院, 太原 030001)
乳腺癌是严重危害女性健康的恶性肿瘤,多药耐药(multidrug resistance,MDR)是导致其化疗失败、复发和预后差的重要原因。其耐药机制复杂多样,与之紧密相关的是ATP结合盒(ATP-binding cassette, ABC)转运蛋白超家族[1,2]。其中,ABCG2(ATP-binding cassette G2)作为一种典型的ABC转运蛋白质,通过外排多种化疗药物介导多种肿瘤(包括乳腺癌)的多药耐药[3-5]。但目前国内外对ABCG2的调控机制有待深入研究,且缺少能有效应用于临床的抑制剂。因此,探究ABCG2介导的多药耐药的分子机制对改善乳腺癌化疗耐药有重要意义。
上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)与细胞黏附、迁移和增殖等功能均相关,在多种恶性上皮肿瘤中异常表达。EpCAM已被证实与乳腺癌的转移、预后和耐药相关[6],但其在ABCG2介导的乳腺癌耐药中的机制尚未阐明。细胞间紧密连接与肿瘤的多细胞耐药表型有关[7],密封蛋白(claudins)家族是组成细胞间紧密连接结构的关键蛋白质,EpCAM与密封蛋白家族(特别是claudin-7和claudin-1)相互作用,调节人结肠癌细胞的紧密连接,促进肿瘤进展和耐药[8,9]。MCF-7/MX细胞是米托蒽醌 (mitoxantrone, MX)诱导筛选的、仅高表达ABCG2的耐药株[10]。本研究选用人乳腺癌敏感株MCF-7和耐药株MCF-7/MX,探究EpCAM在ABCG2介导的乳腺癌中的耐药作用,以及是否通过经典的紧密连接蛋白密封蛋白1影响细胞间紧密连接进而影响耐药。
1 材料与方法
1.1 材料
1.1.1 细胞株 人乳腺癌米托蒽醌敏感株MCF-7和耐药株MCF-7/MX均由美国国家癌症研究所Cowan博士馈赠。
1.1.2 试剂 米托蒽醌 (mitoxantrone,MX,Sigma);RPMI-1640培养基(HyClone);胎牛血清(Cellmax);ABCG2单抗、EpCAM多抗、β-肌动蛋白(β-actin)单抗、FITC-羊抗小鼠IgG、CY3-羊抗兔IgG 等均购自武汉Boster;密封蛋白1多抗(ABclonal);EpCAM单抗(湖北Servicebio);脂质体转染试剂盒(美国Invitrogen);CCK8检测试剂盒(Cell Counting Kit-8)、DAPI染色液、BCA蛋白质定量试剂盒、抗荧光衰减封片剂等均购于Boster;ECL底物化学发光检测试剂盒(美国Bio-Rad);辣根酶标记山羊抗小鼠/兔 IgG(北京中杉金桥);siRNA序列设计及合成(Public Protein/Plasmid Library,PPL0038-3a/b/c),靶向干扰引物序列见Table 1。
1.2 方法
1.2.1 细胞培养 MCF-7和米托蒽醌耐药株MCF-7/MX培养于RMPI-1640完全培养基(10% FBS),放置于37 ℃、5% CO2细胞培养箱。为维持多药耐药表型,MCF-7/MX细胞在添加400 ng/mL MX的培养基中培养,于实验前2周转移到无药物培养基中。
1.2.2 siRNA转染 将生长状态良好的MCF-7/MX细胞稀释为1×105个/ mL,接种至6孔板,2.5 mL/孔,轻摇使细胞均匀分布,汇合度在75%左右,用LipofectamineTMDNA/ RNA 试剂盒转染siRNAEpCAM 和阴性对照siNC,待72 h后用Western印迹法鉴定干扰效果。
1.2.3 细胞形态学变化 将长势良好的各转染细胞接种在6孔板中,并在37 ℃,5% CO2细胞培养箱中培养过夜。观察细胞形态并记录100倍镜下图像。
1.2.4 细胞毒性分析 取对数生长期细胞,分别以90 μL/孔细胞悬液(含1.5×103个细胞)接种于96 孔板孔内(空白对照中只加培养基),培养24 h,每孔加10 μL不同浓度米托蒽醌 (mitoxantrone,MX)(阴性和空白对照组加入等量生理盐水),每组设6个复孔。继续培养70 h,每孔加 10 μL CCK8溶液。37 ℃避光孵育2 h,用酶标仪测波长450 nm的A值,将各测试孔A值减去空白A值,细胞存活率% = (A加药组-A空白组) /(A对照组-A空白组) × 100%。根据不同浓度的MX存活率绘制生存曲线,用GraphPad Prism 8.0软件计算IC50值。耐药倍数(resistant fold)=IC50(耐药株) /IC50(敏感株) 。
1.2.5 免疫荧光染色法 将2×105个细胞接种于6孔板中的圆玻片上培养过夜。4%多聚甲醛固定,Triton X-100通透15 min。用山羊血清37 ℃封闭1 h,细胞与按比例稀释的一抗在4℃孵育过夜。PBS冲洗5次,在37 ℃,避光环境下用荧光二抗 (1∶100 稀释)孵育1 h。用PBS代替一抗作为阴性对照。用DAPI (1 μg/mL)染色细胞核,抗荧光衰减封片剂封片,在荧光显微镜下观察、拍照(FV1000;奥林匹斯,中心谷,宾夕法尼亚州)。荧光双染时,将2种不同种属一抗混合稀释,使抗体终浓度为每种抗体的工作浓度,再用相应种属荧光二抗标记(FITC标记山羊抗小鼠IgG和CY3标记山羊抗兔IgG)。
1.2.6 Western 印迹法 收集各组细胞,按照RIPA∶蛋白酶抑制剂∶磷酸酶抑制剂=100∶1∶1比例配制裂解试剂,裂解离心细胞后提取上清液,BCA法测定总蛋白质浓度,调整蛋白质浓度后加上样缓冲液混合煮沸5 min使蛋白质变性,保存于-80 ℃。进行SDS-PAGE,蛋白质上样量为35 μg/孔,半干转和湿转法转膜,室温缓慢封闭1.5 h,放入按比例稀释的一抗中4 ℃孵育16 h,二抗室温孵育1.5 h,用ECL化学发光显影凝胶成像,Image J 软件分析各条带灰度值,以β-肌动蛋白为内参进行量化分析。
1.2.7 统计学方法 用SPSS 30.0以及GraphPad Prism 8.0软件进行统计学处理,数据均采用均数±标准差(mean ±SD)表示。实验重复3次以上。两样本间比较采用t检验、多组间比较釆用单因素方差分析(One-way ANOVA)或双因素方差分析(Two-way ANOVA)进行显著性检验。P< 0.05时认定差异有统计学意义。
2 结果
2.1 上皮细胞黏附分子在ABCG2高表达的乳腺癌耐药株上调
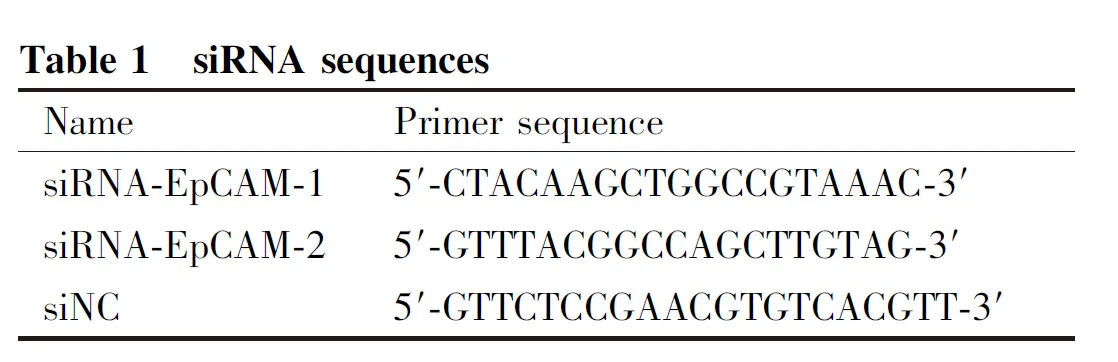
CCK8结果显示,经梯度浓度的MX处理,乳腺癌米托蒽醌耐药株MCF-7/MX细胞在各浓度米托蒽醌处理后细胞存活率显著高于其敏感株MCF-7细胞(Fig. 1A)。同时,相对于敏感株MCF-7细胞,MCF-7/MX细胞的ABCG2表达增加,EpCAM的表达同步上调(P< 0.01)(Fig. 1B,C)。耐药株MCF-7/MX细胞的IC50值显著高于MCF-7细胞(P< 0.01),耐药倍数为11.2倍(Table 2)。

2.2 敲低上皮细胞黏附分子增加MCF-7/MX细胞对MX的敏感性
siRNA法靶向干扰MCF-7/MX细胞的EpCAM,并用Western 印迹法鉴定干扰效果。结果显示,与(MCF-7/MX)空白对照相比,阴性对照(siNC)组EpCAM的表达无明显变化,而敲低组siEpCAM-1和-2中分别降低 24.4%(P< 0.05)和 49.0%(P< 0.001),ABCG2的表达同步下调(Fig. 2A, B)。CCK8结果显示,siNC组细胞对MX药物敏感性未发生明显变化,敲低组siEpCAM-1和siEpCAM-2对MX的敏感性显著增强(Fig. 2C)。
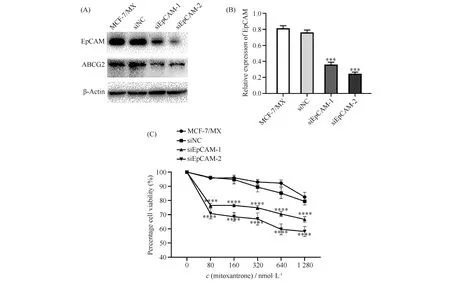
Fig.2 Effects of EpCAM interference and its effect on resistance to MCF-7/MX cells (A, B) The efficiencies of EpCAM inhibition were examined by Western blotting. (Mean ± SD, n = 6),***P < 0.001, vs MCF-7 cells.****P < 0.0001, vs MCF-7 cells. (C) NX cytotoxicity was evaluated by CCK8 assays and expressed as percentage of cell viability. (Mean ± SD, n = 6),****P < 0.0001, vs MCF-7/MX cells
2.3 敲低上皮细胞黏附分子抑制MCF-7/MX细胞间紧密连接
敏感株MCF-7多呈单细胞存在,细胞间连接不紧密,而耐药株MCF-7/MX多聚集成团,细胞间隙明显减小,细胞间连接紧密。相较于MC-7/MX细胞,siNC组细胞间连接变化不明显,多数仍聚集成团,而EpCAM敲低组细胞间连接明显减弱或缺失(Fig. 3)。
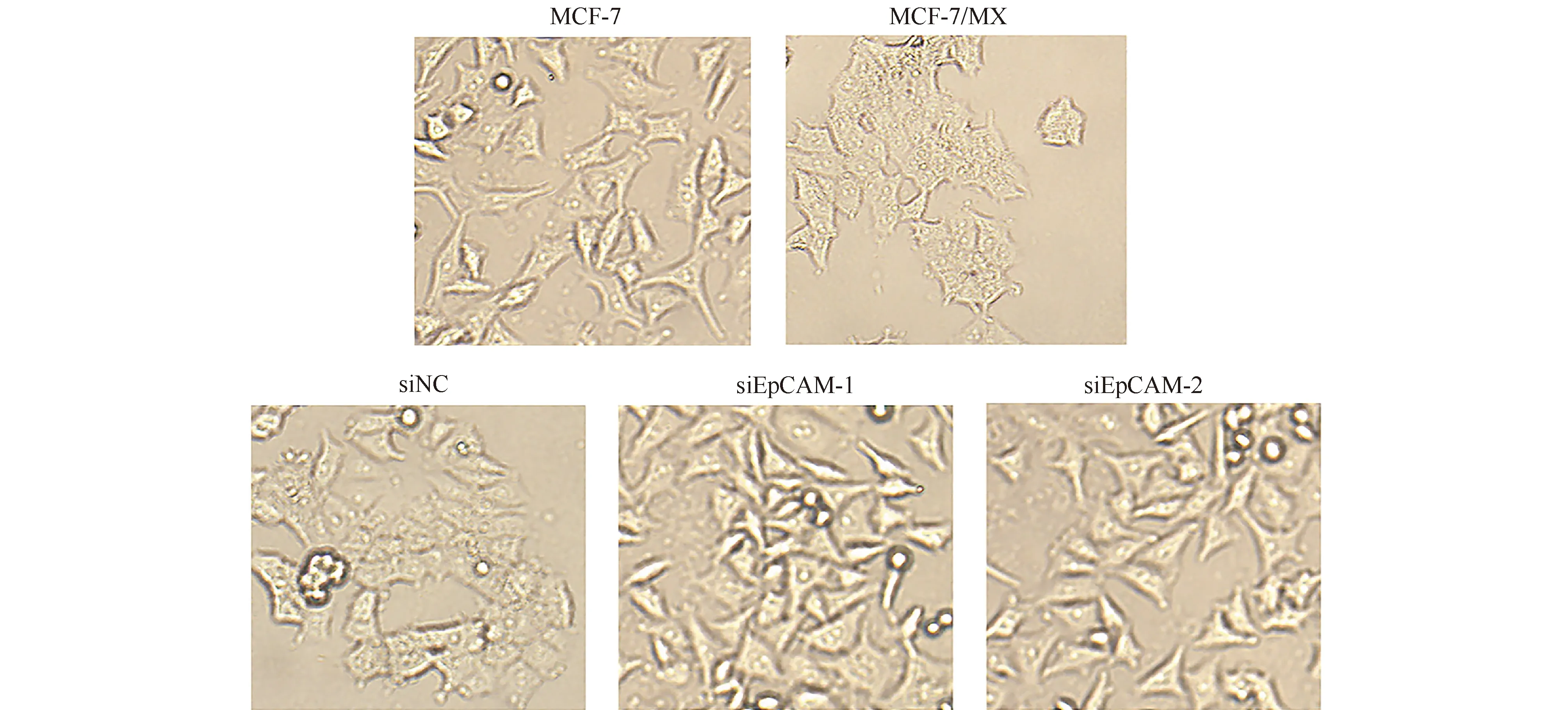
Fig.3 Morphological changes in MCF-7/MX cells by EpCAM knockdown Effects of EpCAM down-regulation on the morphology of MCF-7/MX cells via microscopical observation. Representative cell morphologic images of MCF-7, MCF-7/MX, EpCAM-silenced MCF-7/MX cells and control cells photographed by inverted microscope (200×)
2.4 上皮细胞黏附分子与密封蛋白1在MCF-7/MX细胞中共定位
双重免疫荧光染色结果显示,EpCAM免疫荧光阳性为绿色荧光,细胞紧密连接的密封蛋白 1免疫荧光阳性呈红色荧光。将同细胞中二者荧光融合时呈黄色,在MCF-7/MX细胞胞浆有共定位现象(Fig. 4)。
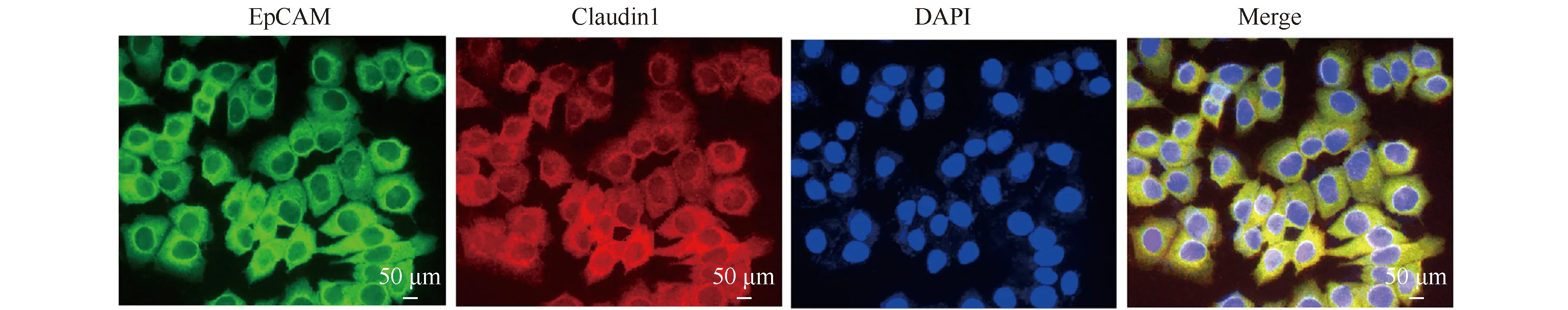
Fig.4 Colocalization of EpCAM and claudin 1 in MCF-7/MX cells Colocalization of claudin 1 and EpCAM in MCF-7/MX cells was visualized by immunofluorescence. Scale bar = 50 μm
2.5 敲低上皮细胞黏附分子减少MCF-7/MX的密封蛋白1表达
免疫荧光结果显示,密封蛋白1主要分布在2种细胞的胞浆,相对于MCF-7细胞,MCF-7/MX细胞的密封蛋白1的荧光强度明显增强(Fig. 5A)。敲低EpCAM的MCF-7/MX细胞荧光强度减弱(Fig. 5B)。Western 印迹结果表明,相对于MCF-7/MX细胞,siNC组细胞的密封蛋白 1表达变化不明显,而siEpCAM组密封蛋白1表达下调(P< 0.0001)(Fig. 5C,D)。
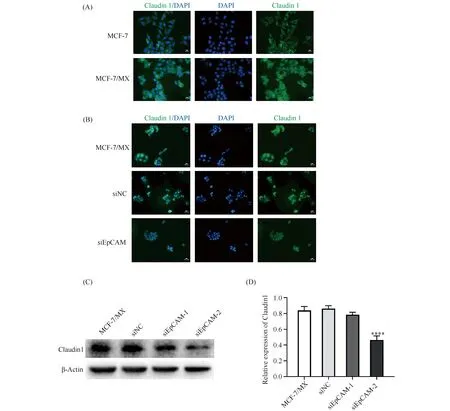
Fig.5 Effects on claudin 1 in MCF-7/MX cells by EpCAM knockdown (A) Immunofluorescence of claudin 1 localization in MCF-7 and MCF-7/MX cells (400×) (scale bar indicates 50 μm). (B) Immunofluorescence of claudin 1 localization in MCF-7/MX and EpCAM-silenced MCF-7/MX cells (200×) (scale bar indicates 100 μm). (C, D) The protein levels of claudin 1 were determined in MCF-7/MX and MCF-7/MX-siEpCAM cells using Western blotting assays. (Mean ± SD, n = 6),****P < 0.0001 vs MCF-7/MX
3 讨论
ABCG2主要通过多个底物结合位点特异性地泵出肿瘤细胞内多种化疗药物和新型靶向分子药物,在肿瘤细胞的多药耐药中发挥重要介导作用,是典型的多药耐药转运蛋白质[11]。肿瘤干细胞是肿瘤转移、耐药和复发的根本原因,ABCG2已被证实为肿瘤干细胞标记物之一[12]。ABCG2严重影响乳腺癌患者的化疗效果,并导致预后不良。因此,深入研究ABCG2介导的多药耐药的分子机制,并探寻其逆转策略是防治耐药乳腺癌和抑制肿瘤干细胞的焦点。
EpCAM被证实与多种肿瘤的转移、黏附、耐药和干性相关,是防治转移和耐药等恶性肿瘤的新型分子靶点。EpCAM在乳腺癌、结直肠癌等多种肿瘤中均有过表达,在肝癌中作为干细胞标志物[13,14],食管癌细胞被诱导耐药过程中EpCAM同步上调,敲低则增加其化疗敏感性[15]。在乳腺癌中,EpCAM高表达被证实其与转移、不良预后均相关[16,17]。本研究证实,EpCAM在ABCG2高表达的乳腺癌耐药株MCF-7/MX细胞中上调,敲低EpCAM则逆转细胞耐药性,ABCG2的表达随之下调,证明EpCAM可促进ABCG2介导的乳腺癌细胞耐药。
细胞间紧密连接是上皮和内皮细胞间的重要屏障结构,紧密连接或紧密连接蛋白质是影响癌症进展的众多关键因素之一,也是体内实体瘤群集耐药的重要结构基础。Claudins家族是细胞间维持紧密连接结构的主要跨膜蛋白质。研究证实,EpCAM能与一些Claudins蛋白相互作用影响紧密连接[18,19]。本研究表明,相较于MCF-7敏感株,ABCG2高表达的MCF-7/MX耐药株紧密连接明显增强,敲低EpCAM明显削弱MCF-7/MX细胞的紧密连接。
经典的紧密连接蛋白质密封蛋白 1在一些乳腺癌细胞系(例如MCF-7)中表现出抗凋亡和促肿瘤作用,可通过激活上皮间质转化过程促进乳腺癌细胞迁移和侵袭,还能增加三阴性乳腺癌细胞系的细胞间黏附[20,21]。有研究报道,EpCAM能增强密封蛋白 1的稳定性,促进乳腺癌的进展[22]。本研究显示,密封蛋白1在EpCAM上调的MCF-7/MX中的表达明显高于MCF-7,且EpCAM与密封蛋白 1共定位于MCF-7/MX细胞浆,表明EpCAM与密封蛋白1可能有相互作用。后续实验发现,敲低EpCAM能明显减少密封蛋白1的表达,进一步证实EpCAM可以由密封蛋白1介导增强MCF-7/MX细胞间紧密连接,进而增强耐药性。鉴于密封蛋白1的功能复杂性,EpCAM与密封蛋白1间具体的相互作用机制有待深入研究。
综上所述,本研究证实,EpCAM可以通过与密封蛋白1相互作用增强细胞间紧密连接,从而促进ABCG2介导的乳腺癌细胞耐药,是防治耐药乳腺癌的关键分子靶点。本研究从分子水平探寻ABCG2介导乳腺癌耐药的机制及相关蛋白质分子,对临床上有效防治乳腺癌具有重要的理论和临床意义。

