LncRNA MIAT靶向调节miR-128-3p对心房颤动大鼠心室重构和心肌纤维化的影响
邢佳侬,梁卓,邢爱君,刘俊兰,彭宏超,张天桦,张春来
心房颤动(atrial fibrillation,AF)为常见心律失常症状,易引发心力衰竭、肾功能损伤、动脉栓塞等并发症,严重威胁患者生命健康[1-2]。心肌纤维化导致的心室重构是AF的主要病理特征,多种炎性因子诱导并放大的炎症反应与其关系密切,抑制炎症反应可降低AF发生风险,减轻心肌纤维化与心室重构[3-4]。心肌梗死相关转录本(myocardial infarction associate transcript,MIAT)是一种保守的长链非编码RNA(long non-coding RNA,lncRNA),在心肌梗死、AF等心血管疾病的发病及进展过程中起到关键调控作用;降低MIAT的表达可显著减轻炎症反应,延缓心肌纤维化、心肌肥厚等病理改变,改善心力衰竭症状[5-6]。研究显示,LncRNA MIAT在AF大鼠中表达显著增加,下调MIAT能显著缓解AF,减轻其诱导的心肌细胞凋亡和心肌纤维化[7]。miR-128-3p是MIAT的一个下游调控因子,其表达水平与MIAT呈负相关[8]。miR-128-3p作为一种重要的炎症调控因子,与AF的发生、发展过程关系密切。过表达miR-128-3p可明显抑制脂多糖诱导的炎症反应[9],还可降低转化生长因子-β1(transforming growth factor-β1,TGF-β1)水平,进而抑制AF小鼠心房心肌组织纤维化进程[10]。由此可知,miR-128-3p是治疗AF的一个重要作用靶点。目前,LncRNA MIAT可否通过靶向调节miR-128-3p表达,从而影响AF大鼠心室重构和心肌纤维化尚鲜见报道。本研究通过建立AF大鼠模型,探究LncRNA MIAT靶向调节miR-128-3p对AF大鼠心室重构和心肌纤维化的影响。
1 材料与方法
1.1 材料 SD雄性大鼠75只购自郑州市惠济区华兴实验动物养殖场[SCXK(豫)2019-0002],无特定病原体(specific pathogen free,SPF)级,6~7周龄,体质量200~230 g。无水氯化钙(货号C7250)、乙酰胆碱(货号G8320)、天狼星红染色试剂盒(货号G3632)购自北京索莱宝科技有限公司;白细胞介素(interleukin,IL)-6测试盒(H007)、IL-18测试盒(H015)、TGF-β1测试盒(H034-2)购自南京建成生物工程研究所有限公司;RNA提取液(货号G3013)购自Servicebio公司;LncRNA MIAT siRNA质粒、miR-128-3p siRNA质粒、空载质粒、miR-128-3p与U6引物、野生型miR-128-3p 3′-UTR报告质粒、突变型miR-128-3p 3′-UTR报告质粒、miR-128-3p 3′-UTR无义序列、LncRNA MIAT过表达质粒、LncRNA MIAT空载质粒购自上海吉玛制药技术有限公司;人心肌细胞(货号CP-H076)、人心肌细胞完全培养基(货号CM-H076)、含酚红的0.25%胰蛋白酶溶液(货号PB180224)购自武汉普诺赛生命科技有限公司;LipofectamineTM2000(货号11668019)、Opti-MEM培养基(货号31985-070)购自美国Invitrogen公司;一步法反转录荧光定量试剂盒(货号B639277-0100)、双荧光素酶报告基因检测试剂盒(货号E608001)购自上海生工生物工程股份有限公司;Langendorff离体心脏灌流系统(型号Myoheart)购自北京拜安吉科技有限公司;电子分析天平(型号FA1004)购自上海津平科学仪器有限公司;多功能酶标仪(型号Varioskan LUX)购自美国Thermo Fisher Scientific公司;光学显微镜(型号Axiovert 200)购自德国ZEISS公司;冰冻切片机(型号CM1950)购自德国Leica公司;实时荧光定量PCR(real-time quantitative PCR,qPCR)系统(型号qPCR 96K)购自澳大利亚KEWLAB Pty Ltd公司等。
1.2 研究方法
1.2.1 大鼠模型制备及分组 将无水氯化钙、乙酰胆碱加入生理盐水中溶解混匀,得到含有10 g/L氯化钙和33.66 mg/L乙酰胆碱的AF诱导液500 mL。取SD大鼠63只,以1 mL/kg舌下静脉注射AF诱导液,隔日给药1次,共给药14次[11]。给药结束后行心电图检测,造模成功大鼠共60只,以随机数字表法分为模型组、LncRNA MIAT siRNA质粒(MIAT)组、miR-128-3p siRNA质粒(miR-128-3p)组、LncRNA MIAT siRNA质粒+miR-128-3p siRNA质粒(MIAT+miR-128-3p)组、空载质粒组,每组12只。另取12只正常SD大鼠,舌下静脉注射等剂量生理盐水,作为对照组。参照文献[10]及说明书:MIAT组尾静脉注射LncRNA MIAT siRNA质粒,miR-128-3p组尾静脉注射miR-128-3p siRNA质粒,MIAT+miR-128-3p组尾静脉注射LncRNA MIAT siRNA质粒和miR-128-3p siRNA质粒,空载质粒组尾静脉注射LncRNA MIAT siRNA和miR-128-3p siRNA相对应的空载质粒,模型组和对照组大鼠尾静脉注射与MIAT+miR-128-3p组相同剂量的生理盐水,各组大鼠均每周给药2次,共用药2周。
1.2.2 大鼠心房肌电生理及左心室质量指数检测 以乙醚气体麻醉各组所有大鼠,测量体质量后断头处死,然后开胸采集心脏血液,4℃1 000×g离心15 min,取上清液,-80℃保存备用;取出上述各组大鼠心脏置于Langendorff离体心脏灌流系统中,等其自主节律稳定时,以氯化银电极检测左心房有效不应期(effective refractive period,ERP)和90%动作电位时程(90%action potential duration,APD90);将心房肌电生理水平检测结束后的心脏左心室剪下,称质量,计算左心室质量指数=左心室质量/体质量(mg/g);剪下左心室心肌组织0.5 g,分组标记并保存在液氮备用;剩余心肌组织经包埋、冰冻成块后切5μm片备用。
1.2.3 天狼星红染色检测大鼠心肌组织纤维化程度 取1.2.2中各组心肌病理切片,室温放置5 min、冰丙酮固定、30%蔗糖脱水后,加入天狼星红染液,染色完成后封片,每张切片于200倍放大倍数下随机读取5个视野拍照,采用Image J分析并计算心肌胶原容积分数(collagen volume fraction,CVF)=胶原面积/所测视野总面积×100%。
1.2.4 酶联免疫吸附试验测定大鼠血清IL-18、IL-6、TGF-β1水平 取1.2.2中的血清冻融后,参照试剂盒说明书测量IL-18、IL-6、TGF-β1水平。
1.2.5 qPCR检测大鼠心肌组织miR-128-3p表达水平 提取1.2.2中心肌组织总RNA后,以反转录荧光定量PCR扩增实验检测miR-128-3p表达水平。反应体系(20μL):一步法qPCR主混合液10μL,上、下游引物(10μmol/L)各0.4μL、酶混合物0.65μL、RNA模板0.55μL、无RNA酶去离子水8μL。反应条件:50℃反转录5 min,95℃预变性3 min;95℃10 s,60℃30 s,40个循环。选用U6做内参,基因引物序列,见表1。

Tab.1 qPCR primer sequence表1 qPCR引物序列
1.2.6 LncRNA MIAT对miR-128-3p的靶向调控作用 TargetScan Release 7.2生物信息学研究显示,LncRNA MIAT和miR-128-3p之间有结合位点。人心肌细胞快速冻融复苏后300×g离心5 min,以专用的人心肌细胞完全培养基重悬细胞沉淀,混匀后置于37.5℃、5%CO2细胞培养箱中无菌培养。细胞融合度达到80%时进行传代,接种在24孔培养板中,分为miR-128-3p无义+空载组(将miR-128-3p 3′-UTR无义序列+LncRNA MIAT空载质粒转染至人心肌细胞)、miR-128-3p无义+过表达组(将miR-128-3p 3′-UTR无义序列+LncRNA MIAT过表达质粒转染至人心肌细胞)、miR-128-3p野生+空载组(将野生型miR-128-3p 3′-UTR报告质粒+LncRNA MIAT空载质粒转染至人心肌细胞)、miR-128-3p野生+过表达组(将野生型miR-128-3p 3′-UTR报告质粒+LncRNA MIAT过表达质粒转染至人心肌细胞)、miR-128-3p突变+空载组(将突变型miR-128-3p 3′-UTR报告质粒+LncRNA MIAT空载质粒转染至人心肌细胞)和miR-128-3p突变+过表达组(将突变型miR-128-3p 3′-UTR报告质粒+LncRNA MIAT过表达质粒转染至人心肌细胞),各组均遵照LipofectamineTM2000试剂说明书进行转染,测定各组细胞双荧光素酶活性[7]。
1.3 统计学方法 采用GraphPad Prism 8.0.1软件进行数据分析。符合正态分布的计量数据以±s表示,多组间比较行单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠心肌纤维化程度、心房肌电生理水平指标及CVF比较 对照组的心肌组织几乎无纤维化,模型组的心肌组织产生纤维化变性。相比模型组,MIAT组大鼠的心肌组织纤维化减轻,miR-128-3p组大鼠的心肌组织纤维化加重,MIAT+miR-128-3p组大鼠的心肌组织纤维化无明显变化。与对照组比较,模型组ERP、APD90降低,左心室质量指数、心肌CVF升高(P<0.05)。与模型组比较,MIAT组ERP、APD90升高,而左心室质量指数、心肌CVF降低(P<0.05),miR-128-3p组ERP、APD90降低,而左心室质量指数、心肌CVF升高(P<0.05),空载质粒组ERP、APD90、左心室质量指数、心肌CVF差异无统计学意义(P>0.05)。与MIAT组比较,MIAT+miR-128-3p组ERP、APD90降低,而左心室质量指数、心肌CVF升高(P<0.05)。与miR-128-3p组比较,MIAT+miR-128-3p组ERP、APD90升高,而左心室质量指数、心肌CVF降低(P<0.05)。见表2,图1。
Tab.2 Comparison of atrial electrophysiological indexes,left ventricular mass index and myocardial CVF between the six groups of rats表2 各组大鼠心房肌电生理水平指标、左心室质量指数、心肌CVF比较 (n=12,±s)

Tab.2 Comparison of atrial electrophysiological indexes,left ventricular mass index and myocardial CVF between the six groups of rats表2 各组大鼠心房肌电生理水平指标、左心室质量指数、心肌CVF比较 (n=12,±s)
**P<0.01;a与对照组比较,b与模型组比较,c与MIAT组比较,d与miR-128-3p组比较,P<0.05。
组别对照组模型组MIAT组miR-128-3p组MIAT+miR-128-3p组空载质粒组F ERP(ms)46.01±3.02 20.15±2.58a 43.57±3.64b 12.63±0.82b 22.08±2.16cd APD90(ms)65.13±4.81 48.94±3.97a 62.87±4.56b 37.58±2.01b 51.89±2.68cd左心室质量指数(mg/g)12.20±2.01 21.05±3.48a 13.97±2.46b 29.03±2.85b 20.01±2.62cd心肌CVF(%)0.52±0.17 20.53±2.04a 3.74±1.23b 31.67±3.52b 18.91±2.19cd 19.78±2.27 351.599**49.72±4.05 84.145**21.67±2.34 61.401**21.06±2.23 356.630**
2.2 各组大鼠血清IL-18、IL-6、TGF-β1水平比较 与对照组比较,模型组血清IL-18、IL-6、TGF-β1水平升高(P<0.05)。与模型组比较,MIAT组血清IL-18、IL-6、TGF-β1水平降低(P<0.05),miR-128-3p组血清IL-18、IL-6、TGF-β1水平升高(P<0.05),空载质粒组血清IL-18、IL-6、TGF-β1水平差异无统计学意义(P>0.05)。与miR-128-3p组比较,MIAT+miR-128-3p组血清IL-18、IL-6、TGF-β1水平降低(P<0.05)。与MIAT组比较,MIAT+miR-128-3p组血清IL-18、IL-6、TGF-β1水平升高(P<0.05),见表3。
Tab.3 Comparison of serum levels of IL-18,IL-6,TGFβ1 and expression of miR-128-3p in myocardial tissue between the six groups of rats表3 各组血清IL-18、IL-6、TGF-β1及心肌组织miR-128-3p水平比较 (n=12,±s)

Tab.3 Comparison of serum levels of IL-18,IL-6,TGFβ1 and expression of miR-128-3p in myocardial tissue between the six groups of rats表3 各组血清IL-18、IL-6、TGF-β1及心肌组织miR-128-3p水平比较 (n=12,±s)
**P<0.01;a与对照组比较,b与模型组比较,c与MIAT组比较,d与miR-128-3p组比较,P<0.05。
组别对照组模型组MIAT组miR-128-3p组MIAT+miR-128-3p组空载质粒组F IL-18(μg/L)0.39±0.04 1.42±0.13a 0.43±0.09b 2.38±0.22b 1.39±0.18cd IL-6(μg/L)1.32±0.24 14.29±2.65a 1.97±0.43b 25.32±3.17b 13.14±3.01cd TGF-β1(ng/L)120.68±26.83 638.15±65.38a 125.49±28.16b 931.27±86.67b 629.82±70.54cd miR-128-3p 1.01±0.24 0.56±0.07a 0.96±0.19b 0.31±0.05b 0.59±0.08cd 1.44±0.26 228.185**14.75±2.82 170.296**635.91±72.08 321.152**0.55±0.06 46.911**
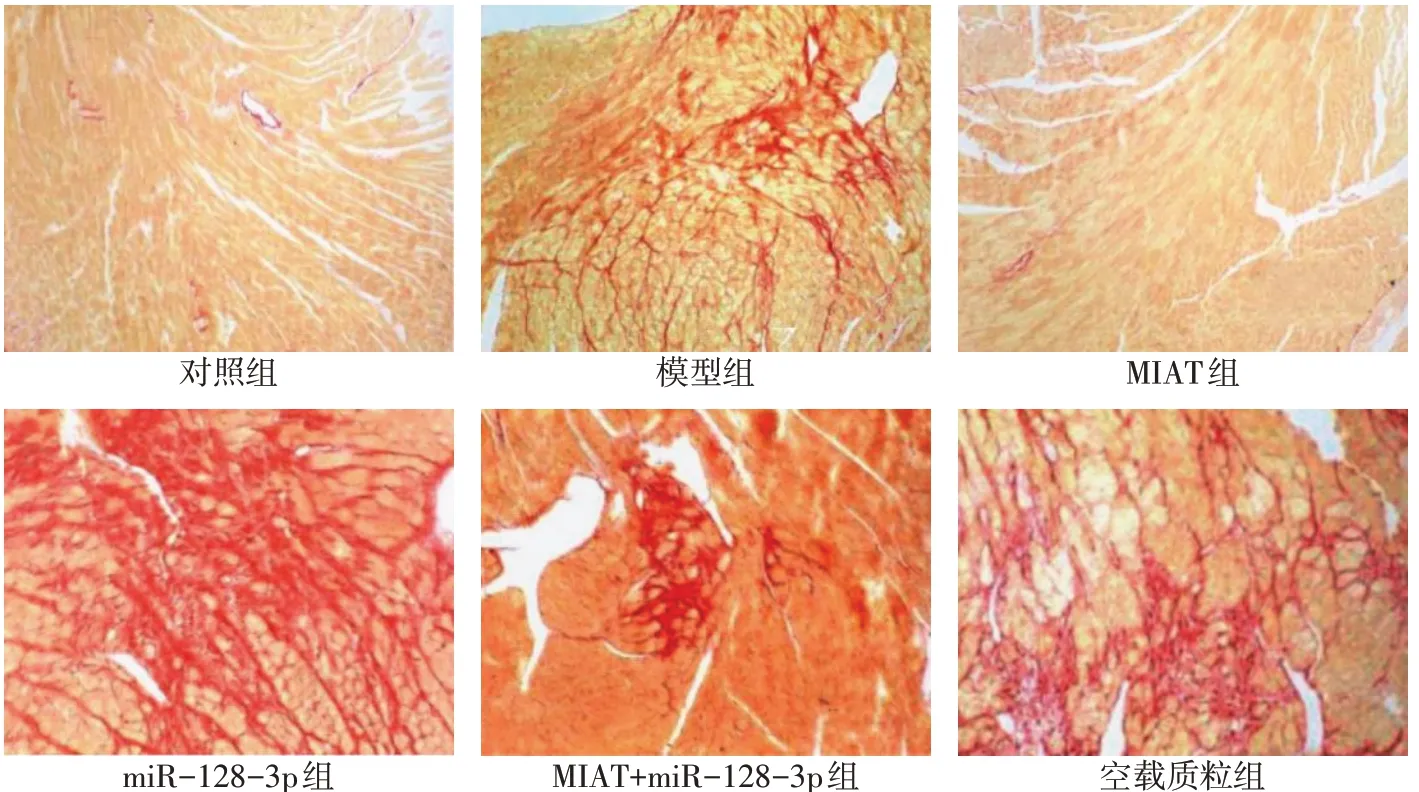
Fig.1 The degree of myocardial fibrosis detected by Sirius red staining(×200)图1 天狼星红染色检测大鼠心肌纤维化程度(×200)
2.3 各组大鼠心肌组织miR-128-3p表达比较 与对照组比较,模型组心肌组织miR-128-3p表达水平降低(P<0.05)。与模型组比较,MIAT组心肌组织miR-128-3p表达水平升高(P<0.05),miR-128-3p组miR-128-3p表达水平降低(P<0.05),空载质粒组miR-128-3p表达水平差异无统计学意义(P>0.05)。与miR-128-3p组比较,MIAT+miR-128-3p组心肌组织miR-128-3p表达水平升高(P<0.05)。与MIAT组比较,MIAT+miR-128-3p组心肌组织miR-128-3p表达水平降低(P<0.05),见表3。
2.4 MIAT对miR-128-3p的靶向调节 TargetScan Release 7.2生物信息学研究显示,LncRNA MIAT和miR-128-3p之间有结合位点,见图2。与miR-128-3p野生+空载组比较,miR-128-3p野生+过表达组相对荧光素酶活性降低(P<0.05);miR-128-3p突变+空载组和miR-128-3p突变+过表达组、miR-128-3p无义+空载组和miR-128-3p无义+过表达组间相对荧光素酶活性差异均无统计学意义(P>0.05),见图3。

Fig.2 Bioinformatics of TargetScan Release7.2 predicts the binding site between lncRNA MIAT and miR-128-3p图2 TargetScan Release7.2的生物信息学预测LncRNA MIAT和miR-128-3p之间的结合位点

Fig.3 Relative luciferase activity of cells in each group图3 各组细胞相对荧光素酶活性值
3 讨论
AF可导致心房收缩、舒张功能减退,使心脏泵血功能明显受损甚至丧失,患者会因心力衰竭而死亡。临床主要通过导管消融术对AF进行治疗,但费用高昂,且复发率高,因此积极探究AF发生、发展机制,寻找更有效的治疗手段具有重要临床价值[12-13]。本研究采用舌下静脉注射氯化钙-乙酰胆碱混合液的方法诱导AF大鼠模型,结果显示,与对照组比较,模型组大鼠的ERP、APD90降低,左心室质量指数、心肌CVF升高,表明大鼠出现心室重构和AF症状,AF模型构建成功。研究显示,多种炎症标志物在AF过程中升高,其引发的炎症级联反应是导致心肌纤维化改变,进而造成心室重构的重要因素,采用免疫调节剂进行抗炎是治疗AF的有效方法[14-15]。MIAT为一种调控炎症的长链非编码RNA,参与介导心力衰竭、AF等疾病的发病机制,可促进心力衰竭患者炎症因子和心肌胶原合成,而沉默LncRNA MIAT可抑制炎症,减轻心肌纤维化导致的心力衰竭[16],缓解心房重构,改善AF症状[17]。本研究结果显示,相比模型组,MIAT组大鼠中LncRNA MIAT表达及IL-18、IL-6、TGF-β1水平降低,左心室质量指数和CVF也降低,大鼠心肌电生理指标ERP、APD90水平升高,表明敲低MIAT表达可抑制炎症,减少胶原合成,减轻心肌纤维化变性,进而改善心肌电生理功能,延缓心室重构进程,减轻大鼠AF症状,证实了LncRNA MIAT参与调控AF发生、发展过程,提示MIAT是AF的重要治疗靶点。
研究显示,miR-128-3p可调控氧化应激和炎症的发生、发展,进而介导心肌梗死与AF等心肌损伤性疾病的发病过程,促进miR-128-3p表达可显著降低致炎因子合成水平,减轻脂多糖诱导的心肌炎症损伤[18]。过表达miR-128-3p可抑制血管紧张素Ⅱ诱导的人心肌纤维化变性[10]。在心肌梗死小鼠中miR-128-3p下调,上调其表达可使小鼠心肌细胞免于凋亡[19]。另有研究显示,MIAT可负向调控miR-128-3p的表达[20]。但miR-128-3p是否为MIAT介导AF发生及病情进展的下游分子靶点并不清楚。本研究结果显示,相比模型组,miR-128-3p组中大鼠血清炎性因子IL-18、IL-6及致纤维化因子TGFβ1水平升高,且左心室质量指数和CVF升高,大鼠心肌电生理指标ERP、APD90水平降低,表明下调miR-128-3p表达可促进炎症进展,加重大鼠心室重塑和心肌纤维化;而敲低MIAT表达可提高心肌组织miR-128-3p表达,提示miR-128-3p参与介导敲低MIAT表达对AF的治疗过程。另外,相比MIAT组,MIAT+miR-128-3p组大鼠ERP、APD90、心肌组织miR-128-3p表达均降低,左心室质量指数、CVF、血清IL-18、IL-6及TGF-β1水平均升高,表明miR-128-3p siRNA质粒与LncRNA MIAT siRNA质粒合用时,miR-128-3p siRNA质粒可减弱MIAT敲低对炎性因子表达的抑制作用,拮抗MIAT敲低对AF大鼠心室重塑和心肌纤维化的缓解作用,最终逆转MIAT敲低对AF大鼠AF症状的改善作用。另外,双荧光素酶报告基因试验结果显示,LncRNA MIAT对miR-128-3p具有靶向调节作用,表明敲低MIAT表达可通过提高心肌组织miR-128-3p表达而起到抑制炎症作用,进而减轻AF大鼠心室重塑和心肌纤维化,改善心功能,揭示LncRNA MIAT可通过靶向调节miR-128-3p表达,介导AF引发的心室重构和心肌纤维化过程。
综上所述,LncRNA MIAT参与介导AF的发生、发展,敲低MIAT可上调miR-128-3p,减少炎性细胞因子与致纤维化因子合成,抑制心肌炎症及纤维化,延缓心室重构进程,最终改善AF症状,而靶向调控miR-128-3p表达是其发挥上述作用的分子机制之一。

