年龄对人脂肪来源间充质干细胞生物学特性的影响
杜鹏,王峰,陈晓波,郑燕,吴倩倩,刘卫军,王玉亮△
间充质干细胞(mesenchymal stromal cells,MSCs)具有多能性、易得性,并兼有免疫调节、炎症趋化、组织修复等生物学特性,故有望成为自身免疫疾病、心脑血管疾病、失代偿性乙型肝炎肝硬化、器官移植及新型冠状病毒肺炎(conronavirus disease 2019,COVID-19)等疾病治疗的细胞来源[1-2]。脂肪来源间充质干细胞(adipose derived mesenchymal stromal cells,ADSCs)是一种具有自我更新能力和多向分化潜能的组织工程种子细胞,具有容易获得并可大量复制的特点,其获取效率优于骨髓MSCs,特别是自体细胞移植不涉及伦理道德问题[3]。随着ADSCs在多种难治性疾病研究中的应用,制备足够的ADSCs成为研究热点。ADSCs捐赠者年龄对细胞增殖活性、分化潜能及旁分泌作用有较大影响,尤其是老年患者能否采取自体干细胞治疗相关疾病尚无定论[4]。本研究旨在观察年龄对ADSCs体外生物学特性的影响,以期为临床进行自体细胞移植,迅速获得所需ADSCs提供实验依据。
1 对象与方法
1.1 研究对象 纳入2020年8月—2021年8月于天津市儿童医院行腹部肿物切除的10例患儿(儿童组),男女各5例,年龄2~6岁。纳入同期天津市人民医院行阑尾炎切除的20例患者;其中,20~40岁的10例(成年组),男女各5例;51~74岁的10例(>50岁组),男女各5例。获取各组患者的术中腹部皮下脂肪组织并留取外周血5 mL。捐献者均签署知情同意书。
1.2 主要试剂与仪器 鼠抗人CD34、CD45、CD73、CD90、CD105单克隆抗体(BD Pharmingen公司,美国);DMEM/F12培养基、胎牛血清(Gibco公司,美国);Ⅰ型胶原酶、胰蛋白酶、植物血凝素(PHA)、成脂及成骨诱导试剂(Sigma公司,美国);重组人白细胞介素(IL)-2(北京四环生物制药有限公司);TRIzol RNA提取试剂盒(Invitrogen公司,美国);干扰素(IFN)-γ酶联免疫吸附试验(ELISA)试剂盒(eBioscience公司,美国);聚蔗糖-泛影葡胺淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);倒置显微镜(Olympus公司,日本);CO2培养箱(Thermo公司,美国);超净工作台(上海力康生物医疗科技控股有限公司);xCELLigence RTCA实时细胞分析系统及其配套E-plate16孔培养板、CIM-Plate 16孔迁移培养板(Roche公司,德国);FACS Calibur流式细胞仪(Becton Dickinson公司,美国);7500型PCR扩增仪(ABI公司,美国);酶标仪(BioTek公司,美国)。
1.3 研究方法
1.3.1 ADSCs的分离、培养和鉴定 参照文献[5],对儿童组、成年组和>50岁组腹部皮下脂肪组织进行ADSCs的分离与培养,取第3代ADSCs用于后续实验。倒置显微镜和姬姆萨染色观察细胞形态,流式细胞术对MSCs细胞表面标志物(CD90、CD105和CD73)、造血干细胞表面标志物CD34及白细胞共同抗原CD45进行鉴定,其中细胞表面标志物表达>95%为阳性[6]。
1.3.2 增殖细胞指数(CI)测定 取xCELLigence RTCA实时细胞检测系统所配置的布满电极的E-plate 16孔培养板,每孔加入100μL细胞培养液测定基线;待测定完毕,将各组细胞按5 000个/孔的密度种植于E-plate培养板内,置于xCELLigence RTCA仪器上,于37℃、5%CO2及饱和湿度的培养箱中培养,实验过程中电极实时监测各孔增殖CI值,以72 h为监测终点。
1.3.3 迁移CI测定 制备细胞悬液前先将细胞在无血清培养基中饥饿培养24 h,消化细胞,调整细胞密度至1×105/mL;取细胞悬液100μL种植于CIM-Plate 16细胞迁移培养板上室;细胞迁移培养板下室加入160μL含20%胎牛血清的完全培养基。将CIM-Plate 16孔迁移培养板安置于xCELLigence RTCA仪器上,于37℃、5%CO2及饱和湿度的培养箱中培养,实验过程中电极实时监测各孔迁移CI值,以72 h为监测终点。
1.3.4 ADSCs多向分化能力评估 参照文献[6],鉴定ADSCs体外诱导多向分化的潜能,光学显微镜下观察油红O染色后脂肪细胞质内球形脂滴形成情况、茜素红染色后成骨细胞内矿物质沉积情况。
1.3.5 实时逆转录-聚合酶链反应(RT-qPCR)检测成骨特异性基因骨桥蛋白(OPN)和脂肪形成特异性基因过氧化物酶体增殖物激活受体-γ(PPAR-γ)mRNA表达水平 采用Trizol法提取ADSCs总RNA,反转录为cDNA。OPN引物:上游5′-AAACGCCGACCAAGGTACAG-3′,下 游5′-ATGCCTAGGAGGCAAAAGCAA-3′;PPAR-γ引物:上游5′-AGTCCTCACAGCTGTTTGCCAAGC-3′,下 游5′-GAGCGGGTG AAGACTCATGTCTGTC-3′;内参基因GAPDH引物:上 游5′-AGAAGGCTGGGGCTCATTTG-3′,下 游5′-AGGGGCCATCCACAGTCTTC-3′。反应体系:2μL模板、1μL引物、10μL Real PCR Master Mix,焦碳酸二乙酯(DEPC)处理双蒸水补至20μL。PCR反应条件:95℃预变性10 min;95℃变性30 s,60℃退火45 s,72℃延伸30 s,共40个循环。记录Ct值,以2-ΔCt表示OPN及PPAR-γmRNA的相对表达水平,其中ΔCt=Ct目的基因-CtGAPDH。
1.3.6 ELISA检测培养上清液中IFN-γ水平 ADSCs以1×104/孔密度接种于96孔细胞培养板,37℃、5%CO2饱和湿度的培养箱中孵育1 h,将留取的5 mL外周血经淋巴细胞分离液以2 000 r/min离心20 min,分离出外周血单个核细胞(PBMCs)。用含10%胎牛血清的RPMI 1640培养基调整细胞浓度为1×105/孔,待ADSCs贴壁后每孔加入1×105个PBMCs,建立共培养体系,共培养体系加入10μL PHA(10 mg/L)及8μL IL-2(100 U/mL)刺激淋巴细胞增殖,每个共培养体系设3个复孔,于37℃、5%CO2孵箱中培养72 h,收集培养上清液。参照试剂盒说明书,检测IFN-γ水平。
1.4 统计学方法 采用SPSS 11.5软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 ADSCs的体外培养和鉴定 ADSCs传代后细胞主要呈长梭形,并呈几何倍数稳定增长,传3代后ADSCs细胞形态均一,呈漩涡状铺满板底,各组细胞形态均为典型的纺锤形,具备典型的ADSCs形态特征,见图1。姬姆萨染色后,可见各组细胞大部分呈纺锤形,也有多角形,胞核染成紫红色,胞浆染成淡紫色,见图2。流式细胞仪检测各组ADSCs表面标志物CD90、CD105和CD73表达均>95%,CD34、CD45表达均呈阴性,见图3。
2.2 各组细胞体外增殖和迁移CI比较 与成年组以及>50岁组比较,儿童组细胞体外增殖CI和迁移CI均增加(P<0.01),见表1。
2.3 各组细胞多向分化结果 成脂和成骨诱导液均可诱导ADSCs分化为脂肪细胞和成骨细胞,其中儿童组及成年组能够明显诱导分化为成骨细胞,而>50岁组诱导分化为成骨细胞染色较弱,见图4。

Fig.1 Morphologic characteristics of ADSCs from three age groups(×200)图1 3个年龄组ADSCs形态图(×200)
Fig.2 Morphologic characteristics of ADSCs after Gemsa staining(×400)图2 姬姆萨染色后的ADSCs的形态图(×400)
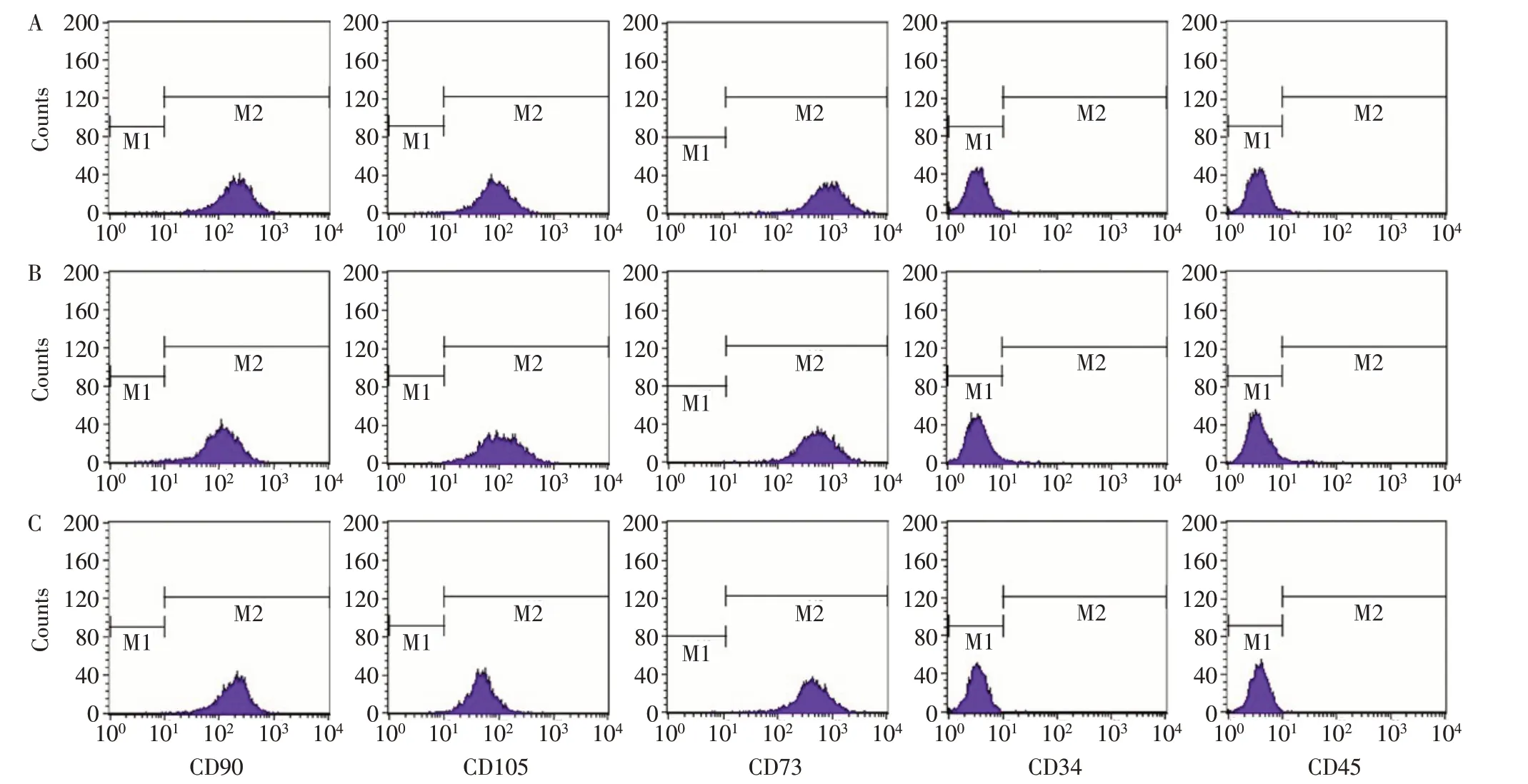
Fig.3 Detection of surface markers of ADSCs detected by flow cytometry图3 流式细胞术检测ADSCs表面标志物情况
Tab.1 Comparison of cell proliferation and migration cell index of ADSCs derived from three age groups表1 3组ADSCs增殖及迁移CI比较(n=10,±s)

Tab.1 Comparison of cell proliferation and migration cell index of ADSCs derived from three age groups表1 3组ADSCs增殖及迁移CI比较(n=10,±s)
**P<0.01;a与儿童组比较,P<0.05。
组别儿童组成年组>50岁组F增殖CI 2.65±0.18 2.43±0.15a 2.32±0.15a 11.580**迁移CI 2.34±0.17 1.92±0.14a 1.78±0.20a 29.460**
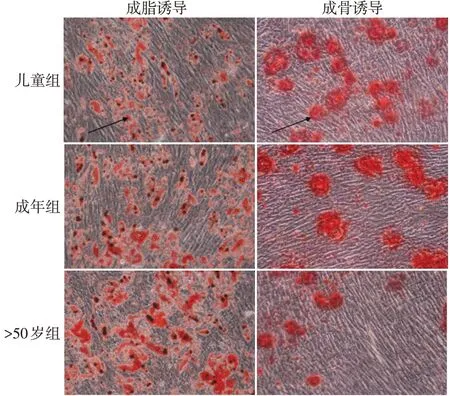
Fig.4 Adipogenic and osteogenic induction differentiation of isolated ADSCs derived from three age groups(×200)图4 3组ADSCs诱导分化成脂及成骨细胞图(×200)
2.4 各组PPAR-γ、OPN mRNA相对表达水平及ADSCs抑制PBMCs IFN-γ分泌水平比较 随年龄的增长,各组PPAR-γmRNA相对表达水平差异无统计学意义,而OPN mRNA相对表达水平和抑制IFNγ分泌水平逐渐降低(P<0.05),见表2。
Tab.2 Comparison of PPAR-γ,OPN mRNA expression in ADSCs and IFN-γsecretion in PBMCs from three age groups表2 3组ADSCs中PPAR-γ、OPN mRNA表达及PBMCs中IFN-γ分泌水平比较 (n=10,±s)
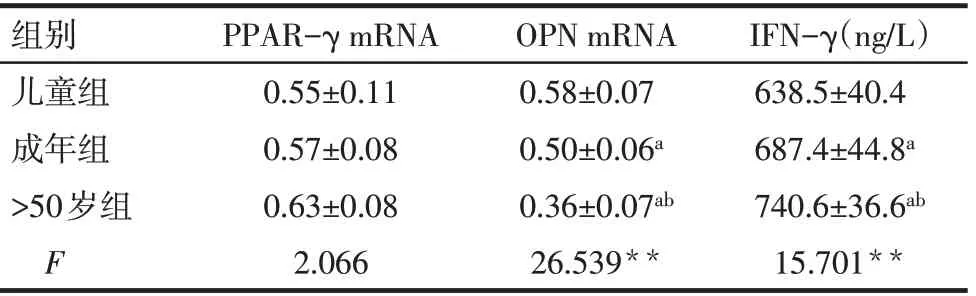
Tab.2 Comparison of PPAR-γ,OPN mRNA expression in ADSCs and IFN-γsecretion in PBMCs from three age groups表2 3组ADSCs中PPAR-γ、OPN mRNA表达及PBMCs中IFN-γ分泌水平比较 (n=10,±s)
**P<0.01;a与儿童组比较,b与成年组比较,P<0.05。
组别儿童组成年组>50岁组F PPAR-γmRNA 0.55±0.11 0.57±0.08 0.63±0.08 2.066 OPN mRNA 0.58±0.07 0.50±0.06a 0.36±0.07ab 26.539**IFN-γ(ng/L)638.5±40.4 687.4±44.8a 740.6±36.6ab 15.701**
3 讨论
3.1 ADSCs的形态及表型 了解不同年龄人群ADSCs的体外生长规律及生物学特性是实现其应用的基础。本研究结果显示,各年龄组细胞形态均为纺锤形,均具备典型的ADSCs形态特征;流式细胞分析结果显示,3组细胞的MSCs表面标志物CD73、CD90、CD105的表达率均在95%以上,同时阴性标志物CD34、CD45表达率均在1%以下,表明来自所有年龄组的ADSCs含有均一MSCs表型,年龄因素并不影响ADSCs的均一性,与Horinouchi等[7]研究结论相近。
3.2 ADSCs的生物学特性 研究显示细胞的增殖、迁移、抗细胞凋亡和分化能力可能是影响临床治疗结果以及组织工程成功的关键因素[8]。细胞增殖能力是ADSCs用于治疗的关键,即在短时间内获得满足临床细胞治疗所需要的细胞数量的能力。迁移指数反映细胞在体内向炎症部位或是损伤部位迁移能力,在组织修复中起关键作用。多向分化反映细胞对损伤部位进行损伤修复及组织再生能力。本实验通过xCELLigence RTCA实时细胞分析系统检测3组细胞增殖和迁移能力,该分析系统利用检测电子传感器阻抗变化以反映细胞生理状态,从而对细胞进行无损伤地定量检测。结果表明,在相同培养条件下,随着年龄的增长,ADSCs体外增殖、迁移能力均逐渐减弱,表明衰老可以降低细胞增殖和迁移能力,提示对老年供体采集ADSCs需要收集更多的脂肪组织或需要对细胞进行预处理以增强ADSCs的增殖和迁移能力。ADSCs具有多向分化潜能。本研究细胞染色及标志基因表达指标显示,各组ADSCs均有效地分化为了脂肪细胞和成骨细胞;不同年龄组之间,油红O阳性细胞数量相当,脂肪形成特异性基因PPAR-γmRNA表达差异无统计学意义,表明高龄人群ADSCs的脂肪生成潜能亦得到了很好的保存。然而,本研究显示,>50岁组ADSCs诱导分化成骨细胞的能力较弱,随年龄的增长,骨结节形成特异性基因OPN mRNA相对表达水平降低,表明随着年龄的增长,ADSCs向成骨细胞分化能力逐渐减弱。儿童因正处于旺盛的生长发育期,因此要比高龄人群具备更强的自我增殖、迁移和多向分化能力,是较理想的种子细胞的来源。Kornicka等[9]研究显示,ADSCs的成脂和成骨分化潜能取决于供体年龄,其中>20岁年龄组OPN mRNA表达水平较高,而50~70岁年龄组的PPAR-γmRNA表达水平更高。另有研究显示,髂嵴和胫骨来源MSCs的多向分化潜能不受年轻(18~49岁)和高龄(≥50岁)影响[10]。本研究结果表明,除了不同来源MSCs之间的差异可能影响细胞多向分化潜能外,供体年龄组的差异以及MSCs的培养条件也是导致结果差异的因素。
3.3 ADSCs免疫调节 一般认为,ADSCs的免疫调节作用是通过与效应细胞的相互接触并释放可溶性细胞因子,从而达到抑制免疫细胞增殖的作用[11]。本研究显示,IFN-γ与淋巴细胞介导的细胞免疫反应有关[12]。本研究以有丝分裂原活化的淋巴细胞在体外与来自3组患者的ADSCs共培养结果显示,ADSCs可降低促炎细胞因子IFN-γ的分泌,而儿童组来源ADSCsIFN-γ分泌水平低于成年组和>50岁组,表明ADSCs免疫调节能力随年龄增长而下降,提示需要细胞预处理策略来提高自体疗法中高龄人群来源ADSCs的免疫调节功能,与王平等[13]研究结果相近。
综上所述,ADSCs的生物学和功能特征与年龄有关,儿童来源ADSCs具有更强的体外增殖、迁移、多向分化以及免疫抑制能力。

