动脉瘤形态、血流动力学和微小RNA对颅内动脉瘤术中破裂的影响及预测价值
杨利超,赵中甫,胡国超
颅内动脉瘤(IA)表现为颅内动脉异常扩张,动脉壁变薄变弱,存在破裂风险[1]。IA的全球人口发病率为2%~5%,其中0.7%~1.9%的IA破裂引起蛛网膜下腔出血,危及生命[2]。IA的死亡率和不良预后率高[3-4],是最具破坏性的神经系统疾病之一,以自发性脑出血、脑血管痉挛和动眼神经麻痹为主要临床特征[5]。但不幸的是,大多数IA患者无症状,在破裂之前几乎不会感到疼痛,因此探讨影响IA破裂的危险因素,在临床上具有重要的指导价值。研究[6-8]显示,IA破裂常见的危险因素有动脉瘤体形态、血流动力学障碍、基因、感染、衰老和先天因素等。最近,越来越多的证据[9]表明,循环微小RNA(miRNA)在IA的发展中起着至关重要的作用。miR-29被认为是主动脉发育和老化以及IA进展中的基因调节剂[10]。动脉瘤破裂是胶原蛋白降解的结果。有报道[11]显示,miR-29家族通过调节编码细胞外基质蛋白的基因转录,参与胶原蛋白Ⅰ、胶原蛋白Ⅲ、纤维蛋白-1和弹性蛋白-1的纤维化反应。miR-126在甲状腺癌中,通过调节血管内皮生长因子(VEGF)水平发挥抑癌作用[12]。而VEGF是一种重要的血管生长因子,Liu等[13]推测miR-126可能通过调节VEGF参与IA的发展。有报道[14-15]显示,IA外周血中miR-143和miR-145表达下调,参与的病理生理学过程包括炎症、动脉瘤的失调等过程。本研究中通过比较IA的形态学指标、血流动力学指标和miRNA对IA颈夹闭术或介入治疗术中IA破裂的预测价值,筛选出最有价值的预测因素以指导临床治疗。
1 对象与方法
1.1 对象 选取2018年1月至2021年3月在本院接受治疗的IA患者195例,根据术中IA是否破裂分为未破裂组162例及破裂组33例。纳入标准:(1)经头颅CT、CTA或DSA确诊为IA;(2)接受IA颈夹闭术或介入术治疗;(3)临床数据完整。排除标准:(1)多发性IA;(2)合并肿瘤;(3)有卒中史;(4)合并炎症性疾病。本研究经医院伦理委员会批准,患者知情同意。
1.2 方法
1.2.1 形态学指标的测量 所有患者入院后均行DSA,测量形态学参数包括动脉瘤体长径、瘤体宽径、瘤体最大长径、瘤颈宽度和载瘤动脉宽度,计算瘤体最长径与瘤颈宽度的比值(AR)、瘤体最大长径/载瘤动脉直径(SR)、瘤体长径/瘤体宽径(HWR)和瘤体宽径/瘤颈宽度(BN),记录动脉瘤形态[规则(圆形或类圆形,表面光滑无分叶)、不规则(表面有鼓泡、突起或分叶形)]。
1.2.2 血流动力学参数的测量 使用Diasonic VST Master行TCD检测,包含一个2.0 MHz实时成像换能器和一个2.0 MHz脉冲多普勒换能器。记录收缩期动脉瘤的表面平均压力(PA)、1个心动周期内的动脉瘤表面最大压力(PM)、动脉瘤标准化PA(NPA)、动脉瘤标准化PM(NPM)、平均壁面剪切力(WSSA)、低剪切力面积比值(LSQR)。
1.2.3 外周血miRNA水平的检测 提取外周血清中总RNA并反转录为cDNA,根据试剂盒说明行实时定量PCR检测。引物设计如下:(1)miR-29a:上游引物序列为5′-AAA GGA TCC GCC ATA GAA ACC CAG TTT C-3′,下游引物序列为5′-AAA ACG CGT CCA AGG GAT GAA TGT AAT TG-3′;(2)miR-126:上游引物序列为5′-GTC GTA TCC AGT GCA GGG TCC GAG-3′,下游引物序列为5′-GTA TTC GCA CTG GAT ACG AC-3′;(3)miR-143:上游引物序列为5′-AGT GTC CCC ACC GTC GGT TGT ACC TTG-3′,下游引物序列为5′-CAC TGC TGC TAC CGT ACA AG-3′;(4)miR-145:上游引物序列为5′-CTC GCT TCG GCA GCA CA-3′,下游引物序列为5′-AAC GCT TCA CGA ATT TGC GT-3′;(5)U6:上游引物序列为5′-GTA GAT GCA CTA CCG AT-3′,下游引物序列为5′-CTG AAC TGT AGC TAA CTG AT-3′。根据2-ΔΔCt公式计算出miR-29a、miR-126、miR-143和miR-145的相对表达水平。

2 结 果
2.1 破裂组及未破裂组一般资料的比较 见表1。破裂组及未破裂组性别、年龄、高血压、糖尿病、脑血管病史、吸烟史和动脉瘤位置差异无统计学意义(均P>0.05)。

表1 破裂组及未破裂组一般资料的比较[例(%)]
2.2 破裂组及未破裂组动脉瘤形态参数的比较 见表2。与未破裂组比较,破裂组瘤体长径、瘤体最长径、AR、SR和形状不规则患者比率显著升高,瘤体宽径显著降低(均P<0.05)。两组间瘤颈宽度、载瘤动脉宽度、HWR和BN差异无统计学意义(均P>0.05)。
表2 破裂组及未破裂组IA形态参数的比较[±s,例(%)]
表2 破裂组及未破裂组IA形态参数的比较[±s,例(%)]
组别例数瘤体长径(mm)瘤体宽径(mm)瘤体最长径(mm)瘤颈宽度(mm)载瘤动脉宽度(mm)破裂组3312.96±2.127.81±2.5013.95±3.447.83±2.121.50±0.31未破裂组16210.14±2.528.67±3.2511.04±3.057.66±2.551.44±0.40χ2/t值3.2413.6523.0230.9241.245P值0.0100.0090.0240.7480.098组别例数ARHWRBNSR形状不规则破裂组331.57±0.351.25±0.211.04±0.076.53±1.7417(51.5)未破裂组1621.36±0.281.29±0.261.12±0.106.02±1.6237(22.8)χ2/t值2.6321.2052.1623.14211.258P值0.0320.1040.0590.0100.001
2.3 破裂组及未破裂组血流动力学指标的比较 见表3。破裂组WSSA和LSQR水平高于未破裂组,差异有统计学意义(均P<0.05),其他指标差异无统计学意义(均P>0.05)。
表3 破裂组及未破裂组血流动力学指标的比较[±s,M(Q25,Q75)]

表3 破裂组及未破裂组血流动力学指标的比较[±s,M(Q25,Q75)]
组别例数PA(Pa)PM(Pa)NPANPMWSSA(Pa)LSQR破裂组332105(1032,3856)4085(2914,5875)0.65±0.081.03±0.083.12±0.850.39(0.21,0.84)未破裂组1622136(1029,3852)4105(2784,5796)0.66±0.091.05±0.042.13±0.470.25(0.13,0.48)χ2/t值0.7681.0350.1320.5623.8564.002P值0.1140.2120.1170.3190.0090.004
2.4 破裂组及未破裂组miR-126、miR-143、miR-145、miR-29a水平的比较 见表4。与未破裂组比较,破裂组miR-126、miR-29a水平显著升高,miR-143、miR-145水平显著降低(均P<0.05)。
表4 两组间miR-126、miR-143、miR-145、miR-29a水平的比较(±s)

表4 两组间miR-126、miR-143、miR-145、miR-29a水平的比较(±s)
组别miR-126miR-143miR-145miR-29a破裂组(n=33)3.01±0.260.56±0.110.43±0.083.18±0.25未破裂组(n=162)1.05±0.132.14±0.152.32±0.210.96±0.14t值4.8543.6523.9655.102P值<0.0010.0100.005<0.001
2.5 IA破裂的影响因素的多因素分析 见表5。以上述有统计学差异的因素为因变量,采用逐步向前法行多因素Logistic回归分析。结果显示,AR、SR、形状不规则、WSSA、LSQR、miR-126和miR-29a为动脉瘤破裂的危险因素,miR-143和miR-145为动脉瘤破裂的保护因素(P<0.05~0.01)。

表5 IA破裂的影响因素的多因素Logistic回归分析结果
2.6 IA形态危险因素、血流动力学危险因素和miRNA危险因素对IA破裂的预测价值的比较 见图1、2、3及表6。AR、SR、形状不规则联合检测(联合检测-1)的曲线下面积(AUC)大于AR、SR、形状不规则的AUC(Z=3.856,Z=4.325,Z=3.524;P=0.017,P=0.008,P=0.034)。WSSA、LSQR联合检测(联合检测-2)的AUC大于WSSA、LSQR的AUC(Z=3.154,Z=4.041;P=0.042,P=0.011)。miR-126、miR-29a联合检测(联合检测-3)的AUC大于miR-126、miR-29a的AUC(Z=3.847,Z=3.652;P=0.020,P=0.026)。联合检测-1和联合检测-2的AUC大于联合检测-3(Z=5.201,Z=4.865;均P<0.001),联合检测-1和联合检测-2的AUC差异无统计学意义(P>0.05)。
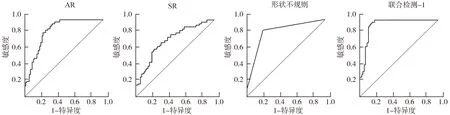
图1 IA形态危险因素对动脉瘤破裂的预测价值
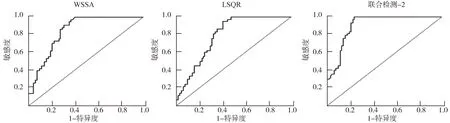
图2 血流动力学参数危险因素对IA破裂的预测价值

图3 miRNA危险因素对IA破裂的预测价值
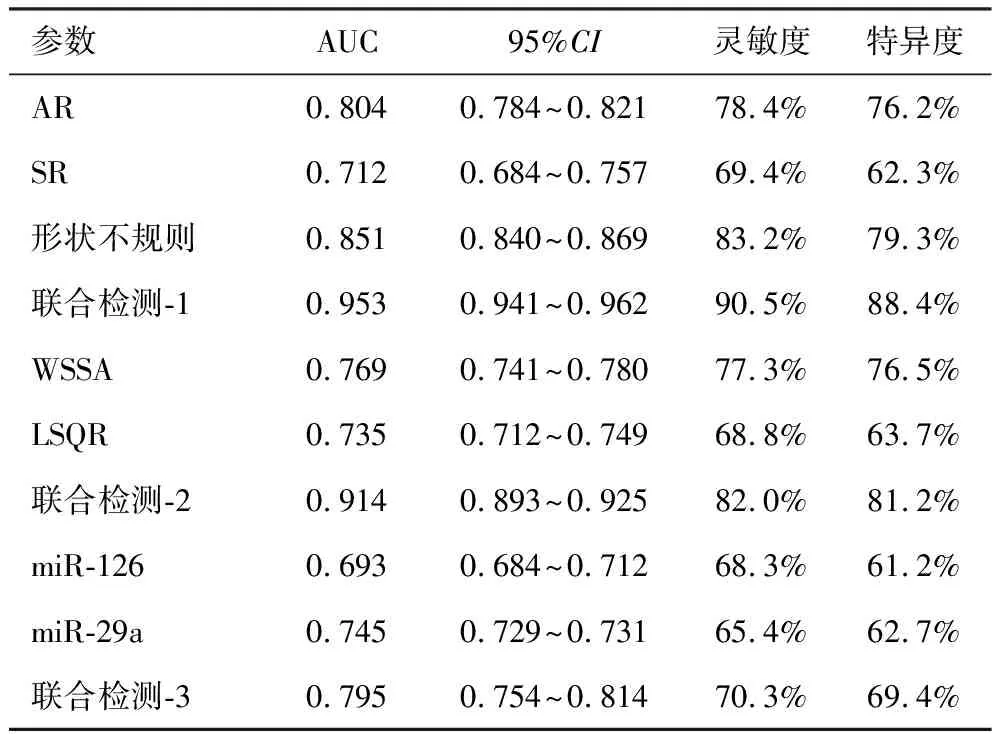
表6 ROC曲线特征
3 讨 论
随着医疗水平的提高,IA的发现率逐步增加,携带患者比率约3%[16-17]。IA破裂与手术者经验和手术操作有关,在这些人为因素外,IA本身也有一定影响,且IA破裂导致的动脉瘤性蛛网膜下腔出血病死率较高[18]。因此筛选影响IA破裂的危险因素,对高危患者采取积极的预防措施,对降低IA破裂率有一定帮助。miRNA是一种短链非编码RNA,与IA的形成密切相关,但其对IA破裂影响的相关研究较少见[19-20]。本研究通过比较IA的形态学指标、血流动力学指标和miRNA对IA破裂的预测价值,筛选出对IA破裂最有价值的预测因素。
IA是一种由血管炎症驱动的疾病,在体内施用抗炎药物后,实验性IA的形成和进展可显著减慢[21]。miR-143和miR-145在血管炎症中起关键作用,研究[22-24]显示其在血管疾病动物模型中表达下调,如血管损伤、动脉粥样硬化和IA形成等。Jiang等[25]发现,miR-143和miR-145在IA破裂患者中均显著下调。与此一致的是,Liu等[26]发现血管平滑肌富集的miRNA,如miR-143/145在IA患者中发生了显著改变。同样,本研究显示miR-143和miR-145在破裂患者外周血中水平显著低于未破裂患者,是IA破裂的保护性因素。
miR-29a通过靶向调节脂蛋白脂肪酶参与炎症信号通路和清道夫表达的调节[27]。由于血流和剪切应力的改变,IA的形成始于内皮功能障碍[28]。内皮功能障碍会导致代偿反应,不可避免地出现内皮功能和形态变化,从而引发炎症反应[29]。Wang等[30]研究显示,miR-29a可能通过炎症反应参与IA的发展,可作为IA预后的预测因子,为IA治疗提供新的靶点。Yang等[31]表明,IA患者中miR-126的表达水平显著高于正常组,对IA的诊断具有较高的临床价值,miR-126高表达患者病灶大于10 mm的患者数量多,提示miR-126与患者病灶大小有关,推测miR-126的表达增加促进血管生成并扩大病灶。VEGF是血管生成的重要因素,miR-126为其上游调控基因[32],推测VEGF与IA密切相关。本研究显示,破裂组患者外周血中miR-29a和miR-126的表达水平增加,且为IA破裂的独立危险因素。但miR-29a和miR-126联合检测对IA破裂的临床预测价值低于IA形态危险因素动脉瘤长径、AR、形状不规则的联合检测和血流动力学危险因素WSSA和LSQR的联合检测,推测其原因可能为miRNA的影响因素较多,特异性较差。
AR、SR和IA的形态不规则均为影响IA破裂的独立危险因素。研究[33]显示,AR不仅可量化IA的不规则形态,亦是IA破裂的重要预测因素。AR值较大的IA腔内血流速度缓慢,血流涡流时间较长,使血管内皮细胞缺处于缺氧状态,加剧了瘤腔内血管内皮细胞的损害,促使IA破裂。SR将IA的几何形态与IA的局部几何学相结合,反映IA相对于载瘤血管的突出程度,解决了单纯比较IA大小的问题[33]。形态不规则对IA破裂的预测具有更直观、更潜在的价值,不规则IA破裂的风险更大[34]。亦有大样本研究[35]显示,形态不规则IA破裂的风险明显大于形态规则的IA。本研究结果证实了AR、SR和IA的形态不规则为IA破裂的独立危险因素。IA的破裂与血流动力学参数息息相关。本研究显示,WSSA、LSQR为IA破裂的独立危险因素,与多项研究[36-37]结果相一致。IA形态学参数和血流动力学参数为影响IA破裂的直接影响因素,对IA破裂的预测价值较大,具有一定的临床使用价值。
综上所述,AR、SR和IA形态不规则的联合检测和WSSA、LSQR联合检测对IA破裂的预测价值高于miR-29a和miR-126联合检测,具有较高的临床预测价值。随着IA夹闭术和栓塞术的不断改进以及操作者对手术的熟练程度和手术器械的更新,可能对IA破裂产生影响,本文未对以上因素进行分析,可能对研究结果造成一定的误差。

