南极磷虾肽对高尿酸血症小鼠脂代谢的改善及作用机制❋
王庆慧, 蔡维震, 姚 蔓, 王 若, 傅安妮, 王静凤❋❋
(1. 中国海洋大学食品科学与工程学院, 山东 青岛 266003; 2. 中国人民解放军95958部队, 上海 200120)
高尿酸血症(Hyperuricemia, HUA)是因血清尿酸(Uric acid, UA)过度升高导致的系统性疾病[1]。流行病学研究表明,中国沿海地区HUA的发病率已高达20%[2],其中60%的HUA患者会出现脂代谢紊乱[3-4]。高尿酸已被认为是高脂血症的独立危险因素[5-6]。抗HUA药物和降血脂药物的组合虽能同时降低血清UA和脂质水平,但仍存在肝损伤、肾纤维化、肾结石等不良反应[7],因此针对HUA和脂代谢异常的安全、有效的治疗仍然是目前研究的重点。
南极磷虾(Euphausiasuperba)是生活在南极海域的一种甲壳类浮游动物,全球储量上亿吨,尚待大量开发、利用[8]。南极磷虾富含蛋白质,且生物价值优于肉类和牛奶[9-10]。本课题组已初步证实,来源于南极磷虾的活性肽(Peptides from Antarctic krill, AKP)具有降UA[11]和加速软骨内骨化过程、促进骨折小鼠愈合[12]的功效。但作为HUA并发症的脂代谢异常,AKP对其是否有作用尚不清楚。因此,本文以HUA小鼠为研究对象,探究AKP对其脂代谢改善效果和作用机制,以期为AKP的高值化利用提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
8周龄健康(SPF级)Balb/c小鼠,雄性,体质量(22.0±2.0)g,购于北京维通利华实验动物技术公司,动物合格证号:SCXK(京)2014—0001。所有动物实验程序均符合中国海洋大学食品科学与工程学院动物伦理委员会的政策(批准号:SPXY2015012)。
脱脂南极磷虾粉购于辽宁省大连海洋渔业集团,用于制备AKP。
甘油三酯(TG)、总胆固醇(TC)、腺苷脱氨酶(ADA)普通试剂盒购于南京建成生物工程研究所;尿酸(UA)、黄嘌呤氧化酶(XO)ELISA试剂盒购于苏州卡尔文生物科技有限公司;氧嗪酸钾(PO)购于上海阿拉丁生化科技股份有限公司;酵母浸粉购于北京普纳德科技有限公司;目的基因引物由上海生工生物工程公司合成;其他试剂均为国产分析纯试剂。
1.2 仪器与设备
GL-20M高速冷冻离心机购自上海卢湘仪离心机仪器公司,1100型液相色谱仪购自美国Agilent公司,Model 680型酶标仪购自美国Bio-Rad公司,Light Cycler 480型Real-time PCR购自瑞士Roche公司,Tanon-520型全自动化学发光成像分析系统购自上海天能科技有限公司。
1.3 方法
1.3.1 高嘌呤饲料的配制 以25%酵母浸粉和75%基础饲料配制高嘌呤饲料。
1.3.2 南极磷虾肽的制备 根据薛长湖[13]的方法,将10 g脱脂南极磷虾粉与水按1∶10(m/v)配成均匀溶液,将pH调至7.5,加入2%中性蛋白酶,50 ℃酶解6 h,沸水浴灭酶,在4 500 r/min(离心力2 248g)下离心20 min取上清。采用30 mL 0.3 mol/L盐酸脱氟,静置后在4 500 r/min(离心力2 248g)下离心20 min,取上清,喷雾干燥即得AKP。其中AKP分子量为400~2 000 Da,蛋白质含量为85.4%,氟含量为1.66 mg/kg[12]。
1.3.3 动物模型建立、分组及实验 40只雄性Balb/c小鼠适应性喂养3 d后,采用高嘌呤饮食联合腹腔注射PO建立HUA小鼠模型[11]。除正常组(N组,n=8)饲喂普通饲料,腹腔注射生理盐水,其余组饲喂高嘌呤饲料,隔天腹腔注射PO(200 mg·kg-1),造模21 d后,随机分为模型组(M组,0.85%生理盐水)、阳性药组(P组,7.5 mg·kg-1非布司他)、AKP低、高剂量组(AKP-L和AKP-H,450和900 mg·kg-1),n=8。持续造模并干预30 d后,单只收集尿液、粪便。于末次给药后,禁食不禁水12 h,摘眼球取血,分离血清于-20 ℃保存。仔细剥离肝脏,每只各取0.1 g置于液氮中保存备用。
1.3.4 血清UA和血清、肝脏、粪便中TG、TC测定 按试剂盒说明测定血清UA和血清、肝脏、粪便中TG、TC含量。参照Folch[14]的方法,取0.1 g肝脏以1 mL氯仿-甲醇混合溶液(2∶1,v/v)提取肝脏脂质。参照Evrard[15]的方法,取0.1 g粪便以4 mL 95%乙醇提取粪便脂质。
1.3.5 肝脏组织XO及ADA活力测定 肝脏匀浆上清制备:取0.1 g肝脏,用冰冷生理盐水制成10%匀浆,在8 500 r/min(离心力8 020g)、4 ℃下离心15 min取上清,分别按照ELISA试剂盒和普通试剂盒说明检测XO和ADA酶活。
1.3.6 qRT-PCR分析 采用Trizol法提取肝脏总RNA,将RNA逆转录成cDNA,以cDNA为模板,进行qPCR扩增,反应条件为:95 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸15 s,变性、退火、延伸共35个循环;最后72 ℃再延伸10 min。以β-actin作为内参基因,基因相对表达量以目的基因与内参基因的表达量之比表示。所用目的基因引物序列如表1所示。

表1 目的基因的引物序列
1.3.7 Western Blot分析 采用RIPA裂解液提取肝脏组织总蛋白。肝脏蛋白经10%SDS-PAGE电泳,电泳条件为:恒压80 V,电泳3 h。随后电转至PVDF膜,5%脱脂奶粉封闭2 h,加入4 mL稀释的一抗(1∶1 000)于4 ℃孵育过夜。TBST洗涤3次后,加入4 mL稀释的二抗(1∶2 000)于室温孵育2 h后,TBST洗涤3次,采用发光试剂盒发光,化学发光成像仪对底片曝光、显影、定影拍照,使用Image J软件进行定量,以β-actin作为内参蛋白,蛋白相对表达量以目的蛋白与内参蛋白的表达量之比表示。
1.3.8 统计学分析 实验结果均以平均值±标准差表示,使用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),以P<0.05为具有统计学上的显著差异。
2 结果
2.1 AKP降低HUA小鼠血清UA、肝脏XO和ADA表达
血清UA含量是临床判断HUA的决定性因素。如图1a所示,与正常组相比,模型组血清UA升高46.60%(P<0.01),而AKP低、高剂量组较模型组分别降低了血清UA水平17.45%、25.16%(P<0.01),这表明AKP具有改善HUA的功效。
XO和ADA是黄嘌呤、次黄嘌呤及腺苷转化为尿酸的限速酶。如图1b所示,AKP低、高剂量组的XO和ADA酶活较模型组均显著降低(P<0.01),这表明AKP能抑制尿酸生成酶活性来减少UA的生成,从而降低血清UA水平。

(##:P<0.01,与正常组比较;**:P<0.01,与模型组比较。N为正常组,M为模型组,P为阳性药组,AKP-L为AKP低剂量组,AKP-H为AKP高剂量组,XO为黄嘌呤氧化酶,ADA为腺苷脱氨酶,n=8。##:P<0.01, versus normal group; **:P<0.01, versus model group. The N represents normal group, the M represents model group, the P represents positive group, the AKP-L represent AKP low group, AKP-H represent AKP high group, the XO represents xanthine oxidase, the ADA represents adenosine deaminase, n=8.)
2.2 AKP降低HUA小鼠脂质水平
HUA对脂代谢的影响直观的反映在血清、肝脏和粪便中。如图2所示,与正常组相比,模型组血清TG、TC显著降低(P<0.01),肝脏TG、TC显著升高(P<0.01),粪便TG、TC显著降低(P<0.01)。经AKP干预后,HUA小鼠体内TG、TC生成减少,排泄增加,脂质水平显著改善。以上结果表明,AKP可有效控制HUA小鼠体内脂质水平,调节因HUA导致的脂代谢紊乱。
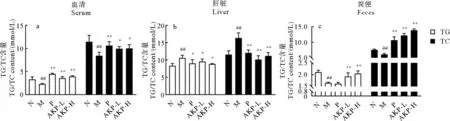
(##:P<0.01,与正常组比较;*:P<0.05,**:P<0.01,与模型组比较。N为正常组,M为模型组,P为阳性药组,AKP-L为AKP低剂量组,AKP-H为AKP高剂量组,n=8。##:P<0.01 versus normal group; *:P<0.05, **:P<0.01 versus model group.The N represents normal group, the M represents model group, the P represents positive group, the AKP-L represent AKP low group, the AKP-H represent AKP high group, n=8.)
2.3 AKP降低NLRP3、caspase1蛋白表达
UA作为信号分子,能诱导NLRP3表达,引起下游炎症反应。由图3可知,经AKP干预后,NLRP3、caspase1表达较模型组均有所降低,分别下降了21.57%和24.44%(P<0.01)。上述结果表明,AKP能在翻译水平上抑制HUA小鼠NLRP3及其下游效应蛋白caspase1的表达。
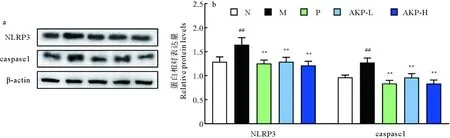
(##:P<0.01,与正常组比较;**:P<0.01,与模型组比较。N为正常组,M为模型组,P为阳性药组,AKP-L为AKP低剂量组,AKP-H 为AKP高剂量组,NLRP3为炎症小体(NOD)样受体蛋白3,caspase1为半胱天冬酶-1,n=3。##:P<0.01 versus normal group; **:P<0.01 versus model group. The N represents normal group, the M represents model group, the P represents positive group, the AKP-L represent AKP low group, the AKP-H represent AKP high group, the NLRP3 represents NOD-like receptor protein 3, the caspase1 represents cysteinyl aspartate specific proteinase, n=3.)
2.4 AKP抑制HUA小鼠肝脏脂肪酸合成
SREBP-1c是脂肪酸合成的关键蛋白;ACC1催化丙二酰辅酶A的合成,充当脂肪酸合成中的碳源;FAS催化CoA和丙二酰辅酶A合成棕榈酸盐,并调节脂肪酸链长;SCD1是催化C16∶0和C18∶0分别转化为C16∶1和C18∶1的关键限速酶。如图4a所示,与正常组相比,模型组SREBP-1c蛋白表达提高了34.50%(P<0.01),经AKP干预后,AKP低、高剂量组均能显著降低SREBP-1c蛋白表达(P<0.01)。如图4b所示,与模型组相比,AKP剂量组的肝脏SREBP-1c基因表达量也显著下降(P<0.01)。作为其靶基因的ACC、FAS和SCD1基因表达表现出了相同的变化趋势,表明AKP可通过降低HUA小鼠肝脏SREBP-1c的基因和蛋白表达,从而降低脂肪酸合成相关基因的表达,抑制脂肪酸合成。

(##:P<0.01,与正常组比较;*:P<0.05,**:P<0.01,与模型组比较。N为正常组,M为模型组,P为阳性药组,AKP-L为AKP低剂量组,AKP-H为AKP高剂量组,SREBP-1c为固醇调节元件结合蛋白-1c,SREBP-1c为编码SREBP-1c蛋白的基因,ACC为编码乙酰辅酶A羧化酶的基因,FAS为编码脂肪酸合成酶的基因,SCD1为编码硬脂酰辅酶A去饱和酶1的基因,n=3。##:P<0.01 versus normal group; *:P<0.05, **:P<0.01 versus model group. The N represents normal group, the M represents model group, the P represents positive group, the AKP-L represent AKP low group, the AKP-H represent AKP high group, the SREBP-1c represents sterol-regulatory elementary binding protein-1c, SREBP-1c is the gene encoding SREBP-1c protein, ACC is the gene encoding acetyl-CoA carboxylase, FAS is the gene encoding fatty acid synthase, and SCD1 is the gene encoding stearoyl-CoA desaturase 1, n=3.)
2.5 AKP促进HUA小鼠肝脏脂肪酸β氧化
PPARα是脂肪酸β氧化的首要转录调节因子;CPT1是一种负责将长链脂肪酰辅酶A转移到线粒体的限速酶;而在线粒体基质内,CPT2能将酰基从酰基肌苷转移回CoA,从而实现β-氧化;ACOX是启动长链脂肪酸氧化过程的关键酶。如图5a所示,模型组PPARα蛋白降低了25.39%(P<0.01),表明HUA小鼠肝脏脂肪酸β氧化受到抑制。如图5b所示,AKP剂量组较模型组均能显著提高PPARα及其下游靶基因CPT-1、CPT-2和ACOX的 mRNA表达(P<0.01),这表明AKP可在转录和翻译水平上促进HUA小鼠PPARα及其靶基因的表达,刺激肝脏脂肪酸β氧化,减少肝脂堆积。

(##:P<0.01,与正常组比较;*:P<0.05,**:P<0.01,与模型组比较。N为正常组,M为模型组,P为阳性药组,AKP-L为AKP低剂量组,AKP-H为AKP高剂量组,PPARα为过氧化物酶体增殖物激活受体,PPARα为编码PPARα蛋白的基因,CPT-1/2为编码肉碱棕榈酰转移酶1/2的基因,ACOX为编码酰基辅酶A氧化酶的基因,n=3。##:P<0.01 versus normal group; *:P<0.05, **:P<0.01 versus model group. The N represents normal group, the M represents model group, the P represents positive group, the AKP-L represent AKP low group, the AKP-H represent AKP high group, the PPARα represents peroxisome proliferators-activated receptors α, PPARα is the gene encoding PPARα protein, CPT-1/2 is the gene encoding carnitine palmitoyl transferase-1/2, and ACOX is the gene encoding acyl-CoA oxidase, n=3.)
3 讨论
本研究前期测定AKP、沙丁鱼肽、金枪鱼肽等海洋肽体外XO抑制活性,发现AKP效果最佳,动物实验也表明AKP具有降UA的功效[11]。因此,本文进一步探究AKP对HUA小鼠脂质水平的作用,证实了其改善效果,且作用机制与抑制NLRP3炎症小体表达有关。
活性肽能显著促进体内脂质排泄。Lee等[16]研究发现酪蛋白水解物能升高高脂血症小鼠肠道ABCG5表达,促进胆固醇分泌来降低血清胆固醇水平。亲水性胆盐在肠道维持胆固醇稳态中发挥着重要作用,它能激活FXR表达,促进肠腔内胆固醇排泄[17]。上述研究与本文的研究结果一致,AKP作为一种高活性的海洋生物肽,能促进TC、TG排泄,改善因HUA引起的脂代谢紊乱,其作用机制可能与肠道中ABCG5的表达、以及胆汁酸对FXR的调控作用有关。
大量研究表明HUA小鼠会出现肝脂沉积、血脂异常情况[18]。尿酸作为信号分子,能激活NLRP3炎症体[19],影响脂质生成和代谢。Wan等[20]发现UA激活NLRP3后,导致IL-1β和IL-18的产生和分泌,促进肝细胞脂质堆积。不仅如此,有研究[21]表明抑制NLRP3和caspase1表达可恢复果糖诱导的肝细胞中SREBP-1c、PPARα、CPT-1等脂肪酸代谢关键因子的转录水平。脂质合成关键蛋白SREBP-1c能调控下游基因参与到脂肪酸的合成中。而PPARα作为脂肪酸β氧化的首要转录调节因子,不仅可以调控下游CPT-1和CPT-2催化脂肪酸进入线粒体中,还可调控ACOX促进过氧化物酶体脂肪酸β氧化[22]。本文对AKP改善因HUA引起的脂代谢紊乱的作用机制研究发现,AKP能显著抑制NLRP3和caspase1的表达,从而调控脂肪酸合成关键蛋白SREBP-1c和脂肪酸β氧化关键蛋白PPARα的表达,降低HUA小鼠的脂质水平。
4 结语
本研究构建了HUA动物模型,探究AKP对HUA小鼠体内脂代谢紊乱的作用及机制。结果表明,首先AKP能显著降低HUA小鼠体内尿酸含量和脂质水平;其次AKP能通过下调UA-NLRP3炎症小体通路,抑制脂肪酸合成,促进脂肪酸β氧化,从而减少体内TG、TC累积。本研究首次证实了AKP对HUA小鼠脂代谢的改善作用,同时从营养干预的角度为改善HUA引起的脂代谢异常提供了一种天然、有效、价廉的新型治疗方法。

