铁筷子挥发油对慢性脑缺血致血管性认知功能障碍大鼠的作用及机制研究
丁晓丽,薛丁嘉,邓万娟,韩彩瑶,刘晓龙,李 媛,钱海兵*
铁筷子挥发油对慢性脑缺血致血管性认知功能障碍大鼠的作用及机制研究
丁晓丽1, 2, 3,薛丁嘉1, 2,邓万娟1, 2,韩彩瑶1, 2,刘晓龙1, 2,李 媛1,钱海兵1, 2*
1. 贵州中医药大学,贵州 贵阳 550025 2. 贵州省中医药方证药理研究特色重点实验室,贵州 贵阳 550025 3. 龙岩市中医院,福建 龙岩 364030
探究苗药铁筷子[腊梅及山腊梅的干燥根]挥发油对慢性脑缺血(chronic cerebral hypoperfusion,CCH)致血管性认知功能障碍(vascular cognitive impairment,VCI)大鼠的作用及机制。采用改良的双侧颈总动脉结扎(bilateral common carotid artery occlusion,BCCAO)法建立CCH模型,将造模成功大鼠随机分为模型组及铁筷子挥发油高、中、低剂量(80、40、20 mg/kg)组和丁苯酞(63 mg/kg)组,另设假手术组,给予相应药物干预28 d,采用水迷宫实验检测各组大鼠学习记忆能力;采用旷场实验、Y迷宫实验检测各组大鼠自主活动性和新奇事物探索能力;采用苏木素-伊红(HE)染色、Nissl染色、TUNEL染色观察各组大鼠大脑皮层及海马CA1区神经细胞结构变化、尼氏小体以及凋亡细胞数量变化;采用ELISA法检测各组大鼠血清中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)水平;采用比色法检测各组大鼠海马组织中乙酰胆碱酯酶(acetylcholinesterase,AChE)和乙酰胆碱转移酶(cholineacetyltransferase,ChAT)的活性;采用Western blotting法检测各组大鼠海马组织中BDNF、酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)、磷酸化TrkB(phosphorylated TrkB,p-TrkB)、磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase,PI3K)、蛋白激酶B(Akt)、p-Akt和半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)蛋白表达。与模型组比较,铁筷子挥发油组大鼠逃避潜伏期缩短(<0.05、0.01),穿越平台次数和跨格次数提高(<0.05、0.01),在新异臂所待时间延长(<0.05);神经细胞结构的变性得到改善,脑组织中尼氏小体的数量提高(<0.05),细胞凋亡减少(<0.05);血清中BDNF水平及海马组织中ChAT活性升高(<0.05、0.01),海马组织中AChE活性降低(<0.05);海马组织中BDNF、TrkB、p-TrkB、PI3K和p-Akt蛋白表达水平均显著升高(<0.05、0.01),Caspase-3蛋白表达水平降低(<0.05)。苗药铁筷子挥发油可以改善CCH致VCI大鼠认知功能障碍,其作用机制可能与激活BDNF/TrkB/PI3K/Akt信号通路有关。
铁筷子挥发油;慢性脑缺血;血管性认知功能障碍;脑源性神经营养因子;酪氨酸激酶受体B;磷脂酰肌醇-3-激酶/蛋白激酶B信号通路
慢性脑缺血(hronic cerebral hypoperfusion,CCH)是脑内血流量降低的一种病理状态,其中CCH所致的血管性认知功能障碍(vascular cognitive impairment,VCI)是诱发血管性痴呆的主要危险因素[1]。VCI的严重程度与脑内血流灌注不足呈正相关,反映了从轻度认知功能障碍到严重痴呆的整个发展进程,若长期发展即可导致缺血性脑卒中、阿尔茨海默病、Binswanger病等脑血管疾病的发生[2]。因此及时干预并治疗VCI是十分必要的。研究表明脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)/酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)信号通路与脑内神经元增殖、分化、存活以及神经递质释放密切相关,其下游磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路对神经元细胞的存活有明显的促进作用[3-4]。许多中药挥发油如益智仁挥发油、辛夷挥发油、当归挥发油、桂枝汤挥发油等在改善认知障碍方面具有潜在优势,能够提高学习记忆能力[5-8]。苗药铁筷子是腊梅科腊梅属植物腊梅(L.) Link及山腊梅Oliv.的干燥根,味辛性温,具有祛风止痛、理气活血的功效,其提取的挥发油气辛香,芳香疗法已被证实可以通过嗅觉的刺激改善认知障碍,且挥发油较易通过血脑屏障,其中含量前3的为蓖麻油酸、棕榈酸、油酸,多为不饱和脂肪酸,不饱和脂肪酸在脑血管方面的治疗中有显著疗效[9]。本课题前期研究表明,铁筷子挥发油具有极强的抗炎作用,之后又对其同属植物山腊梅叶的挥发油进行研究,发现其对痴呆大鼠的认知记忆具有明显改善作用[10-11]。因此本研究采用改良的双侧颈总动脉永久结扎(bilateral common carotid artery occlusion,BCCAO)法建立CCH大鼠模型,水迷宫筛选出CCH致VCI大鼠,探究苗药铁筷子挥发油对CCH致VCI大鼠的认知功能障碍的改善作用及机制。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量280~300 g,8周龄,由长沙市天勤生物技术有限公司提供,动物许可证号SCXK(湘)2019-0014,动物合格证号No. 430726200100285985。动物实验经贵州中医药大学实验动物伦理审查委员会批准(批准号20210056)。
1.2 药材
苗药铁筷子购自贵阳万东桥药材市场,经贵州中医药大学药学院刘晓龙博士鉴定为腊梅科腊梅属植物腊梅(L.) Link的干燥根。
1.3 药品与试剂
丁苯酞软胶囊(批号1182005116)购自石药集团恩必普药业有限公司;苏木素-伊红(HE)染色试剂盒(批号20190929)、Nissl染色试剂盒(批号20210712)、BCA蛋白定量试剂盒(批号20210717)、牛血清白蛋白(批号212D051)购自北京索莱宝科技有限公司;TUNEL细胞凋亡检测试剂盒(批号030521210615)购自上海碧云天生物技术有限公司;Omni-EasyTM一步法PAGE凝胶快速制备试剂盒(批号02561150)、Omni-ECL超灵敏化学发光检测试剂盒(批号02581060)购自上海雅酶生物医药科技有限公司;乙酰胆碱转移酶(choline acetyltransferase,ChAT)试剂盒(批号20210816)、乙酰胆碱酯酶(acetylcholinesterase,AChE)检测试剂盒(批号20210806)购自南京建成生物工程研究所;BDNF试剂盒(批号6C3GRQT3BJ)购自武汉伊莱瑞特生物科技股份有限公司;HRP标记的山羊抗兔IgG抗体(批号AA16201)购自南京巴傲得生物科技有限公司;β-actin抗体(批号00097048)购自美国Protrintech公司;BDNF抗体(批号3507448002)购自武汉爱博泰克生物科技有限公司;磷酸化TrkB(phosphorylated TrkB,p-TrkB)抗体(批号4621T)、p-Akt兔多克隆抗体(批号9018T)购自美国CST公司;TrkB抗体(批号GR3360045-3)、PI3K抗体(批号GR277867-1)、Akt抗体(批号GR240003-94)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号GR3241586-3)购自英国Abcam公司。
1.4 仪器
DRT-TW型电热套(郑州长城科工贸有限公司);JJ224B型电子天平(常熟市双杰测试仪器厂);DNS-2型Morris水迷宫设备(中国医学科学院药物研究所);SMART 3.0旷场实验设备、Y型迷宫实验设备(美国Panlab公司);YZB/0009-2003型组织包埋机、RM2265型组织切片机(浙江省金华市科迪仪器设备有限公司);SLK-O3000-S型摇床(美国Scilogex公司);XH-D型涡旋混合器(江苏天翎仪器有限公司);XK-400型低温高速离心机(江苏新康医疗器械有限公司);DKZ-2型电热恒温水槽(上海精宏试验设备有限公司);EPS300型电泳仪、VE-180型电泳槽(上海天能科技有限公司);InfiniteM200型酶标仪(北京新风机电技术公司);ChemiDocTMTouch超灵敏多功能化学发光成像系统曝光机(美国Bio-Rad公司)。
2 方法
2.1 铁筷子挥发油的制备
取粉碎的铁筷子药材100 g,置2 L圆底烧瓶中,加入10倍量水,浸泡过夜,采用水蒸气蒸馏法制备,取所得挥发油,经无水硫酸钠干燥,置于棕色玻璃瓶中备用,所得铁筷子挥发油为淡黄色油状物,具辛香气味,提取率为0.8%。参照高源等[12]提取方法,经气相色谱-质谱检测发现黔产铁筷子挥发油中主要成分为棕榈酸,质量分数为38.496%,其余主要成分为亚油酸16.996%、油酸14.586%、α-杜松醇9.028%、氧化石竹烯5.654%。
2.2 动物造模及筛选
采用改良的BCCAO方法进行造模[13],大鼠ip 20%乌拉坦(6 mL/kg)麻醉,颈部备皮、消毒,在颈部左侧处皮肤做纵向切口,分离左侧颈总动脉,用4-0手术尼龙线结扎颈总动脉的近心端和远心端,并用眼科剪在中间剪断,随后逐层缝合,碘伏消毒;1周后,在右侧进行同样的操作。假手术组不结扎双侧颈总动脉,其余操作与造模大鼠保持一致。造模1周后,使用水迷宫实验筛选造模成功大鼠,以假手术组大鼠逃避潜伏期均值为参考值,若造模大鼠的逃避潜伏期与假手术组大鼠逃避潜伏期之差占该鼠逃避潜伏期的比例>20%则定为造模成功的CCH致VCI大鼠[14]。
2.3 分组及给药
将造模成功大鼠随机分为模型组及铁筷子挥发油高、中、低剂量(80、40、20 mg/kg)组和丁苯酞(63 mg/kg)组,每组12只。各给药组ig相应药物(5 mL/kg),假手术组和模型组ig等体积蒸馏水,1次/d,共28 d。给药结束后,每组随机选取8只大鼠进行后续行为学和生化检测,剩余4只大鼠进行病理组织检测。
2.4 行为学检测
2.4.1 Morris水迷宫实验
(1)定位航线实验:实验开始的时候,将安全岛放置在1个固定的象限即第II象限,将大鼠面向池壁放入水池,大鼠入水点顺序:第1天,I→II→III→IV;第2天,II→III→IV→I;第3天,III→IV→I→II;第4天,IV→I→II→III;第5天,I→II→IV→III。第1天为适应性训练不记录成绩,后4天记录大鼠在120 s内,从不同入水点爬上平台消耗的时间,即逃避潜伏期。若大鼠在120 s内爬上平台,则让大鼠在平台停留15 s;若大鼠在120 s内未能找到平台,则可以适当引导大鼠爬上平台并停留15 s,逃避潜伏期相应地记录为120 s[15]。
(2)空间探索实验:在定位航行实验第6天,撤除安全岛平台,将大鼠从IV象限面向池壁放入水中,记录大鼠2 min内跨越原平台位置的次数。
2.4.2 旷场实验 将大鼠放入箱内底面中心,观察大鼠在5 min内的行为变化情况及其探索轨迹。每只动物检测结束后,需用酒精擦拭整个箱子,避免本次检测对下一只动物的影响与干扰。
2.4.3 Y迷宫实验 使用隔板封闭新异臂,让大鼠在另外2个臂中自由探索8 min,大鼠初进迷宫时所在的臂为起始臂,另一臂称为其他臂,2 h后移开隔板,让大鼠在3个臂中自由探索10 min,记录并比较大鼠在各个臂中停留的时间[16]。
2.5 取材
行为学测试完成后,麻醉大鼠,打开大鼠腹腔,分离腹主动脉,以7号采血针配合5 mL真空红帽采血管进行取血,静置分离血清,分装于EP管中,置于−80 ℃保存备用,取血完毕后迅速转移至冰上取脑,分离海马,置于−80 ℃保存,用于后续检测;剩余的4只大鼠对其进行灌注取脑,固定于4%多聚甲醛中用于后续病理组织检测。
2.6 HE染色观察皮层及海马CA1区神经细胞形态变化
脑组织于4%多聚甲醛固定48 h后,切取视交叉至乳头体之间的部分,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(厚度为5 μm),脱蜡至水,苏木素染色5 min,分化10 s,伊红染色1 min,封片,于显微镜下观察神经细胞形态。
2.7 Nissl染色观察皮层及海马CA1区尼氏小体数量
取“2.6”项下制备的脑组织切片,脱蜡至水,滴染亚甲蓝染色液10 min,分化1 min,钼酸铵溶液处理5 min,封片,于显微镜下观察尼氏小体数量,采用Image Lab软件计数。
2.8 TUNEL染色观察皮层及海马CA1区神经细胞凋亡情况
取“2.6”项下制备的大鼠脑组织切片,脱蜡至水,加入蛋白酶K作用30 min,加入封闭液孵育20 min,滴加生物素标记液,37 ℃避光孵育60 min;滴加Streptavidin-HRP工作液,室温孵育30 min;滴加DAB显色,苏木素染色1 min,封片,于显微镜下观察神经细胞凋亡情况,采用Image Lab软件计数。
2.9 血清中BDNF水平及海马组织中AchE、ChAT活性的检测
取各组大鼠血清,按ELISA试剂盒说明书测定血清中BDNF水平;取各组大鼠海马组织,匀浆后,采用比色法测定海马组织中AChE和ChAT活性。
2.10 Western blotting检测海马组织中BDNF、TrkB、p-TrkB、PI3K、Akt、p-Akt和Caspase-3的蛋白表达
取各组大鼠海马组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,在组织研磨仪中研磨,取上清,采用BCA蛋白定量试剂盒测定蛋白质量浓度,加入Loading Buffer,100 ℃煮沸使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%牛血清白蛋白中封闭1 h,分别加入BDNF抗体(1∶500)、TrkB抗体(1∶5000)、p-TrkB抗体(1∶1000)、PI3K抗体(1∶1000)、Akt抗体(1∶5000)、p-Akt抗体(1∶1000)、Caspase-3抗体(1∶2000)和β-actin抗体(1∶5000),4 ℃孵育过夜;TBST洗涤3次后,加入二抗(1∶10 000),孵育1 h,TBST洗涤后,加入显影液,于凝胶成像仪中显影。
2.11 统计学分析
3 结果
3.1 铁筷子挥发油对CCH致VCI大鼠行为学的影响
3.1.1 水迷宫实验 如图1-A、B和表1所示,与假手术组比较,模型组大鼠逃避潜伏期明显延长(<0.01),穿越平台次数明显减少(<0.05),表明经造模后大鼠学习记忆水平下降,产生认知障碍,造模成功;经过药物干预28 d后,与模型组比较,各给药组大鼠逃避潜伏期均显著缩短(<0.05、0.01),铁筷子挥发油中、高剂量组和丁苯酞组大鼠穿越平台次数明显升高(<0.05、0.01),表明铁筷子挥发油可以改善造模大鼠的学习记忆能力。
3.1.2 旷场实验 如图1-C和表2所示,与假手术组比较,模型组大鼠跨格次数明显减少(<0.01),垂直得分降低(<0.05);与模型组比较,铁筷子挥发油中剂量组和丁苯酞组大鼠跨格次数增加(<0.05、0.01),表明铁筷子挥发油可以改善大鼠自主活动性,提高探索能力。
3.1.3 Y迷宫 如图1-D和表3所示,与假手术组比较,模型组大鼠在新异臂探索时间缩短(<0.05),但在起始臂的停留时间延长(<0.05),在其他臂的停留时间无显著性差异,表明模型组大鼠对新奇事物的探索能力下降;与模型组比较,铁筷子挥发油中剂量组大鼠在新异臂的探索时间增加(<0.05),表明铁筷子挥发油可提高大鼠探索新奇事物的能力。
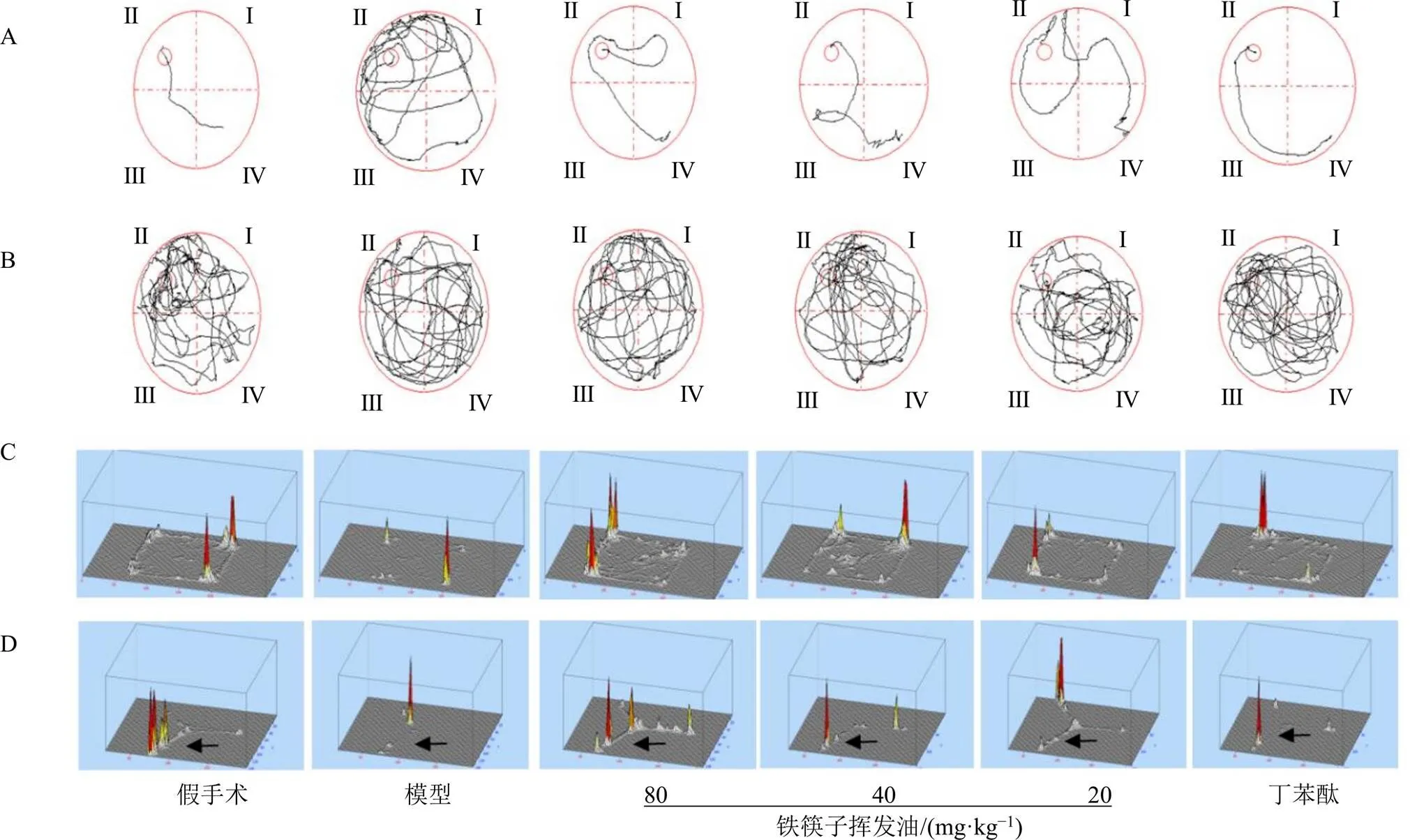
A-定位航线实验轨迹图 B-空间探索实验轨迹图 C-旷场实验活动轨迹三维立体图 D-Y迷宫活动轨迹三维立体图,箭头所指为新异臂
表1 铁筷子挥发油对CCH致VCI大鼠逃避潜伏期和穿越平台次数的影响(, n = 8)
Table 1 Effect of volatile oil of Chimonanthi Radix on escape latency and platform crossing times in rats with CCH-induced VCI (, n = 8)
组别剂量/(mg·kg−1)逃避潜伏期/s穿越平台次数/次 给药前给药后给药前给药后 假手术—29.37±9.3426.63±11.647.13±0.839.25±1.39 模型—101.37±37.73**68.25±18.16**4.75±2.86*5.00±1.41** 铁筷子挥发油80107.13±24.5030.87±17.60#4.12±1.888.00±3.02## 40106.25±27.2834.00±10.40##4.37±2.137.87±2.47# 20102.25±26.1048.13±24.49#4.62±2.264.75±2.37 丁苯酞63106.75±14.7333.13±12.04##4.50±1.698.75±2.05##
与假手术组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01,下表同
*< 0.05**< 0.01sham group;#< 0.05##< 0.01model group, same as below tables
表2 铁筷子挥发油对CCH致VCI大鼠跨格次数和垂直得分的影响(, n = 8)
Table 2 Effect of volatile oil of Chimonanthi Radix on number of grid crossing and vertical score in rats with CCH induced VCI (, n = 8)
组别剂量/(mg·kg−1)跨格次数垂直得分 假手术—49.60±12.5313.50±5.26 模型—26.12±9.90**8.12±2.90* 铁筷子挥发油8026.87±13.076.87±4.15 4051.62±17.88##10.87±5.02 2035.12±17.038.62±2.72 丁苯酞6343.75±10.68#8.12±2.90
3.2 铁筷子挥发油对CCH致VCI大鼠大脑皮层及海马CA1区神经细胞形态的影响
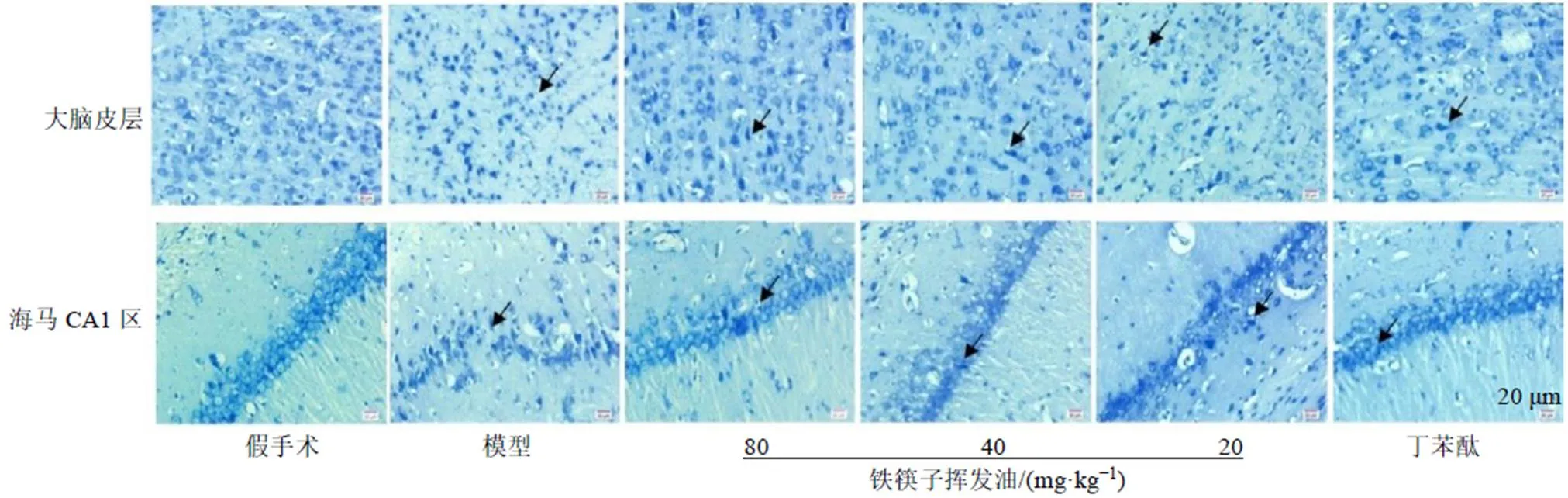
如图2所示,假手术组大鼠皮层神经元细胞结构完整,类圆形,边界清晰、可见核仁,海马CA1区细胞结构排列紧密、整齐;与假手术组比较,模型组大鼠细胞结构变性,有些固缩成梭形、三角形,核仁消失,出现空泡,海马区神经细胞排列疏松;与模型组比较,铁筷子挥发油高、中剂量组细胞结构改善,只见少量的细胞固缩,海马区细胞排列较为整齐,表明铁筷子挥发油对神经细胞结构的变性有一定的修复作用。
表3 铁筷子挥发油对CCH致VCI大鼠新异臂探索时间的影响(, n = 8)
Table 3 Effect of volatile oil of Chimonanthi Radix on exploration time of new arm in rats with CCH-induced VCI (, n = 8)
组别剂量/(mg·kg−1)新异臂探索时间/%起始臂探索时间/%其他臂探索时间/% 假手术—56.32±15.9715.70±9.1227.35±21.78 模型—25.15±11.94*35.40±23.03*23.48±17.21 铁筷子挥发油8032.50±16.5431.56±19.2825.93±12.64 4049.66±20.92#23.90±10.8426.27±12.70 2022.92±18.1327.30±29.0333.47±29.35 丁苯酞6339.76±27.9839.76±19.6324.02±12.23

箭头指示神经细胞固缩
3.3 铁筷子挥发油对CCH致VCI大鼠大脑皮层及海马CA1区尼氏小体数量的影响
如图3和表4所示,假手术组大鼠皮层及海马CA1区尼氏小体数量丰富,海马CA1区细胞层数多,尼氏小体间排列紧密、整齐;与假手术组比较,模型组大鼠皮层及海马中尼氏小体丢失严重,海马CA1区细胞呈散落状,细胞间距增大,尼氏小体数量明显减少(<0.01);与模型组相比,铁筷子挥发油高剂量组皮层尼氏小体的数量明显增加(<0.05),铁筷子挥发油高、中剂量组和丁苯酞组海马CA1区尼氏小体数量明显增加(<0.05),且细胞排列较为紧密、有序,表明铁筷子挥发油可以提高脑组织中尼氏小体的数量,保护神经元细胞。
箭头指示尼氏小体溶解消失
表4 铁筷子挥发油对CCH致VCI大鼠大脑皮层及海马CA1区尼氏小体数量的影响(, n = 4)
Table 4 Effect of volatile oil of Chimonanthi Radix on number of Nissl bodies in cerebral cortex and hippocampal CA1 region in rats with CCH-induced VCI (, n = 4)
组别剂量/(mg·kg−1)尼氏小体数量 海马CA1区皮层 假手术—90.75±5.37195.00±16.83 模型—44.00±5.35**109.00±10.42** 铁筷子挥发油8058.00±4.39#156.50±22.64# 4054.50±7.04#117.00±19.88 2039.50±6.61108.00±12.35 丁苯酞6359.25±3.86#120.75±28.06
3.4 铁筷子挥发油对CCH致VCI大鼠大脑皮层及海马CA1区神经细胞凋亡的影响
如图4和表5所示,与假手术组比较,模型组大鼠皮层及海马CA1区中凋亡细胞数量明显增多,细胞凋亡率显著升高(<0.01);与模型组比较,铁筷子挥发油高、中剂量组和丁苯酞组大鼠皮层及海马CA1区细胞凋亡率均显著降低(<0.05),表明铁筷子挥发油可以抑制神经细胞凋亡,对神经元细胞具有保护作用。

箭头指示凋亡细胞
表5 铁筷子挥发油对CCH致VCI大鼠大脑皮层及海马CA1区神经细胞凋亡的影响(, n = 4)
Table 5 Effect of volatile oil of Chimonanthi Radix on neuronal apoptosis in cerebral cortex and hippocampal CA1 region in rats with CCH-induced VCI (, n = 4)
组别剂量/(mg·kg−1)细胞凋亡率/% 海马CA1区皮层 假手术—25.12±4.5030.37±5.85 模型—76.60±9.38**89.10±5.50** 铁筷子挥发油8040.28±3.10#55.32±4.54# 4054.28±3.02#74.28±9.36# 2080.59±4.0986.42±5.31 丁苯酞6350.67±5.34#65.12±9.97#
3.5 苗药铁筷子挥发油对CCH致VCI大鼠血清中BDNF水平及海马组织中AChE、ChAT活性的影响
如表6所示,与假手术组比较,模型组大鼠血清中BDNF水平和海马组织中ChAT活性均显著降低(<0.05),海马组织中AChE活性显著升高(<0.01);与模型组比较,铁筷子挥发油高剂量组和丁苯酞组大鼠海马组织中ChAT活性均显著升高(<0.05);铁筷子挥发油高、中剂量组和丁苯酞组大鼠血清中BDNF水平显著升高(<0.05、0.01),海马组织中AChE活性显著降低(<0.05),表明铁筷子挥发油可以通过提高血清中BDNF水平,调节海马组织中AChE和ChAT的活性而发挥作用。
表6 铁筷子挥发油对CCH致VCI大鼠血清中BDNF水平及海马组织中AChE、ChAT活性的影响(, n = 8)
Table 6 Effect of volatile oil of Chimonanthi Radix on BDNF level in serum and AChE, ChAT activities in hippocampus in rats with CCH-induced VCI (, n = 8)
组别剂量/(mg·kg−1)BDNF/(pg·mL−1)AChE/(U·mg−1)ChAT/(U·g−1) 假手术—319.20±72.810.373 8±0.057 3122.86±30.01 模型—182.92±52.44*0.538 9±0.135 9**77.73±20.21* 铁筷子挥发油80267.64±47.42#0.419 5±0.076 1#108.54±35.12# 40301.19±92.58##0.448 4±0.052 6#85.50±26.90 20202.17±58.530.504 4±0.101 680.86±16.71 丁苯酞63264.60±66.01#0.411 9±0.080 8#109.50±26.62#
3.6 铁筷子挥发油对CCH致VCI大鼠海马组织中BDNF、TrkB、p-TrkB、PI3K、Akt、p-Akt和Caspase-3蛋白表达的影响
如图5所示,与假手术组比较,模型组大鼠海马组织中BDNF、TrkB、p-TrkB、PI3K和p-Akt蛋白表达水平均显著降低(<0.05、0.01),Caspase-3蛋白表达水平显著升高(<0.01);与模型组比较,铁筷子挥发油高、中剂量组大鼠海马组织中BDNF和p-TrkB蛋白表达水平显著升高(<0.05、0.01),Caspase-3蛋白表达水平显著降低(<0.05);铁筷子挥发油高剂量组大鼠海马组织中TrkB、PI3K和p-Akt蛋白表达水平均显著升高(<0.05)。
4 讨论
人口老龄化是世界发展大势,2018年我国65岁及以上的老年人达到1.67亿,占我国总人口数的11.9%,预计2020—2035年中国老年人口将实现大幅增长[17]。CCH高发于中老年人群,当脑缺血发生时,脑灰质和脑白质产生缺血性损伤从而诱发VCI[18]。

A-假手术组 B-模型组 C-铁筷子挥发油高剂量组 D-铁筷子挥发油中剂量组 E-铁筷子挥发油低剂量组 F-丁苯酞组 与假手术组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
目前,常采用BCCAO法制备CCH模型,经BCCAO造模后,大鼠全血黏度中切、低切偏高,血浆黏度增加,出现血液流变学障碍,学习记忆能力受损[19]。大鼠具有Willis循环,与人类脑血管解剖较为接近,双侧颈总动脉结扎后大鼠可通过基底动脉和基底动脉环调节血流,逐渐形成侧枝循环所,产生一种慢性脑低灌注状态。但是一次性阻断会导致大鼠脑内血流量急性减少,与慢性低灌注的损伤不太吻合,且动物死亡率较高,因此本研究采用改良的BCCAO即间隔1周后结扎另一侧颈总动脉的方法制备CCH模型,来探究苗药铁筷子挥发油对CCH致VCI大鼠的作用及机制。
Morris水迷宫已被广泛用于评价啮齿类动物对空间位置感和方向感的学习、记忆能力。水迷宫可利用啮齿类动物怕水但善于游泳的天性迫使动物学习[20],本研究共进行2次水迷宫实验,第1次是通过与假手术组比较,筛选出具有学习、记忆障碍的CCH致VCI大鼠(即具有认知功能障碍的大鼠);第2次是给药后对各组大鼠学习记忆能力的检测,探究铁筷子挥发油对大鼠的学习记忆能力是否有改善作用,评价其对大鼠认知能力的影响。结果显示,造模后的大鼠逃避潜伏期明显延长,穿越平台次数降低,表明CCH可损害大鼠的学习记忆能力,导致VCI的产生;给药后,与模型组比较,各剂量铁筷子挥发油均可以缩短大鼠的逃避潜伏期,其中高、中剂量组还可提高大鼠的穿越平台次数。CCH诱导的VCI不仅体现在学习记忆方面,还有注意力、定向力和执行力方面的障碍[21],因此本研究还采用了旷场和Y迷宫2种行为学实验探究苗药铁筷子挥发油对CCH致VCI大鼠的作用,结果显示,铁筷子挥发油可以增加模型大鼠的跨格次数,提高大鼠对新异臂的探索能力。通过上述3种行为学检测,可以初步看出铁筷子挥发油可以改善CCH致VCI大鼠的学习记忆能力,提高大鼠探索能力以及提高其对新鲜事物的喜好。
长期的脑灌注不足极易对大脑皮层及海马产生影响,丁利静等[22]发现采用BCCAO构建的CCH大鼠皮层及海马中神经细胞损伤严重,发生了细胞结构的变性;牟静静[23]发现CCH致认知功能障碍的大鼠中,海马CA1区和额叶皮质神经元细胞出现大量脱失、组织结构紊乱,神经元细胞大量凋亡脱失。大脑皮层作为最高级的神经中枢,在外界信息的整理和翻译中发挥着重要的作用,一旦产生损伤会对日常的认知记忆产生影响。同样,海马更是记忆储存的重要场所,其中CA1区对缺血缺氧等损伤最为敏感,CA1区神经元的损伤、缺失也会造成记忆的损坏。HE染色结果表明,模型大鼠神经细胞结构发生改变,核仁消失,有些甚至固缩为梭形和三角形,海马中的神经细胞较假手术组排列稀疏、紊乱,表明皮层及海马中的神经细胞受损,也再次确认了CCH致VCI大鼠造模成功,而铁筷子挥发油可以修复皮层及海马中神经细胞的损伤。为了进一步探究神经细胞的损伤程度及铁筷子挥发油对脑组织的保护作用,又采用Nissl染色和TUNEL染色发现铁筷子挥发油可以抑制模型大鼠皮层及海马CA1区尼氏小体的减少和神经细胞的凋亡,从而产生神经保护作用。
BDNF主要在神经元和神经胶质中合成,低水平的BDNF与认知功能障碍高度相关,上调BDNF会对许多神经系统疾病产生有益的影响[24-25]。成熟的BDNF在脑内和外周血清中均有分布,其中在海马及大脑皮层中含量极高,大脑中的BDNF可通过血脑屏障进入外周血清,并与血清中BDNF的变化呈正相关。因此本研究首先通过ELISA法对大鼠血清中BDNF水平进行检测分析,发现模型组大鼠血清中BDNF水平显著下降,这也验证了CCH大鼠VCI产生的原因确与BDNF的减少有关,铁筷子挥发油可提高大鼠血清中BDNF水平。不仅如此,外源性BDNF还能提高胆碱能样神经元的功能,增加海马突触体释放乙酰胆碱(acetylcholine,Ach)[26]。已有研究表明BDNF对中枢胆碱能神经元有刺激生长作用,能促进背根神经节神经元突起向中枢生长,也可延长离体培养胚胎大鼠脑中膈胆碱能神经细胞的存活时间,并增加AChE和ChAT的活性[27]。因此本研究对大鼠海马组织中AChE、ChAT的活性进行检测,结果表明模型组大鼠海马组织中ChAT活性降低,AChE活性升高。ChAT是合成ACh的关键酶,AChE可酶解ACh,铁筷子挥发油可通过提高ChAT活性、降低AChE活性来协调ACh的平衡,改善认知功能的障碍。BDNF作为神经营养因子的一员,可通过一种特定的酪氨酸激酶受体即TrkB,在中枢神经系统(central nervous system,CNS)突触可塑性的形成和神经元细胞的存活中发挥着有益的作用[28]。通过激动剂或促突触分子级联(如蛋白激酶C-BDNF途径)激活BDNF/TrkB信号,可改善突触丧失和促进神经再生[29]。BDNF与TrkB结合后还可激活PI3K/Akt信号通路,PI3K/Akt信号通路在抑制神经细胞凋亡和促进神经元存活方面发挥着重要的作用[30-31],Akt磷酸化后可抑制Caspase,从而抑制细胞凋亡[32]。本研究通过检测BDNF/TrkB/PI3K/Akt信号通路相关蛋白表达来探究铁筷子挥发油改善CCH致VCI大鼠的作用机制,结果表明模型组大鼠海马组织中BDNF、TrkB、p-TrkB、PI3K和p-Akt蛋白表达水平较假手术组均显著降低,Caspase-3作为Caspase级联反应中最终的执行酶,其表达显著提高;铁筷子挥发油高剂量组可显著提高模型大鼠海马组织中BDNF、TrkB、p-TrkB、PI3K和p-Akt蛋白表达水平,降低Caspase3蛋白表达水平,表明铁筷子挥发油的治疗机制可能与激活BDNF/TrkB/PI3K/Akt信号通路有关。
综上所述,苗药铁筷子挥发油对CCH致VCI大鼠的认知功能有改善作用,其作用机制与改善神经细胞结构、提高脑中尼氏小体数量、抑制细胞凋亡、上调血清BDNF水平和海马组织ChAT活性、降低海马组织AChE活性有关,此外,还与激活BDNF/TrkB/PI3K/Akt信号通路有关。CCH作为一种低灌注状态,其不同时间段检测的结果也可能不同,因此若能将在不同时间段检测其相关细胞因子的含量,将为进一步深入研究铁筷子挥发油的作用机制提供基础,也为铁筷子挥发油在脑血管方面的应用提供方向。
利益冲突 所有作者均声明不存在利益冲突
[1] 高利. 慢性脑缺血中西医结合诊疗专家共识 [J]. 中国中西医结合杂志, 2018, 38(10): 1161-1167.
[2] Daulatzai M A. Cerebral hypoperfusion and glucose hypometabolism: Key pathophysiological modulators promote neurodegeneration, cognitive impairment, and Alzheimer’s disease [J]., 2017, 95(4): 943-972.
[3] 张薇薇, 苗玲. PI3K/Akt信号通路及其在神经疾病中的研究进展 [J]. 中风与神经疾病杂志, 2007, 24(6): 755-757.
[4] 朱金墙, 宋宛珊, 马妍, 等. PI3K/Akt信号通路与血管性痴呆的关系及中药干预作用研究进展 [J]. 中国实验方剂学杂志, 2016, 22(9): 223-229.
[5] 王虎平. 当归挥发油改善阿尔茨海默病模型大鼠学习记忆机制初探 [J]. 天然产物研究与开发, 2022, 34(5): 836-841.
[6] 马俊俏. 益智仁挥发油对学习记忆障碍小鼠的改善作用及机制研究 [D]. 武汉: 湖北中医药大学, 2019.
[7] 冉庆森, 战晓玲, 李晓东, 等. 桂枝汤挥发油的成分归属分析及其对认知障碍小鼠学习记忆的影响 [J]. 国际中医中药杂志, 2017, 39(5): 435-441.
[8] 贺利敏, 李光武, 王敏, 等. 辛夷挥发油经嗅觉通路改善自闭症模型昆明鼠学习记忆能力及其神经递质含量 [J]. 神经解剖学杂志, 2016, 32(4): 507-512.
[9] 靳凤云, 王祥培, 章誉, 等. 黔产铁筷子枝、叶部位挥发油化学成分气相色谱-质谱比较分析 [J]. 时珍国医国药, 2012, 23(4): 898-899.
[10] 钱海兵, 蒲金山, 王龙, 等. 苗药铁筷子挥发油抗炎作用研究 [J]. 时珍国医国药, 2012, 23(8): 1961-1962.
[11] 王延, 伍沙沙, 徐婷, 等. 山腊梅叶挥发油对血管性痴呆大鼠认知障碍的改善作用 [J]. 安徽农业科学, 2021, 49(2): 170-174.
[12] 高源, 靳凤云, 王祥培, 等. 黔产铁筷子挥发油化学成分的气相色谱-质谱联用分析[J]. 时珍国医国药, 2011, 22(1): 122-123.
[13] 蔡其燕. 梓醇对慢性脑缺血大鼠脑白质保护作用的实验研究 [D]. 重庆: 第三军医大学, 2011.
[14] 罗本华, 于建春, 胡跃强, 等. “益气调血、扶本培源”药线灸治疗轻中度血管性痴呆临床观察 [J]. 时珍国医国药, 2015, 26(3): 649-651.
[15] 刘晓俊. 化瘀通络灸对血管性痴呆大鼠海马CA1区小胶质细胞分泌因子的影响研究 [D]. 合肥: 安徽中医药大学, 2020.
[16] 胡新颖. 电项针对血管性痴呆大鼠海马神经元凋亡和自噬相关蛋白表达的影响 [D]. 哈尔滨: 黑龙江中医药大学, 2018.
[17] 贺丹, 刘厚莲. 中国人口老龄化发展态势、影响及应对策略 [J]. 中共中央党校: 国家行政学院学报, 2019, 23(4): 84-90.
[18] 赵博厚, 施丹莉, 王冰, 等. 慢性脑缺血导致认知功能障碍的研究进展 [J]. 医学综述, 2020, 26(10): 1978-1983.
[19] 黄新武, 张红, 李华,等. 姜黄素对血管性痴呆大鼠血流变学及自由基的影响 [J]. 中成药, 2012, 34(3): 566-568.
[20] Tucker L B, Velosky A G, McCabe J T. Applications of the Morris water maze in translational traumatic brain injury research [J]., 2018, 88: 187-200.
[21] 凌梦钰, 杨一卓, 刘帅, 等. 运动训练对脑缺血再灌注大鼠认知功能及前额皮层神经元核抗原和突触素1表达的效果 [J]. 中国康复理论与实践, 2021, 27(11): 1272-1281.
[22] 丁利静, 赵丹丹, 刘波, 等. 蛇床子素抑制小胶质细胞激活改善血管性痴呆大鼠学习记忆能力 [J]. 中国新药与临床杂志, 2021, 40(6): 470-475.
[23] 牟静静. 慢性脑缺血致认知障碍大鼠线粒体损伤机制及脑脉泰保护作用研究 [D]. 长春: 吉林大学, 2015.
[24] Modarresi F, Faghihi M A, Lopez-Toledano M A,. Inhibition of natural antisense transcriptsresults in gene-specific transcriptional upregulation [J]., 2012, 30(5): 453-459.
[25] Yoshimura R, Ito K, Endo Y. Differentiation/maturation of neuropeptide Y neurons in the corpus callosum is promoted by brain-derived neurotrophic factor in mouse brain slice cultures [J]., 2009, 450(3): 262-265.
[26] 胡维维. BDNF修饰人脐带间充质干细胞源性胆碱能样神经元在阿尔兹海默病大鼠中的作用研究 [D]. 南京: 南京医科大学, 2018.
[27] 李启华. 创伤性脑损伤大鼠乙酰胆碱、脑源性神经生长因子表达变化的研究 [D]. 太原: 山西医科大学, 2012.
[28] Pandya C D, Kutiyanawalla A, Pillai A. BDNF-TrkB signaling and neuroprotection in schizophrenia [J]., 2013, 6(1): 22-28.
[29] Sun M K, Alkon D L. Neuro-regeneration therapeutic for Alzheimer’s dementia: Perspectives on neurotrophic activity [J]., 2019, 40(9): 655-668.
[30] Miao Y, Zheng W, Li N N,. microRNA-130b targets PTEN to mediate drug resistance and proliferation of breast cancer cells via the PI3K/Akt signaling pathway [J]., 2017, 7: 41942.
[31] Zhang T, Gu J B, Wu L M,. Neuroprotective and axonal outgrowth-promoting effects of tetramethylpyrazine nitrone in chronic cerebral hypoperfusion rats and primary hippocampal neurons exposed to hypoxia [J]., 2017, 118: 137-147.
[32] 刘兰, 张东雪, 朱荣芳, 等. 高磷通过SET8-shRNA调控AKT/Caspase-3通路促进血管平滑肌细胞凋亡 [J]. 山西医科大学学报, 2021, 52(10): 1312-1318.
Effect and mechanism of volatile oil ofon vascular cognitive impairment rats induced by chronic cerebral hypoperfusion
DING Xiao-li1, 2, 3, XUE Ding-jia1, 2, DENG Wan-juan1, 2, HAN Cai-yao1, 2, LIU Xiao-long1, 2, LI Yuan1, QIAN Hai-bing1, 2
1. Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China 2. Guizhou Provincial Key Laboratory of TCM Prescription and Pharmacology, Guiyang 550025, China 3. Longyan Hospital of Traditional Chinese Medicine, Longyan 364030, China
To explore the effect and mechanism of volatile oil of Miao medicine Tiekuaizi () on chronic cerebral hypoperfusion (CCH)-induced vascular cognitive impairment (VCI) in rats.CCH model was established by modified bilateral common carotid artery occlusion (BCCAO) method, rats with successful modeling were randomly divided into model group, volatile oil ofhigh-, medium-and low-dose (80, 40, 20 mg/kg) groups and butylphthalide (63 mg/kg) group, and sham operation group was set up. Rats were given corresponding drug for 28 d , water maze test was used to test the learning and memory ability of rats in each group; Open field test and Y-maze test were used to test the autonomous activity and novelty exploration ability of rats in each group; Hematoxylin-eosin (HE) staining, Nissl staining, TUNEL staining were used to observe the changes in structure of nerve cells, Nissl bodies and number of apoptotic cells in cerebral cortex and hippocampus CA1 area of rats in each group; Brain-derived neurotrophic factor (BDNF) level in serum was detected by ELISA; Colorimetric method was used to detect the activities of acetylcholinesterase (AChE) and cholineacetyltransferase (ChAT) in hippocampus of rats in each group; Western blotting was used to detect BDNF, tyrosine kinase receptor B (TrkB), phosphorylated TrkB (p-TrkB), phosphatidylin-ositol-3-kinase (PI3K), protein Kinase B (Akt), p-Akt and cysteine aspartate protease-3 (Caspase-3) protein expressions in hippocampus of rats in each group.Compared with model group, escape latency of rats in volatile oil ofgroup was shortened (< 0.05, 0.01), number of crossing platform and grid crossings were increased (< 0.05, 0.01), time spent in new arm was prolonged (< 0.05, 0.01), degeneration of nerve cell structure was improved, number of Nissl bodies in brain tissue was increased (< 0.05), cell apoptosis was decreased (< 0.05), BDNF level in serum and ChAT activity of in hippocampus were increased (< 0.05, 0.01), AChE activity in hippocampus was decreased (< 0.05), BDNF, TrkB, p-TrkB, PI3K and p-Akt protein expression levels in hippocampus were significantly increased (< 0.05, 0.01), Caspase-3 protein expression level was decreased (< 0.05).Miao medicine volatile oil ofcan improve CCH-induced cognitive impairment in VCI rats, and its mechanism may be related to the activation of BDNF/TrkB/PI3K/Akt signaling pathway.
volatile oil of; chronic cerebral hypoperfusion; vascular cognitive impairment; brain-derived neurotrophic factor; tyrosine kinase receptor B; PI3K/Akt signaling pathway
R285.5
A
0253 - 2670(2022)17 - 5389 - 11
10.7501/j.issn.0253-2670.2022.17.015
2022-04-17
贵州省科技计划项目(黔科合基础-ZK[2022]一般471);贵州省国际科技合作计划项目(黔科合外G字[2010]7012号)
丁晓丽(1996—),硕士研究生,从事中药及民族药的基础研究与开发。Tel: 18300850421 E-mail: 1285485794@qq.com
钱海兵,博士,教授,从事中药及民族药药效物质基础及作用研究。Tel: 13984350701 E-mail: 279753407@qq.com
[责任编辑 李亚楠]

