基于1H-NMR指纹图谱分区相似度的丹参注射剂质量评价方法
赵 芳,李文竹,潘坚扬,杨嘉誉,瞿海斌*
基于1H-NMR指纹图谱分区相似度的丹参注射剂质量评价方法
赵 芳1, 2, 3,李文竹1, 2,潘坚扬1, 2,杨嘉誉1, 2,瞿海斌1, 2*
1. 浙江大学药学院,药物信息学研究所,浙江 杭州 310058 2. 组分中药国家重点实验室浙江大学交叉创新中心,浙江 杭州 310058 3. 海正生物制药有限公司,浙江 杭州 311400
以丹参注射液为研究对象,建立基于1H-NMR指纹图谱分区相似度的质量一致性评价方法。采集81批丹参注射液的1H-NMR光谱,根据代谢物信号的分布规律,将光谱分为氨基酸区、糖类区和酚酸区,分别计算各区光谱的夹角余弦与标准化欧氏距离2种相似度指标,并评价丹参注射液批次质量一致性的性能,并与基于全1H-NMR谱的相似度计算结果进行对比。不同批次丹参注射液间氨基酸、糖类及酚酸的组成均存在一定差异,其中氨基酸、糖类的批间差异较大;同时,欧式距离对成分的批间波动更为敏感。此外,基于全谱的相似度分析结果受糖区特征峰影响极大,对酚酸及氨基酸类成分的批间差异辨识能力较差。基于1H-NMR光谱分区相似度计算法可以更好地辨识不同类别成分的批间波动,较全谱相似度计算法更适用于丹参注射液的一致性评价,为进一步提升中药制剂的质量一致性提供参考。
核磁共振氢谱;丹参注射液;质量控制;质量一致性;相似度分析;氨基酸;糖类;酚酸;丹参素;原儿茶醛;迷迭香酸;紫草酸;丹酚酸B;丹酚酸A
在中药注射剂生产过程中,由于原料或辅料批次更换,以及工艺参数波动等原因,产品质量会有不同程度的波动[1-2]。由于中药化学成分繁多、结构类型高度复杂,在治疗疾病时具有多成分、多靶标的特性,其功效取决于多种成分的共同作用[3],况且中药注射剂给药方式的特殊性,因此,中药注射剂质量的全面表征与一致性评价是中药质量控制标准建立过程中的重点和难点,已成为制约其发展的瓶颈之一[4]。
目前,中药注射剂质量的批间一致性评价通常采用包括HPLC、GC等在内的色谱技术或色谱联用技术的定量分析及指纹图谱分析法,通过定量、半定量或定性分析[5-6],实现化学成分的表征与量化,在此基础上进行质量一致性评价。其中中药指纹图谱是中药多成分质量综合分析及评价的重要手段[7-8]。在现阶段中药的有效成分大多数没有明确的情况下,中药指纹图谱能够有效地从整体上表征中药的整体质量,是基于中药“多成分、多靶点”的作用特性建立的一种有效的中药质量控制方法[8]。
氢核磁共振(proton nuclear magnetic resonance,1H-NMR)指纹图谱技术具有单一性、全面性、定量性和易分辨性等特点,适用于复杂混合物中各类有机物的定性定量分析[9-11]。1H-NMR指纹图谱技术的显著优势在于分析范围广,可同时对初级代谢产物(氨基酸、糖类等)与次级代谢产物(黄酮、酚酸、皂苷等药用活性成分)进行高通量分析。目前基于1H-NMR指纹图谱的中药材及其制剂的质量评价方法,一般通过对分析对象的1H-NMR全光谱进行相似度与空间距离计算[12-18],或在1H-NMR光谱中选择部分代谢物的特征信号并计算相似度[19],以实现一致性评价的目的。然而这些计算方法未能充分利用1H-NMR光谱中反映的样品化学信息。
本研究以丹参注射液为研究对象,考察其1H-NMR光谱中各类初生及次生代谢产物的特征信号及信号分布规律,研究基于丹参注射液1H-NMR光谱特征指纹图谱的产品质量一致性评价方法。
1 仪器与试药
1.1 仪器
Agilent 1100高效液相色谱仪,美国Agilent公司,配四元梯度泵、自动进样器、柱温箱、紫外检测器、ChemStation工作站;Bruker Avance III 500型核磁共振光谱仪,德国Bruker公司,配24位自动进样器及5 mm BBO探头、Topspin工作站;Mettler AE 200型电子天平,瑞士Mettler Toledo公司;IKA VXR basic Vibrax®型光电控制式小型振荡器,德国IKA公司;Eppendorf Multipette M4手动连续分液器,5424及5804R型离心仪,德国Eppendorf公司。
1.2 试药
含有0.05% 3-(三甲基硅基)氘代丙酸钠(TSP)的氘代水(D2O,99.9% D),美国Sigma-Aldrich公司。乙腈、甲醇,色谱纯,德国Merck公司;甲酸,色谱纯,美国ROE科技有限公司;乙酸,色谱纯,美国ROE公司;对照品丹参素钠(批号171027,质量分数99.04%)、原儿茶醛(批号171126,质量分数99.69%)、迷迭香酸(批号171009,质量分数99.36%)、紫草酸(批号180107,质量分数98.85%)、丹酚酸B(批号170924,质量分数99.96%)、丹酚酸A(批号170920,质量分数98.93%)均购自上海融禾医药科技有限公司。
去离子水由Milli-Q Synthesis超纯水机(美国Millipore公司)每日新制。
此外,生产日期2016年7月1日至2020年3月10日的81个不同批次的丹参注射液均为本实验室收集的同一厂家的产品。81批丹参注射液中,批次1~19为过期批次,生产时间为2016年7月至2018年3月;批次20~62的生产时间为2019年3月至2019年8月;批次63~81的生产时间为2019年12月至2020年3月。
2 方法与结果
2.1 样本制备与核磁分析
准确量取900 μL丹参注射液与100 μL含0.05% TSP的氘代水,混合均匀并在10 000 r/min下离心10 min,移取500 μL上清液置入5 mm标准核磁管,留待分析。
在预饱和水峰压制的Noesygppr1d的脉冲序列下进行核磁分析,以溶剂90% H2O+10% D2O锁场,谱宽为12,中心频率为4.695,弛豫时间为2 s,混合时间为50 ms,90°脉冲P1为14.75 μs,空扫次数为4,扫描次数为32,采集时间为2.726 s,接收器增益为114。
在Bruker Topspin(3.6.2版,美国Bruker Biospin Corporation)软件中,对自由感应衰减(free induction decay,FID)信号进行傅里叶变换,窗函数线宽=0.3 Hz,手动执行相位校正并以TSP的特征信号作为内部参考,将其化学位移设为0.00,作为化学位移漂移矫正的基准,确保不同样品光谱之间具有可比性。
2.2 光谱预处理
使用MestReNova(14.0.0版,西班牙Mestrelab Research)软件对光谱在“Peak”模式下进行分箱(Binning)宽度为0.02的降维处理,处理后的光谱作为相似度计算的参考数据。分箱后,去除残留水信号影响的光谱区域(4.5~5.0)及无信号的区域(0.0~0.5),原始光谱由32 768个数据点降维至513个数据点。在此基础上,在Matlab中采用区间相关优化平移算法(interval correlation optimised shifting algorithm,ICOSHIFT)[20-21]工具包对齐NMR光谱信号,消除不同批次丹参注射液NMR图谱间的化学位移偏差。
2.3 光谱分区
中药提取物的1H-NMR光谱按提取物中各类物质化学性质的不同,可被划分为低场区(主要为芳香族化合物信号,5.50~10.00)、中场区(主要为碳水化合物区信号,3.30~5.50)以及高场区(主要为小分子有机酸和氨基酸信号,0.05~3.30)。为充分利用光谱中的信息,并全面表征样品的化学信息,本研究将丹参注射液的1H-NMR光谱按高、中、低场进行分区计算,标记为1、2、3区(M1、M2、M3),分别反映注射液中的氨基酸、糖类及丹参酚酸类的成分信息,如图1所示。
2.4 相似度计算
2.4.1 相似度计算方法 本研究使用标准化欧氏距离与余弦相似度作为丹参注射液1H-NMR光谱指纹图谱的相似性计算方法[22]。相似度计算由Matlab软件(版本2019a,美国Mathworks公司)完成。为使标准化欧式距离这一指标与余弦相识度量纲一致,便于后续统一考察,本研究使用“相对欧氏距离”。样品的1H-NMR光谱的相对欧氏距离DE的计算公式如下。
rE=E/Emax
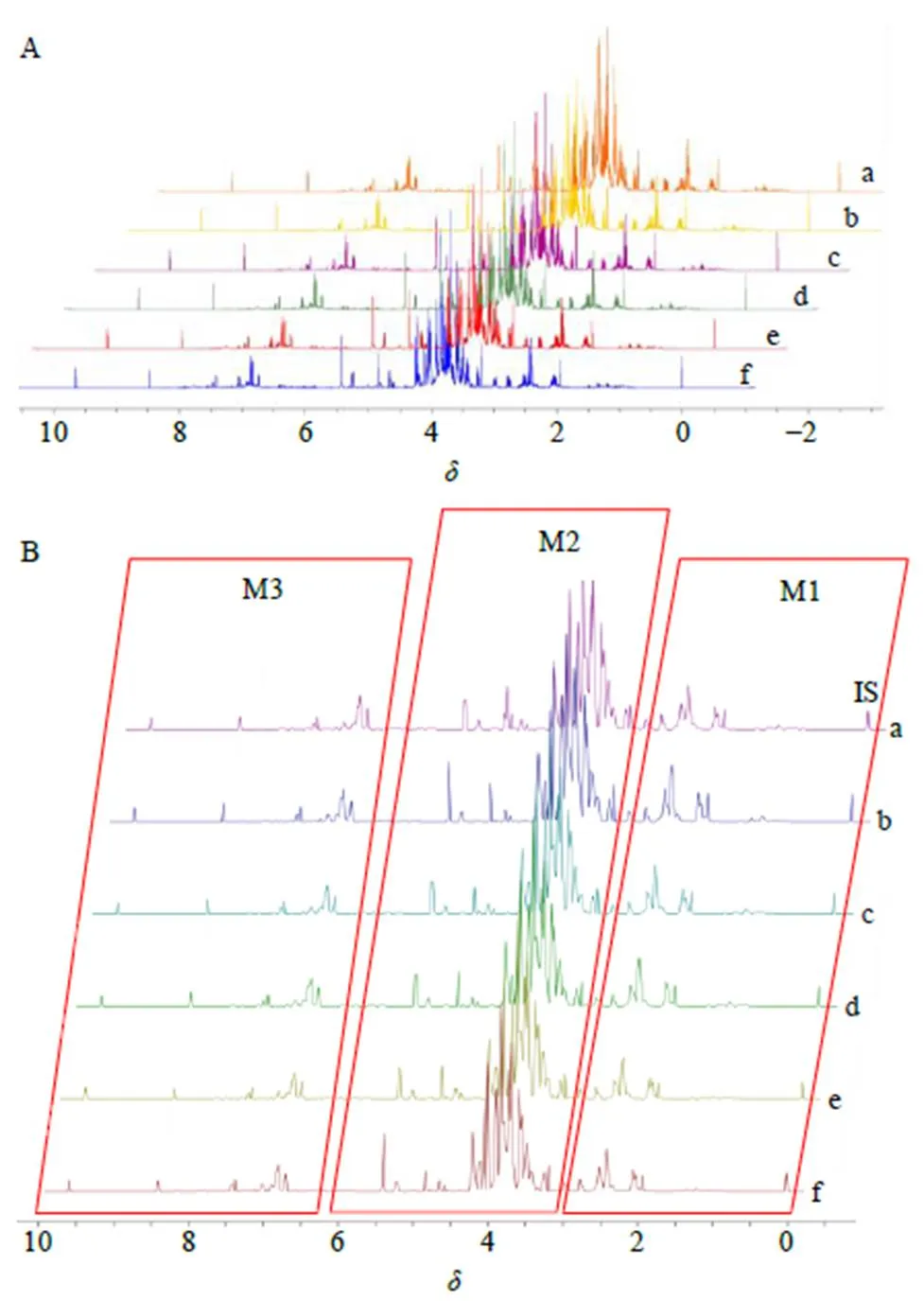
A-6批注射液的原始光谱 B-6批原始光谱经分箱(δ0.02)处理后所得光谱 a~f-6批样品批号分别为161001、170901、180301、190301、190201、200301
E为样品与标准样品的1H-NMR光谱间的标准化欧氏距离,Emax为根据所有被考察批次丹参注射液与标准样品的1H-NMR光谱间的标准化欧氏距离的最大值
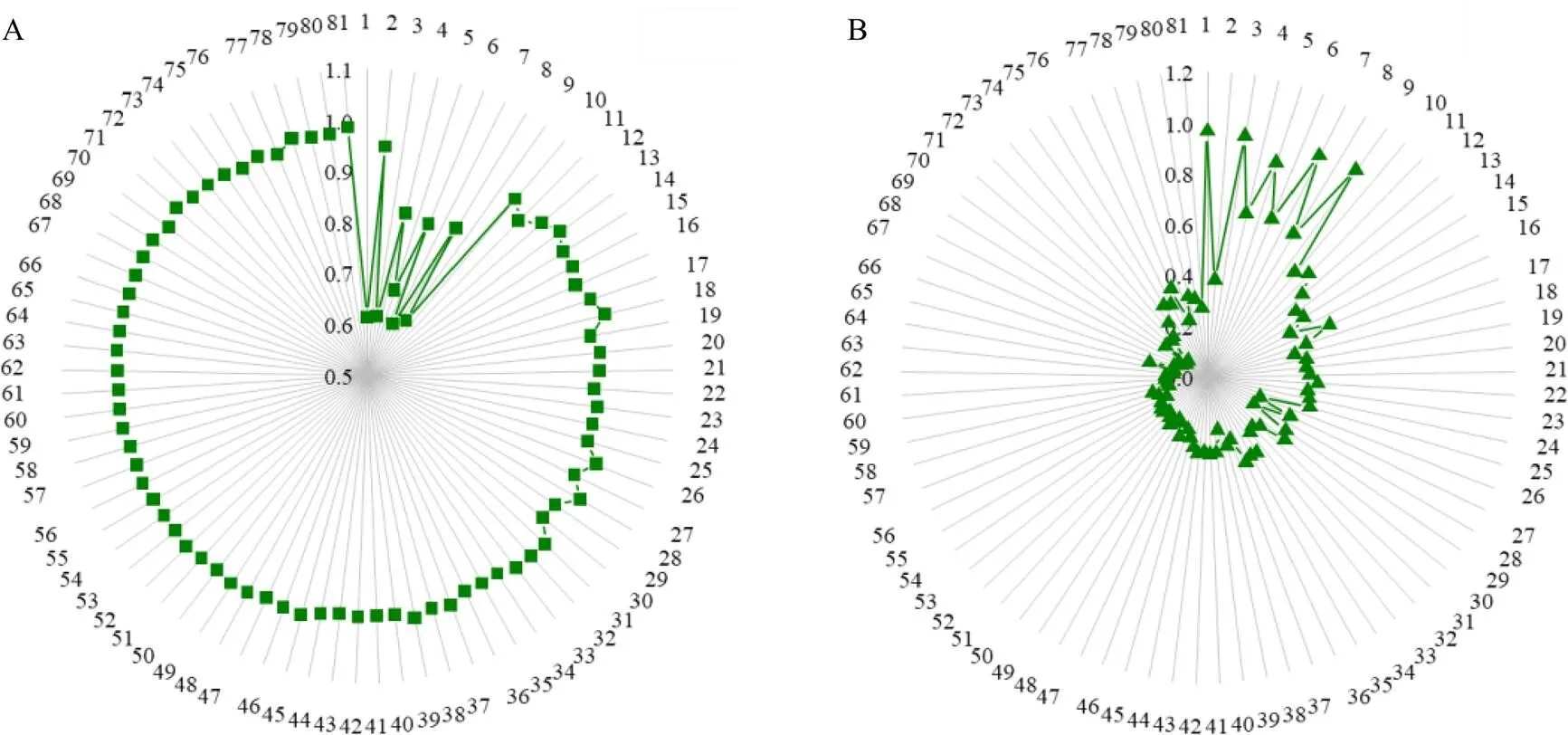
2.4.2 丹参注射液1H-NMR光谱的分区相似度评价结果 以10批临床使用无不良反应的丹参注射液为标准批次,在此基础上计算平均光谱,并以该平均光谱为基准,分别计算81批次丹参注射液3个光谱分区的余弦相似度与相对欧氏距离。为使数据便于观察,使用Origin(版本2019b,美国OriginLab公司)软件将81批丹参注射液的3个分区的相似度计算结果绘制为雷达图(图2)。
余弦相似度越接近1说明该分区与基准光谱越相似,相对欧氏距离越接近0说明该分区的相似度越接近于标准样品。经分析,除批次13、16,不在效期内的丹参注射液1区余弦相似度均大于0.970,效期内批次的1区余弦相似度则均大于0.985,说明余弦相似度对氨基酸区的波动敏感性不足,但仍能体现出不在效期内注射液中的氨基酸、小分子有机酸含量与近期批次有一定程度的差异;与此形成对比的是欧氏距离对样品变异具有更高的敏感性,效期外丹参注射液的1区、2区欧氏距离较大且批间波动也较大,批次20~62的3区欧式距离则明显高于标准批次。

A-氨基酸区余弦相似度 B-糖区余弦相似度 C-酚酸区余弦相似度 D-氨基酸区相对欧氏距离 E-糖区相对欧氏距离 F-酚酸区相对欧氏距离
2区余弦相似度这一指标则体现出了不在效期内的丹参注射液批次糖区光谱的无序波动,在效期内批次31~81中则均高于0.97。而欧式距离的总体趋势则随生产日期与基准批次的接近而逐渐减小:该指标在2018年及之前批次中较高,在2019年3月至6月批次中则显著降低,在0.2~0.5波动;在2019年7月至2020年1月批次中则在0.08~0.23波动,在20年3月及之后的批次中则在0.1~0.4波动。由于糖类在贮存过程中相对稳定,可以推测样品在出厂时糖类含量即不相同,而氨基酸及酚酸类物质可能在贮存过程中发生了较大变化。
3区的余弦相似度在各批次注射液中的波动更为显著,其中批次20~56的余弦相似度均低于0.75,相应的,其欧式距离则均较大,说明酚酸含量也有一定程度的批间波动。
综上,相较余弦相似度,欧式距离更能体现批次间的差异;而3区的余弦相似度对丹参注射液中酚酸的批间变异有较好的考察能力。此外,评价结果表明,丹参注射液中糖类与氨基酸类成分组成的批间差异较为显著,对注射液质量一致性的影响较大,为提高丹参注射液的用药安全性,对这2类成分应提出控制标准。
2.4.3 分区相似度评价方法结果的准确性验证
(1)与丹参注射液1H-NMR光谱的全谱相似度评价结果对比:计算81个样品的全1H-NMR光谱(0.05~10.0)的余弦相似度与欧氏距离。全谱相似度的雷达图如图3所示。由图3可知,基于全光谱的余弦相似度与欧氏距离仅能识别部分不在效期内的注射液的异常;同时,图2与图1中2区余弦相似度及2区欧氏距离的评价结果高度雷同,这是因为糖区在丹参注射液这一品种的氢谱全谱中所占峰面积比例极大,因此基于全谱的相似度分析受糖区特征峰影响极大,对酚酸区及氨基酸区的差异识别能力因此被削弱。因此,对于丹参注射液,基于全谱的余弦相似度及欧式距离相似度评价对异常样本的识别能力不如分区相似度评价方法。
(2)基于主成分分析(principal component analysis,PCA)的一致性评价结果对比:进一步对比81个注射液的全光谱数据(A=81×513)及分区相似度数据(A=81×6)的无监督PCA模型,建模前使用中心化法对所有数据进行缩放处理。81个注射液的全光谱PCA模型包含5个主成分,其2为0.901,2为0.767,前3个主成分分别解释44.6%、27.5%、10.5%的模型方差;81个注射液的分区相似度数据的PCA模型包含3个主成分,其2为0.998,2为0.823,3个主成分分别解释91.5%、5.6%、2.8%的方差。建模结果显示分区相似度的PCA模型的分类性能优于全光谱PCA模型。在此基础上,为使分类结果更为明确,基于PCA结果绘制基于Ward’s最小方差法的层次聚类(hierarchical clustering analysis,HCA)树。聚类结果见图4。
A-全谱余弦相似度 B-全谱相对欧氏距离
由聚类图4-A可以看出,PCA-HCA无监督判别模型对基于全光谱信息的样品具有一定的聚类能力,但对各批号注射液的分离能力不高,集群间的分类界限不清晰,非相近日期生产的注射液批次(如20年3月批次与19年3月至19年6月批次)也有被聚类到同一集群(图4-A IV组)的风险。对比图4-A与4-B,显然基于分区相似度信息的模型聚类效果更好,相近批次之间的空间距离更近,类内相似度更高而类间差异更为显著。
(3)基于正交偏最小二乘判别分析(orthogonal partial least square-discriminant analysis,OPLS-DA)的批间光谱差异辨识 在“2.4.3(2)”项中对效期内样品的聚类结果,为进一步验证方法对注射液批间差异辨识的准确性,将效期内体现出差异的批次分为2类(图4中III组与IV组),对全光谱的分箱积分数据进行帕累托缩放处理后,进行OPLS- DA,以观察2类注射液中的指标差异的明确来源。OPLS-DA模型是一种有监督的判别模型,较PCA模型有更强的识别类间差异来源的能力。OPLS-DA模型相应的S线图和置换检验图如图5所示。其中,S线图用于识别不同类别注射液间的化学组成差异,置换检验图用于评估模型是否过拟合。
图5-D~F表明3个模型均未过拟合,模型性能良好。S线图的ctr[1]反映了变量与1之间的协方差,而corr值代表了变量与1之间的相关性,corr的绝对值越大,表示该点对应的化合物对模型的影响越大;corr的正相关系数和负相关系数分别表示2类样本中相应化合物浓度的正相关和负相关。由图5-A~C中S线图的corr值可知,酚酸区的不同是2类样品的主要差异来源,这一结论与图2中2类样本的分区相似度统计结论(2类样本的3区余弦相似度与欧氏距离均有差异)完全一致。为进一步验证这一结果的准确性,对注射液中酚酸含量进行基于HPLC-UV的定量分析[23],并以HPLC法所得酚酸含量的定量结果为参照,考察2类注射液的酚酸含量差异。6个丹参酚酸在2类注射液中含量差异的双样本检验结果分别为=0.000、0.160、0.640、0.000、0.000、0.004。6种丹参酚酸含量分布的箱型图见图6所示。由相应检验结果可知,注射液中丹参素、紫草酸、丹酚酸B、丹酚酸A的质量浓度在III组中有显著的提升,说明2类样本在酚酸组成上存在显著差异,但是基于1H-NMR全谱的指纹图谱一致性分析(图3)并未体现出这种差异。

A-基于1H-NMR全光谱 B-基于分区1H-NMR光谱 黑体对应批次为标准批次;纵坐标为81批次注射液的批号,6位编号YY-MM-BB分别指代该批次生产的年-月-批

A-1区的S线图(曲线的不同颜色对应不同变量的Pcorr值,纵坐标为Pctr [1],横坐标为相应变量的化学位移) B-2区的S线图 C-3区的S线图 D-1区的置换检验图 E-2区的置换检验图 F-3区的置换检验图
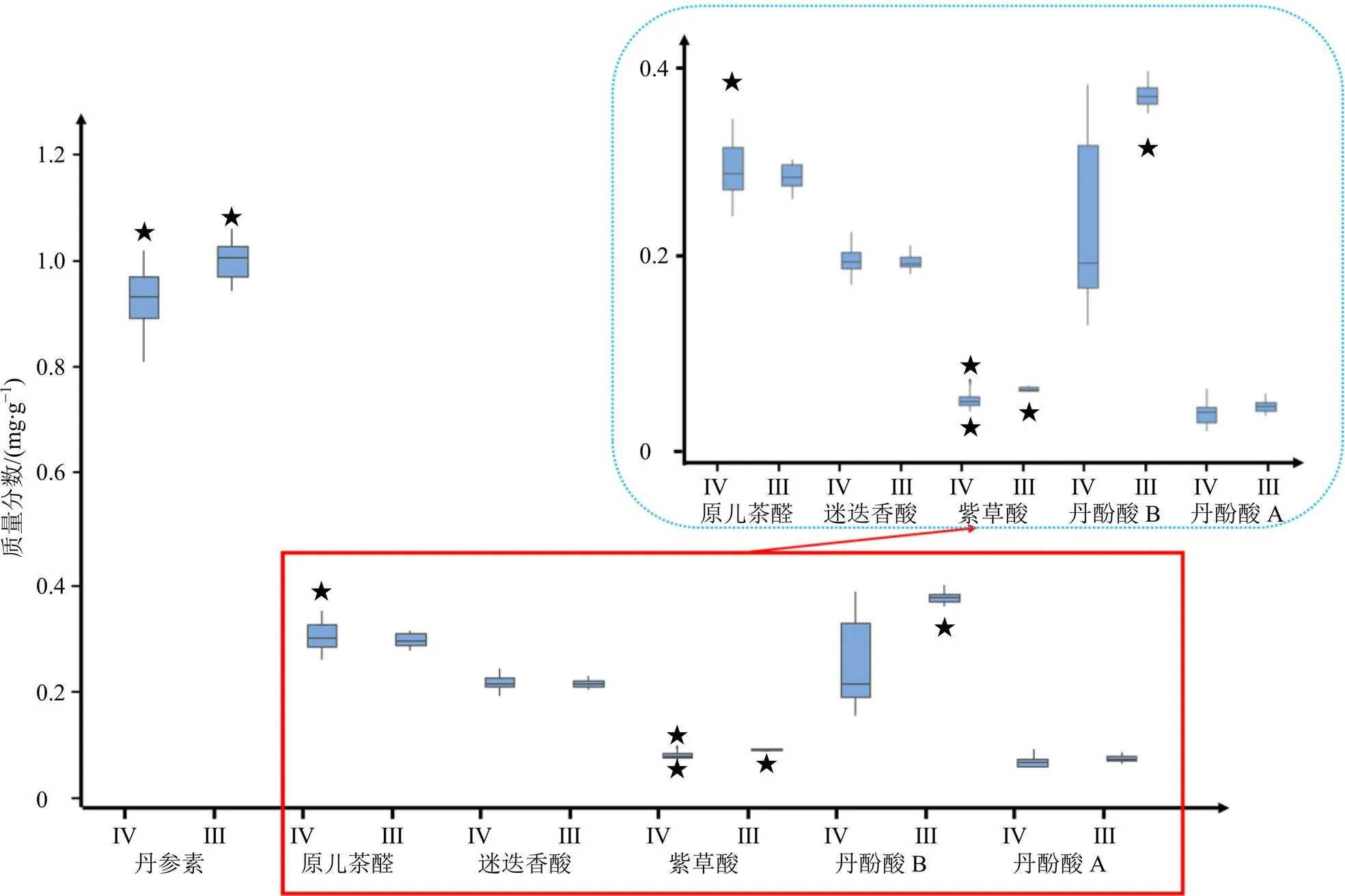
为异常值 III-III组 IV-IV组
3 讨论
本研究将丹参注射液的1H-NMR光谱按代谢物分布规律进行了分区,并以余弦相似度及标准化欧氏距离为评价指标,分别计算氨基酸区、糖区及酚酸区的相似度,作为多批次丹参注射液的质量一致性评价方法,评价了同一厂家在2016年至2020年间生产的81批丹参注射液中酚酸、氨基酸及糖类成分的组成情况,结果显示,生产时间间隔较久的产品在氨基酸及糖类成分的含量与组成上存在差异;此外,随保存时间变长,丹参酚酸也会产生一定程度的降解导致产品质量波动。在此基础上,通过多角度的对比证明了所提出的1H-NMR光谱分区相似度评价方法在丹参注射液的质量一致性评价中相较传统的全光谱相似度计算法具有更强的批间化学差异识别能力。
综上所述,本研究建立的丹参注射液的1H-NMR光谱相似度评价方法可以反映出丹参注射液批间不同类别成分的波动,可用于丹参注射液的多组分质量控制及评价,同时为中药注射液的一致性评价提供了新的思路与参考方法。
利益冲突 所有作者均声明不存在利益冲突
[1] Quality Implementation Working Group Points to Consider (R2) ICH-Endorsed Guide for ICH Q8/Q9/Q10 Implementation [S/OL]. [2014-10-24] http://www. ich. org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q8_9_10_QAs/PtC/Quality_IWG_PtCR2_6dec2011.
[2] Pharmaceutical cGMPs for the 21st century: A risk-based approach [S]. 2002.
[3] Nikam P H, Kareparamban J, Jadhav A,. Future trends in standardization of herbal drugs [J],, 2012, 2(6): 38-44.
[4] 赵桉熠, 倪凤燕, 陈彭月, 等. 以一致性为核心的中成药质量研究现状及优质评价新模式探讨 [J]. 中国中药杂志, 2020, 45(15): 3740-3748.
[5] 胡瑞雪, 梁元昊, 徐文丽, 等. 一测多评法在中药中的应用及研究进展 [J]. 药物分析杂志, 2019, 39(11): 1968-1979.
[6] 张晓雨, 王燕平, 林丽开, 等. 中药注射剂上市后整体评价的思路与关键 [J]. 中国中药杂志, 2017, 42(16): 3229-3232.
[7] 汪悦. 丹红注射液和生脉注射液质量分析研究 [D].杭州: 浙江大学, 2014.
[8] 聂黎行, 石上梅, 翟为民, 等. 指纹图谱技术在中药注射剂标准提高中的应用 [J]. 中成药, 2015, 37(03): 607-611.
[9] Chauthe S K, Sharma R J, Aqil F,. Quantitative NMR: An applicable method for quantitative analysis of medicinal plant extracts and herbal products [J]., 2012, 23(6): 689-696.
[10] Xie J, Zhang A H, Sun H,. Recent advances and effective strategies in the discovery and applications of natural products [J]., 2018, 8(2): 812-824.
[11] Halabalaki M, Vougogiannopoulou K, Mikros E,. Recent advances and new strategies in the NMR-based identification of natural products [J]., 2014, 25: 1-7.
[12] 温时媛, 周江韬, 陈燕燕, 等. 红景天药材的1H-NMR指纹图谱研究 [J]. 中国中药杂志, 2015, 40(13): 2629-2633.
[13] 曲婷丽, 魏玉海, 李爱平, 等. 黄芪注射液1H NMR指纹图谱研究 [J]. 药学学报, 2016, 51(05): 780-785.
[14] 王楠, 高晓霞, 张爱荣, 等. 基于1H-NMR的定坤丹指纹图谱研究 [J]. 山西医科大学学报, 2019, 50(4): 479-483.
[15] 李爱平, 陈佳佳, 李震宇, 等. 基于核磁指纹图谱黄芪药材均一性评价研究 [J]. 中药材, 2017, 40(09): 2107-2111.
[16] 姜苗苗, 张宇, 冯毅凡. 双黄连口服液的核磁共振氢谱指纹图谱研究 [J]. 中国药房, 2012, 23(7): 633-635.
[17] 唐荣伟, 田玫瑰, 唐玲, 等. 乌梅的1H-NMR指纹图谱研究 [J]. 中国药房, 2018, 29(19): 2644-2647.
[18] 谭有珍, 陈碧莹, 吴霞, 等. 基于1H-NMR指纹图谱建立沉香快速识别模型的研究 [J]. 中药材, 2021, 44(04): 818-823.
[19] 陈夏霖, 耿婷, 黄文哲, 等. 基于1H-NMR技术的银杏二萜内酯原料药含量测定和指纹图谱研究 [J]. 中国中药杂志, 2018, 43(7): 1404-1409.
[20] Lee G, Woodruff D L. Beam search for peak alignment of NMR signals [J]., 2004, 513(2): 413-416.
[21] Savorani F, Tomasi G, Engelsen S B. Icoshift: A versatile tool for the rapid alignment of1D NMR spectra [J]., 2010, 202(2): 190-202.
[22] Goodarzi M, Russell P J, Vander Heyden Y. Similarity analyses of chromatographic herbal fingerprints: A review [J]., 2013, 804: 16-28.
[23] 陈丽冰, 何容, 李辉, 等. 恤彤注射液中间体丹参提取液的指纹图谱分析及多指标含量测定[J]. 中国现代应用药学, 2020, 37(9): 1085-1089.
Quality evaluation method for Danshen Injection based on sectionalized1H- NMR fingerprint spectral similarity
ZHAO Fang1, 2, 3, LI Wen-zhu1, 2, PAN Jian-yang1, 2, YANG Jia-yu1, 2, QU Hai-bin1, 2
1. Pharmaceutical Informatics Institute, College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China 2. State Key Laboratory of Component-Based Chinese Medicine, Innovation Center in Zhejiang University, Hangzhou 310058, China 3. Hisun Biopharmaceutical Co., Ltd., Hangzhou 311400, China
To establish a quality consistency evaluation method for Danshen Injection (丹参注射液) based on the similarity of sectionalized1H-NMR fingerprint.The1H-NMR spectra of 81 batches of Danshen Injection were obtained. According to the distribution of various metabolite signals, the spectra were sectionalized into three regions, which were the amino acid region, sugar region, and phenolic acid region, respectively. Then, cosine similarities and standardized Euclidean distances of each region for each spectrum were calculated respectively as the consistency evaluation indexes for Danshen Injection. In addition, the evaluation method results aforementioned was compared with the similarity calculation results based on the full1H-NMR spectra.The results showed that certain fluctuations did exist in the composition of amino acids, carbohydrates, and phenolic acids among different batches of Danshen Injection. Among them, the differences in amino acids and carbohydrates between batches were bigger than those in phenolic acids. At the same time, the Euclidean distance was a more sensitive index to the metabolite fluctuations than cosine similarity. In addition, similarity analysis based on the full1H-NMR spectrum was significantly affected by the sugar region, and so its ability to distinguish differences in phenolic acids and amino acids was weak.Similarities based on sectionalized1H-NMR spectra can identify the fluctuations of different types of metabolites better. The method proposed in this study is more appropriate for quality control of Danshen Injection than that based on full-spectrum, which will help to provide reference ideas for further improving the quality control level of traditional Chinese medicine preparations.
proton nuclear magnetic resonance (1H-NMR); Danshen Injection; quality control; quality consistency; similarity analysis; amino acid; sugar; phenolic acid; danshensu; protocatechuic aldehyde; rosemary acid; alkannic acid; salvianolic acid B; salvianolic acid A
R283.6
A
0253 - 2670(2022)17 - 5312 - 09
10.7501/j.issn.0253-2670.2022.17.007
2022-03-25
国家“重大新药创制”科技重大专项(2018ZX09201011-002)
赵 芳(1993—),女,博士后,研究方向为制药过程分析。E-mail: z_fang@zju.edu.cn
瞿海斌,博士生导师,从事制药过程质量控制研究。Tel: (0571)88208428 E-mail: quhb@zju.edu.cn
[责任编辑 郑礼胜]

