miR-19a对缺氧复氧诱导心肌细胞SOCS3/JAK1/STAT3信号通路及自噬的影响
陈耿仟,吴国平,洪丽明,林 润
心血管疾病,如心力衰竭、冠心病和急性心肌梗死等与心肌结构和功能失调密切相关,严重威胁人类生命安全[1]。溶栓、冠状动脉介入是治疗心血管疾病的有效手段,可使病人受到不同程度的心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤[2]。因此,开发新策略预防I/R损伤对改善心血管疾病具有重要的临床意义[3]。miR-19a在糖尿病诱导的心肌组织中过表达,可能参与糖尿病心肌损伤过程。Liu等[4]研究显示,激活细胞因子信号转导抑制蛋白3(SOCS3)可抑制蛋白质酪氨酸激酶-1(JAK1)及转录活化蛋白3(STAT3)磷酸化水平,抑制SOCS3表达可抑制肝癌细胞自噬。有研究显示,I/R导致心肌细胞过度自噬,抑制I/R诱导的心肌细胞自噬,进而保护心脏功能[5]。miR-19能否参与调控缺氧(hypoxia,H)和复氧(reoxygenation,R)诱导的心肌细胞自噬过程及其与SOCS3/JAK1/STAT3通路的关系尚未明确。本研究在体外模拟H/R模型[6],探讨miR-19a过表达对H/R诱导下心肌细胞增殖、凋亡及自噬变化情况,并分析潜在的作用机制,为预防心肌细胞I/R损伤提供新思路。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验材料 大鼠心肌细胞H9c2(GNR5)购自中国科学院细胞库;DMEM高糖(11995)/无糖(90113)培养基、优级胎牛血清(11011-8611)、胰蛋白酶消化液(0.25%)(T1350)、双抗(青链霉素混合液)(P1400)、Matrigel基底胶(M8370)、逆转录试剂盒(T2210-200T)、电化学发光(ECL)液(PE0010)购自北京Solarbio公司;miR-19a模拟(mimics)、miR-19a阴性对照(negative control,NC)由广州锐博生物科技有限公司设计;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(annexin V-fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)细胞凋亡检测试剂盒(C1062M)、RIPA裂解液(P0013B)、Trizol试剂盒(R0016)、细胞计数试剂盒-8(cell counting kit-8,CCK-8)(C0037)上海碧云天生物技术有限公司;LipofectamineTM2000转染试剂盒(11668019)、磷酸甘油醛脱氢酶(glyceraldehyde phosphate Dehydrogenase,GAPDH)兔抗人多克隆抗体(PA1-16777)、SOCS3兔抗人多克隆抗体(PA5-87485)、Beclin-1兔抗人多克隆抗体(PA5-96649)、微管相关蛋白轻链3Ⅱ/Ⅰ(microtubule-associated protein light chain 3 Ⅱ/Ⅰ,LC3Ⅱ/Ⅰ)兔抗人多克隆抗体(PA5-109226)、核孔蛋白(nucleoporin 62,p62)兔抗人多克隆抗体(PA5-27247)、JAK1兔抗人多克隆抗体(PA5-105265)、JAK1磷酸化(p-JAK1)兔抗人多克隆抗体(44-4222G)、STAT3兔抗人多克隆抗体(710077)、STAT3磷酸化(p-STAT3)兔抗人多克隆抗体(44380G)、山羊抗兔IgG(H+L)二级抗体(A32731)购自美国Thermo Fisher Scientific公司。
1.1.2 实验仪器 二氧化碳细胞培养箱(BBD6220)购自美国Thermo Fisher Scientific公司;低氧工作站(DY-S)购自黑龙江迈沃德工贸有限公司;聚合酶链式反应仪(T100)购自美国Bio-Rad公司;酶标仪(ST-360)购自上海科华生物工程股份有限公司;倒置显微镜购自(MA100N)购自日本Nikon;流式细胞仪(ZS-AE7S)购自中生(苏州)医疗科技有限公司。
1.2 实验方法
1.2.1 心肌细胞培养 将H9c2心肌细胞用含10%胎牛血清(v/v)、1%双抗(v/v)、89%高糖DMEM培养基(v/v)的培养瓶培养,置于37 ℃、5%CO2培养箱,每日更换1次新鲜培养液。细胞融合度>80%时进行传代并保种,胰酶消化收集3~5代细胞用于后续实验。
1.2.2 miR-19a mimics转染 将处于对数期生长的H9c2心肌细胞接种于6孔板(5×105个/孔),待细胞完全贴壁后,随机分为3组:H/R组、H/R-miR-19a mimics组和H/R-miR-19a阴性对照(NC)组。H/R-miR-19a模拟(mimics)组、H/R-miR-19a NC组分别使用无血清的培养基稀释miR-19a mimics储存液、miR-19a NC储存液及LipofectamineTM2000转染液处理6 h,更换新鲜培养液培养细胞24 h,H/R组不进行转染处理,收集各组细胞用于后续实验。
1.2.3 H/R模型建立 按1.2.2步骤收集的各组细胞参照文献[6],换用等量低糖无血清DMEM培养基(已用CO2和N2充分饱和3 h),孵育2 h(37 ℃),置于低氧培养箱(37 ℃、1%O2、5%CO2、94%N2)中培养10 h,胰酶消化处理,收集各组细胞,加入含有10%胎牛血清的高糖DMEM培养基,置于常氧培养箱(37 ℃、95%空气、5%CO2)中复氧2 h。另按1.2.1收集的细胞,接种于6孔板上(5×105个/孔),常规培养,设置为Control组。收集各组细胞用于后续实验。
1.2.4 实时荧光定量聚合酶链式反应(RT-qPCR) 使用Trizol试剂盒分别提取按1.2.3步骤收集的各组H9c2心肌细胞总RNA,取1 μg总RNA进行逆转录、PCR扩增反应。PCR反应条件:95 ℃预处理1 min,95 ℃ 15 s,70 ℃ 30 s,扩增40个循环。以U6为内参,应用2-△△Ct法计算miR-19a基因相对表达量。miR-19a及U6引物由上海生工生物工程有限公司设计合成,引物序列见表1。

表1 miR-19a和参考U6引物序列(5′-3′)
1.2.5 CCK-8实验 将1.2.3收集的各组细胞分别重悬,接种于96孔细胞板(4.5×104个/孔)上,每组设置6个复孔,待细胞完全贴壁后,每孔添加100 μL CCK-8,避光孵育2.5 h,酶标仪检测450 nm波长下各孔OD值,计算各组细胞生存率,取平均值。细胞生存率(%)=各实验组OD值/各空白Control组OD值×100%。
1.2.6 Annexin V-FITC/PI双染法检测细胞凋亡 胰酶(不含EDTA)消化收集1.2.3各组细胞,磷酸缓冲盐溶液(PBS)洗涤2次,离心(1 000 r/min,5 min),Binding Buffer重悬(500 μL),依次添加10 μL Annexin V-FITC和PI,充分混匀,常温避光静置15 min,流式细胞仪检测凋亡率。凋亡率(%)=凋亡早期细胞比例+凋亡晚期细胞比例。
1.2.7 蛋白免疫印迹法 收集1.2.3各组细胞,PBS清洗3次,每孔加入200 μL预冷的RIPA裂解液,提取各组总蛋白。加入等量蛋白样品电泳,转膜,PBS清洗,在37 ℃下用5%脱脂牛奶封闭4 h,加入一抗LC3Ⅱ/Ⅰ(1∶500)、p62、Beclin-1、SOCS3、JAK1、p-JAK1、STAT3、p-STAT3(1∶1 000)、GAPDH(1∶2 000),摇床孵化过夜,洗膜,添加二抗(1∶10 000),室温孵化2 h,洗膜,根据ECL说明书进行显色曝光,凝胶成像仪成像。分析目标蛋白与GAPDH内参条带比值。

2 结 果
2.1 各组H9c2心肌细胞中miR-19a表达比较 与Control组比较,H/R组H9c2心肌细胞miR-19a表达水平降低(P<0.05);与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞miR-19a表达水平显著升高(P<0.05)。详见表2。

表2 各组H9c2心肌细胞中miR-19a表达比较(±s,n=6)
2.2 miR-19a mimics转染对H/R诱导的H9c2心肌细胞存活率的影响 与Control组比较,H/R组H9c2心肌细胞存活率降低(P<0.05);与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞存活率升高(P<0.05)。详见表3。

表3 miR-19a mimics转染对H/R诱导的H9c2心肌细胞存活率的影响(±s,n=6) 单位:%
2.3 miR-19a mimics转染对H/R诱导的H9c2心肌细胞凋亡的影响 与Control组相比,H/R组H9c2心肌细胞凋亡率升高(P<0.05);与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞凋亡率降低(P<0.05)。详见图1、表4。
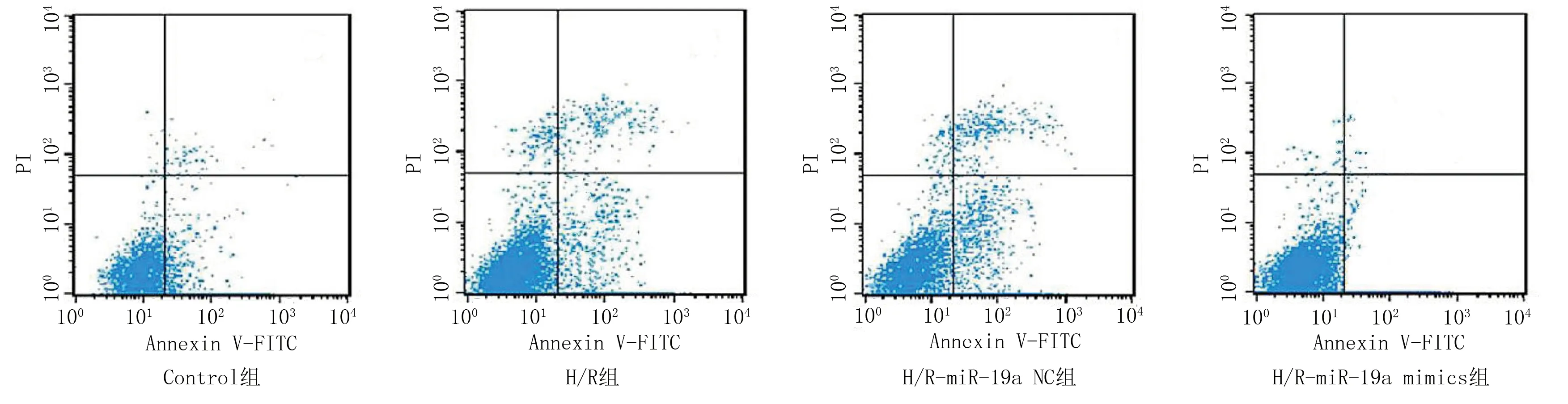
图1 miR-19a mimics转染对H/R诱导的H9c2细胞凋亡的影响

表4 miR-19a mimics转染对H/R诱导的H9c2心肌细胞凋亡的影响(±s,n=6) 单位:%
2.4 miR-19a mimics转染对各组H9c2心肌细胞自噬标记物LC3Ⅱ/Ⅰ、Beclin-1、p62表达的影响 与Control组比较,H/R组H9c2心肌细胞Beclin-1蛋白表达水平及LC3Ⅱ/Ⅰ升高(P<0.05),p62蛋白表达水平降低(P<0.05);与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞Beclin-1蛋白表达水平及LC3Ⅱ/Ⅰ降低(P<0.05),p62蛋白表达水平升高(P<0.05)。详见图2、表5。
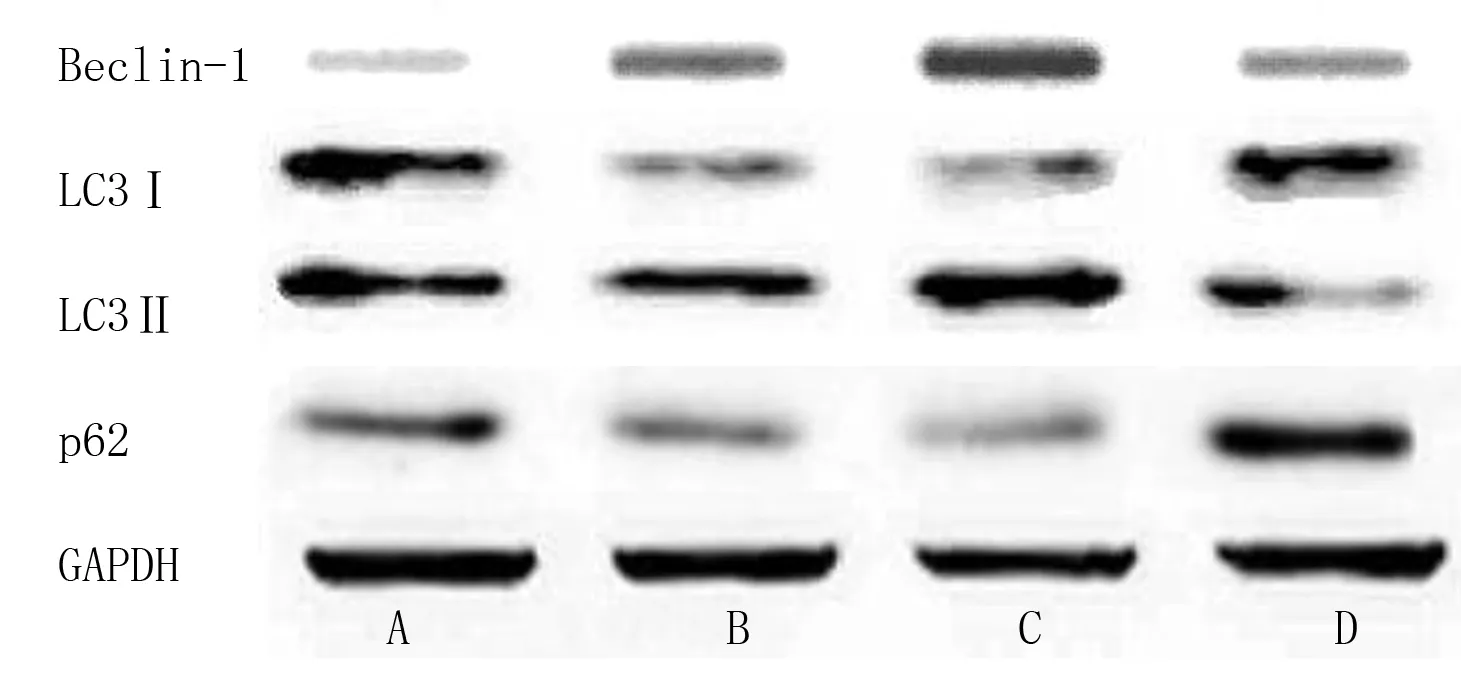
图2 各组LC3Ⅱ、LC3Ⅰ、Beclin-1和p62蛋白表达条带图(A为Control组;B为H/R组;C为H/R-miR-19a NC组;D为H/R-miR-19a mimics组)
2.5 miR-19a mimics转染对H9c2心肌细胞SOCS3、p-JAK1、p-STAT3表达的影响 与Control组比较,H/R组H9c2心肌细胞SOCS3蛋白表达水平升高(P<0.05),p-JAK1、p-STAT3水平降低(P<0.05);与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞SOCS3蛋白表达水平降低(P<0.05),p-JAK1、p-STAT3水平升高(P<0.05)。详见图3、表6。
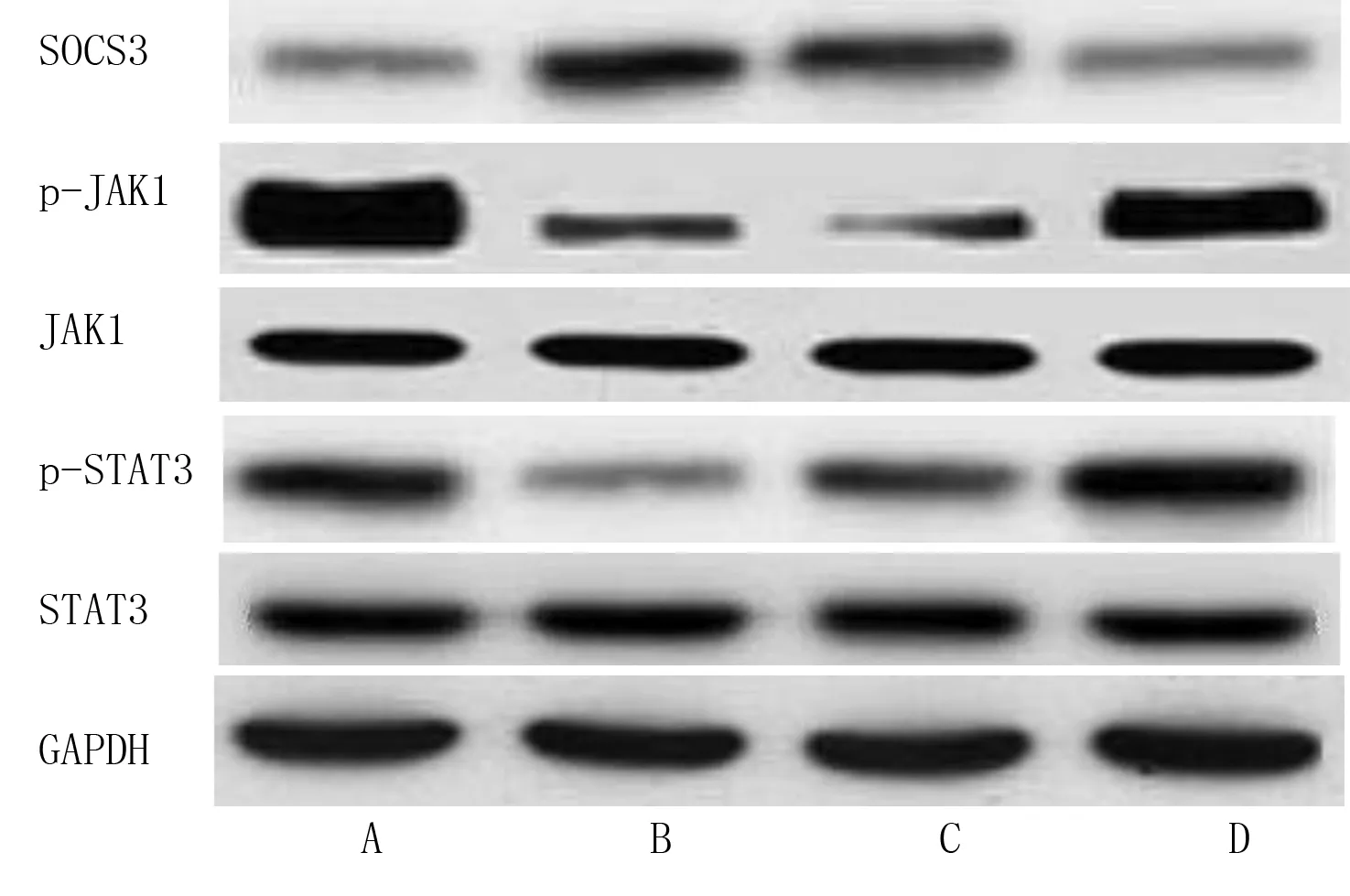
图3 各组H9c2心肌细胞SOCS3、p-JAK1、p-STAT3蛋白表达条带图(A为Control组;B为H/R组;C为H/R-miR-19a NC组;D为H/R-miR-19a mimics组)
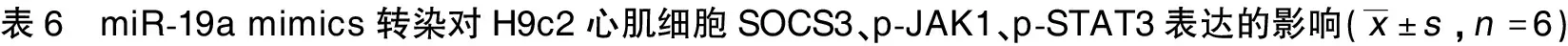
3 讨 论
心肌I/R损伤是一种病理性疾病,特征是血液供给受限,恢复灌注并伴随供氧,最终导致急性心肌梗死或心力衰竭[7]。近年来,治疗心肌I/R损伤手段取得重要进展,但疗效需进一步提高。有研究显示,H/R诱导大鼠H9c2心肌细胞损伤模型可一定程度模拟I/R损伤,因此,本研究选择大鼠H9c2心肌细胞作为体外研究对象[8]。心肌I/R损伤机制尚未明确,寻找治疗心肌I/R损伤的有效靶点,是减少I/R损伤的突破口。
I/R损伤可诱导心肌细胞凋亡,是导致I/R损伤病人生存率低的重要因素。微小RNA(microRNA,miRNA)是一类单链非编码RNA,研究证实,其与心肌细胞增殖、凋亡等密切相关[9]。Mao等[10]研究显示,上调miR-19a-3p表达水平可减轻心肌肥大。Liu等[11]研究显示,miR-19a-3p具有抑制心脏肥大和心力衰竭的能力。本研究首先构建了miR-19a过表达体系,之后建立H/R损伤模型,与Control组比较,H/R组H9c2心肌细胞miR-19a表达水平、存活率降低,凋亡率升高,提示H/R可诱导损伤H9c2心肌细胞,I/R损伤模型构建成功,推测miR-19a与H/R诱导的心肌细胞的增殖、凋亡相关。Gao等[12]研究显示,miR-19a模拟物可增强心肌细胞增殖,减轻心肌梗死引起的心脏损害。本研究结果显示,与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞miR-19a表达水平、细胞存活率升高,凋亡率降低,提示过表达miR-19a可抑制H/R诱导H9c2心肌细胞死亡及凋亡,推测miR-19a可能成为治疗I/R损伤的潜在靶标。
自噬是细胞受外界刺激以维持稳态的动态过程。I/R过程中,心肌细胞自噬发挥着损伤作用。Beclin-1是细胞自噬过程的必需蛋白质,可促进自噬体形成[13]。LC3Ⅱ与溶酶体膜结合诱导细胞自噬,可作为自噬小体标记物之一,p62可用于测定自噬通量,其表达水平与自噬活性成反比[14]。本研究结果显示,与Control组比较,H/R组H9c2心肌细胞Beclin-1蛋白表达水平及LC3Ⅱ/Ⅰ升高,p62蛋白表达水平降低,提示H/R诱导增强了心肌细胞自噬;与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞Beclin-1蛋白表达水平及LC3Ⅱ/Ⅰ降低,p62蛋白表达水平升高,提示miR-19a过表达可减轻H/R诱导的心肌细胞自噬,推测miR-19a可能通过抑制H/R诱导的心肌细胞自噬,发挥心肌保护作用。
Li等[15]研究显示,miR-19a在系统性幼年关节炎病人中低表达,且能激活SOCS3/JAK/STAT信号通路。本研究结果显示,与H/R组和H/R-miR-19a NC组比较,H/R-miR-19a mimics组H9c2心肌细胞SOCS3蛋白表达水平降低,p-JAK1及p-STAT3水平升高,提示过表达miR-19a可抑制SOCS3表达,促进p-JAK1及p-STAT3表达。Liu等[4]研究显示,抑制/促进SOCS3表达,可抑制肝癌细胞/促进乳腺癌细胞自噬的形成。因此推测,过表达miR-19a可能通过抑制SOCS3表达,促进p-JAK1/p-STAT3水平,抑制H/R诱导的心肌细胞自噬。
综上所述,过表达miR-19a可能通过抑制SOCS3表达,激活JAK1/STAT3信号通路,抑制H/R诱导的心肌细胞自噬,从而减轻H/R诱导的心肌细胞损伤,为临床制定治疗I/R心肌损伤的新策略提供了参考。临床导致I/R心肌损伤的因素复杂且具有不可控性,仅凭体外模拟实验证据尚不充分,今后将联合体内小鼠模型和临床试验,深入探讨miR-19a对I/R心肌损伤的影响及作用机制。

