尘螨与特应性皮炎相关性研究进展
江欣雨 赵可喻 许素玲
315211宁波大学医学院(江欣雨 赵可喻)
特应性皮炎(atopic dermatitis,AD)是一种常见的慢性、复发性、炎症性皮肤病,伴有显著的皮肤干燥和瘙痒[1]。近10年来,我国AD的发病率不断上升,且涉及各个年龄段[2]。根据是否伴发变态反应,可将其分为内源性AD和外源性AD[3],其中外源性AD约占80%。而尘螨是引起外源性AD最常见的过敏原之一,可以侵入皮肤屏障,促进辅助性T细胞2(Th2)极化,引起Th1/Th2平衡漂移,导致并加重AD[4]。已有研究表明,尘螨与AD存在一定的相关性,随着研究的深入,有学者发现AD患者对尘螨的部分过敏原敏感性高于呼吸道过敏性疾病[5]。本文对尘螨与AD的相关性综述如下。
1 尘螨与AD的相关性
最新的中国特应性皮炎诊疗指南根据不同年龄段的表现,将AD分为婴儿期(出生至2岁)、儿童期(>2~12岁)、成人期(>12~60岁)及老年期(>60岁)[1]。虽然各期皮疹形态及临床症状有所不同,但分析其特异性免疫球蛋白E(specific immunoglobulin E,sIgE)后发现,尘螨均为主要的吸入性过敏原[6-7]。研究显示,婴儿及儿童期患者随着年龄的增加,吸入性过敏原阳性检出率上升,患者逐渐由食入性过敏转为吸入性过敏为主,这可能与其自身免疫系统完善及户外活动增加有关,而成人患者则随着年龄的增加,吸入性过敏原阳性率呈下降趋势[8-11]。重度AD患者常以成人期居多,有学者指出以尘螨为主的吸入性变应原是成年AD患者病情恶化的基本触发因素,同时其瘙痒强度也与抗尘螨的sIgE抗体水平呈正相关(P<0.001)[12-14]。然而目前针对AD的sIgE数据统计大多集中在婴儿及儿童期,这可能与特应性皮炎好发于儿童有关[15]。但随着近年来成人和老年人患AD的概率逐渐升高,且>12岁AD患者的生活质量明显低于<12岁的患者(P<0.05)[12],因此针对这两类患者的sIgE分析还需更多的数据研究。
2 尘螨的主要过敏原
尘螨的过敏原常存在于其体内或粪便颗粒中[16],也可存在于棚螨外骨骼和腐烂的螨体碎片中,其性质包括蛋白水解活性,使壳多糖裂解和结合的活性,有些过敏原还与Toll样受体4(toll-like receptor-4,TLR-4)的脂多糖结合成分及其他无脊椎动物原肌球蛋白具有同源性[17]。
尘螨有多种类型,但常见的三种为屋尘螨(dermatophagoides pteronyssinus,Der p)、 粉 尘 螨(dermatophagoides farina,Der f)和埋内宇尘螨(euroglyphus maynei,Eur m)[18]。目前研究中,屋尘螨有31种过敏原,粉尘螨有36种,埋内宇尘螨则有5种[17]。以屋尘螨的主要过敏原为例,不同过敏原的生化特性存在一定差异(见表1)。其中Der p 1、p 3、p 6、p 9均具有蛋白水解活性,该性质不仅有直接的致敏作用,还能直接作用于上皮细胞,降低表皮屏障修复能力,激活表皮角质形成细胞和真皮神经中的蛋白酶激活受体-2(protease activated receptor-2,PAR-2),导致细胞因子的释放和非组胺介导的瘙痒[17]。Der p 2则与髓样分化蛋白-2(myeloid differentiation 2,MD-2)具有结构同源性,充当了与TLR-4结合的配体,进而在炎症中发挥作用。而Der p 10和p 11这两种肌肉源性的过敏原主要发生在螨体中但不存在于螨粪中,且Der p 10过敏原阳性的患者虾过敏的可能性更大[17,19]。屋尘螨的主要过敏原大多可在尘螨过敏患者的血清中用sIgE识别,其中针对Der p 23的IgE仅占抗尘螨总IgE相对较小的百分比,但其却是主要的过敏原,因此需要进一步的研究[20-21]。此外,尘螨还有较多未知的过敏原,且不同过敏原的生化特性及功能仍有一定的模糊性。
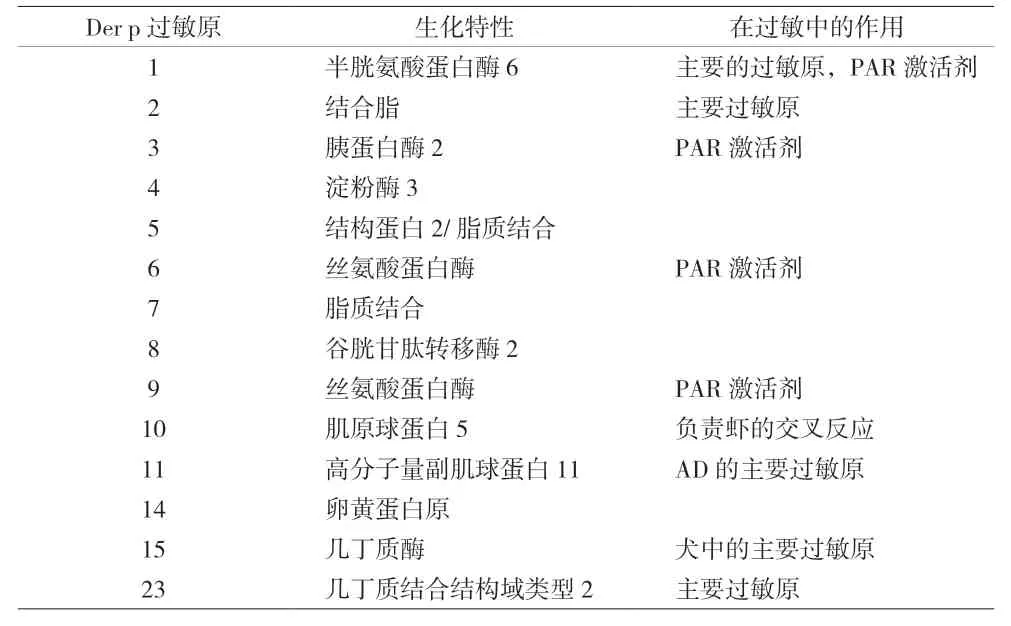
表1 主要Der p的生化特性及其在过敏中的作用
3 尘螨的致敏过程
AD的病因及发病机制较为复杂,目前尚未完全明确,但皮肤屏障异常和免疫功能障碍在其发病过程中起着关键作用。通常认为皮肤屏障的损伤促进过敏原的入侵并激活免疫系统[22]。患者吸入尘螨后引起过敏性炎症,除了表现为尘螨致敏的哮喘或过敏性鼻炎外,还通过减少角质层神经酰胺破坏皮肤屏障功能,同时激活PAR-2,延迟表皮通透性屏障功能的愈合和恢复[23]。而免疫功能障碍主要体现在Th1/Th2平衡失调,尘螨的过敏原刺激机体后,发生Th2型免疫应答,产生大量特异性B细胞,分泌过量的免疫球蛋白E(immunoglobulin E,IgE),并结合于肥大细胞表面。当机体再次接触尘螨时,肥大细胞表面的IgE发生交联,引起细胞过度活化和脱颗粒,释放大量炎症介质和过敏毒素,进而出现一系列的过敏症状[24]。尘螨的两种主要过敏原Der p 1和p 2有不同的生化特性,其引起AD的途径也有所差异。
Der p 1具有半胱氨酸蛋白酶活性,还能诱导机体产生IgE型抗体的免疫活性,通过与PAR2结合产生活化信号,进一步动员细胞内Ca2+介导的细胞内信号传导。同时Der p 1还诱导促炎细胞因子胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP)的生成,促进Th2细胞分化,产生白细胞介素(interleukin,IL)4、IL-5、IL-13等一系列细胞因子,从而启动Th2型过敏性炎症[25]。此外,当机体受到Der p 1刺激后,表皮角质形成细胞(normal human epidermal keratinocytes,NHEKs)迅速向胞外释放出大量腺苷三磷酸,激活下游的MEK/ERK信号通路,细胞内Ca2+数量增加,表达并释放出大量的IL-33,同时增加IL-33活性,随后,Der p 1激活核苷酸结合寡聚化结构域样受体蛋白3炎性小体,介导NHEKs分泌IL-1家族成员:IL-1α、IL-1β、IL-18[26]。以上这些TSLP、细胞因子均是AD发病过程中的关键调节因子[27]。
Der p 2则特异性上调人B细胞中丝裂原活化蛋白激酶磷酸酶-1的表达和活性,进而导致丝裂原活化蛋白激酶去磷酸化,并触发TLR4表达,激活B细胞增殖,促进IL-1β、IL-8、肿瘤坏死因子、干扰素诱导蛋白等各类促炎因子的表达[28]。Der p 2还可以通过与TLR4的相互作用直接激活结构细胞,间接上调MD-2,增加细胞因子IL-1β和IL-8的释放,并触发MD-2启动子,激活GATA-3,促进Th2细胞分化[25,29]。另外,Der p 2作为胆固醇的天然配体,通过与其结合,也参与过敏反应的发生,使血清IgE水平升高,Th1/Th2细胞因子平衡失调[30]。
4 尘螨所致AD的治疗
尘螨所致AD患者的治疗除了一些常规的方法外,如:外用保湿润肤剂、糖皮质激素、钙调神经磷酸酶抑制剂;使用生物制剂;紫外照射治疗等,还应有其它的针对性措施[31]。
4.1 控制过敏原 回避或减少尘螨接触对于尘螨诱发AD的控制起到重要作用。研究显示高浓度过敏原会加重AD的严重程度[32]。尘螨喜湿,因此可以通过降低空气湿度达到减少尘螨数量的目的。同时,尘螨的尸体及其粪便也可致敏,故在控制过敏原时要注意这一点,可以通过物理和化学的方式来进行干预[33]:①物理干预措施包括使用防螨纺织品、降低室内相对湿度(例如通风)、吸尘、使用高效空气过滤器、定期更换地板覆盖物、及时清洗更换毛绒玩具等;②化学干预措施则主要为使用杀螨剂。但单一的除螨方式很难达到较好的效果,可联合多种除螨方式提高除螨效率,同时在除螨的过程中还要考虑可操作性、安全性和性价比等因素。
4.2 变应原特异性免疫治疗 变应原特异性免疫治疗(allergen-specific immunotherapy,ASIT)也叫脱敏治疗,是目前唯一可以影响过敏性疾病自然进程的病因治疗法,并可防止新的过敏发生,动物模型研究显示ASIT可纠正AD小鼠Th1/Th2细胞因子平衡失调,对尘螨致敏的特应性皮炎小鼠有良好的治疗作用[34]。目前ASIT主要有5种方式:皮下注射、舌下含服、口服、经皮免疫治疗及淋巴免疫治疗。LEE等研究发现大多数患者在ASIT治疗后有所改善,部分患者获得接近完全或完全的临床缓解,并观察到瘙痒指数和血清总IgE平均值降低(P<0.01),其中<12岁的患者预后更佳(P=0.024)。相较轻度AD患者而言,中重度AD患者表现出更出色的治疗效果(P=0.036),且ASIT治疗对仅屋尘螨致敏的患者更好[35]。另外不同ASIT治疗途径,均可显著改善尘螨过敏AD患者的症状,研究显示舌下含服粉尘螨滴剂与屋尘螨过敏原淋巴免疫治疗等疗效均比较理想[36]。但临床上发生局部和全身不良反应的风险依然存在,包括注射部位的瘙痒、红晕、肿胀、硬结、坏死,严重者甚至出现休克、喉头水肿、荨麻疹、血管炎、支气管哮喘等[37]。
4.3 其他治疗方法 应用某些中草药或化学物质也可起到治疗效果,如连翘[38]、辣木叶提取物[39]、次氯酸[40]等,其均在尘螨诱导的特应性皮炎中发挥一定的抗炎、止痒的作用。
5 小结
尘螨在各年龄段均为主要的吸入性过敏原,且其浓度与AD的严重程度息息相关,这对检测AD患者过敏原及预防有一定的指导意义。以往认为AD常见于婴幼儿及儿童,而2020版中国特应性皮炎诊疗指南新增了老年期患者,因此针对这一部分患者的流行病学研究需进一步深入。目前认为Der p 1、Der f 1、Der p 2、Der f 2、Der p 23是主要的尘螨过敏原,基于其不同的生化特性,目前的研究在其各自的生物学功能方面仍然存在一定的模糊性。尘螨侵入导致的皮肤屏障损伤和Th1/Th2免疫平衡失调是引起AD的两个主要原因,由于AD的病因及发病过程复杂,在与尘螨相关的机制方面还有较大的探索空间。临床上,对于尘螨引起的AD除常规的治疗外,更重要的是病因治疗,包括控制过敏原和变应原特异性免疫疗法,这对患者的依从性和治疗周期有一定的要求,虽然其疗效尚存争议,但随着更多针对性药物的问世,患者的生活质量也能得到保障。

