原发性肾脏血管母细胞瘤三例报告并文献复习⋆
黄文鹏 刘晨晨 侯佳蒙 肖晓燕 李莉明 高剑波
河南省郑州大学第一附属医院放射科 (河南 郑州 450052)
1 资料与方法
病例1,患者女,43岁,20天前无明显诱因出现左侧腰部疼痛,为阵发性绞痛,无肉眼血尿,无尿频、尿急、尿痛等症状。体格检查未见明显异常。实验室检查:D-二聚体0.89mg/L,白细胞计数10.00×109/L,中性粒细胞计数8.70×109/L,肿瘤标志物未见明显异常。既往体健,无家族性遗传病史。CT检查:平扫示左肾类圆形不均匀软组织密度肿块,CT值约42HU,内见片状低密度坏死(图1A),大小约6.6cm×6.4cm×5.4cm (前后径×左右径×上下径),增强皮质期实性成分强化明显,CT值约174HU,病灶中心位于肾髓质,向周围膨胀性生长,边界尚清(图1B)。实质期实性成分强化程度减低,CT值约140HU(图1C)。手术及病理:患者行后腹腔镜下右肾部分切除术,术中见右肾上极腹侧肾被膜下大小约4.0cm×3.5cm肿物,切面质软到中,呈多彩状,肿物与周围组织界限不清,粘连严重。术后病理:光镜下见组织内多角形间质细胞密集,胞质丰富、淡染,核大,细胞间血管丰富,有较厚的纤维性包膜与肾组织分界(图1D);免疫组化检测:S-100(+),Inhibin-a(+),NSE(+),EMA(灶+),CK(-),Desmin(-),CD34(血管+),CD10(+),Vimentin(+),PAX-8(-),E-Cad(灶+),P504(-),CK7(-),HMB45(-),Melan-A(-),TFE-3(-),Ki-67(<10%+)。病理诊断:左肾血管母细胞瘤。
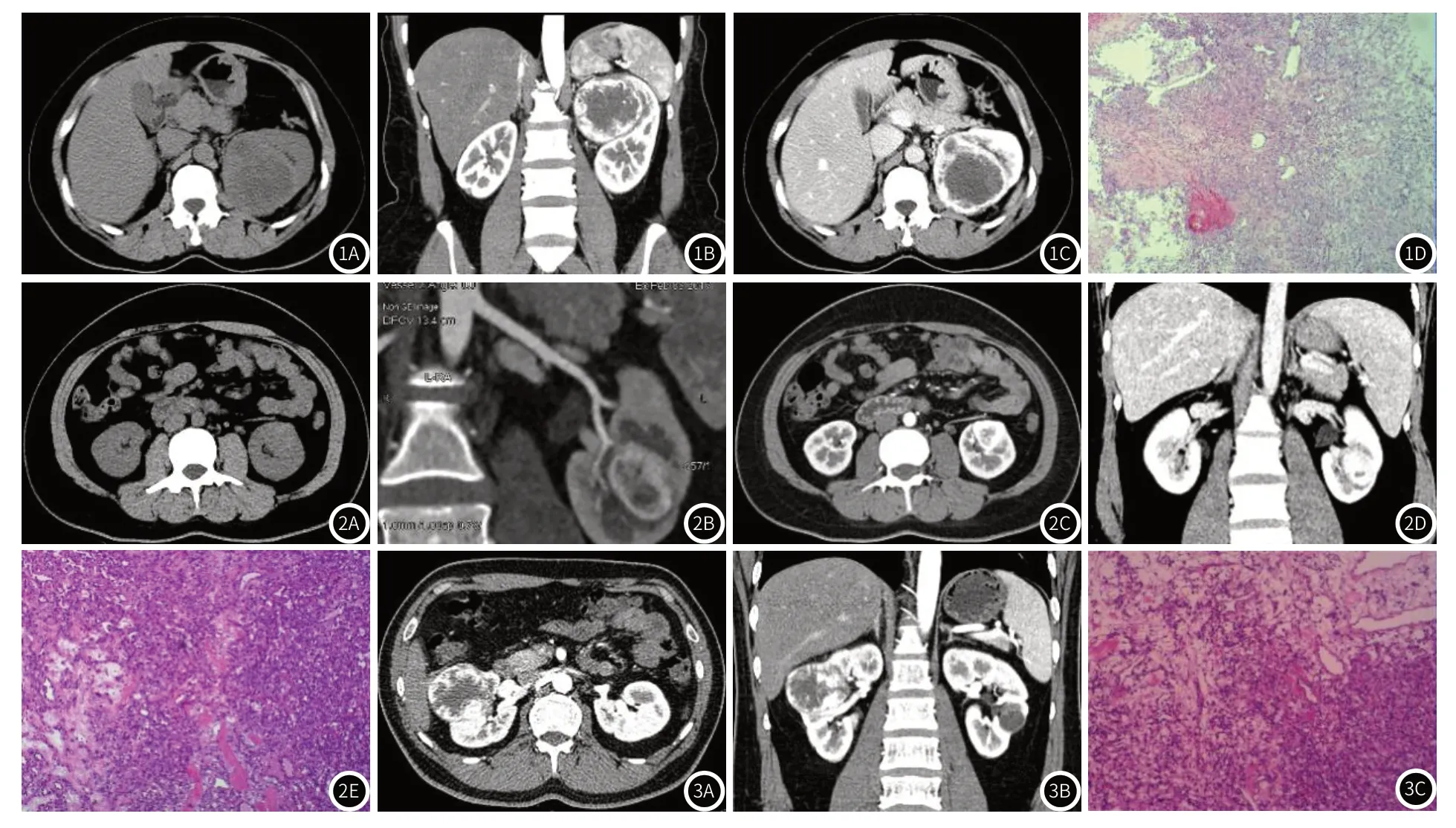
图1 患者1的CT及病理图像,图1A:平扫示左肾内类圆形不均匀密度肿块,内见片状低密度坏死;图1B:皮质期冠状位示病灶中心位于肾髓质,向周围膨胀性生长,边界尚清,实性成分呈明显强化,CT值约174HU;图1C:实质期实性成分强化程度减低,CT值约140HU;图1D:病理图像(HE×40)。图2 患者2的CT及病理图像,图2A:平扫示左肾中部髓质内类圆形稍高密度,边界尚清;图2B:曲面图示病灶见左肾动脉分支供血;图2C:皮质期病灶环形强化,CT值约245HU,强化明显,内见小片状坏死;图2D:实质期冠状位示病灶强化程度降低,CT值约167HU;图2E:病理图像(HE×40)。图3 患者3的CT及病理图像 图3A:右肾上极类圆形不均匀明显强化病灶,CT值约264HU;图3B:皮质期冠状位示病灶中心位于皮髓质交界处;图3C:病理图像(HE×40)。
病例2,患者女,36岁,体检超声示左肾中下极3.1cm×2.2 cm×1.9cm实性不均质略高回声包块,等线边界清楚,内回声不均匀,周边见细晕,包块内见点状血流信号显示,部分周边见血流环绕,考虑左肾实性包块。门诊以“左肾占位”收入院。入院后体格检查未见明显异常。实验室检查:白细胞计数11.87×109/L,中性粒细胞计数10.70×109/L,肿瘤标志物未见明显异常。既往体健,无家族性遗传病史。CT检查:等线左肾中部的髓质内可见类圆形稍高密度肿物(图2A),平扫CT值约37HU,边界尚清,最大截面约2.8cm×2.9cm,病灶在皮质期呈不均匀环形强化,强度程度明显,可见左肾动脉分支供血(图2B),CT值约245HU,内见小片状坏死无强化影(图2C),实质期病灶强化程度减低,CT值约167HU(图2D)。手术及病理:患者行腹腔镜下左肾部分切除术,术中见右肾中部腹侧髓质内见大小约4.0cm×3.5cm×0.7cm肿物,切面灰红质中。术后病理:光镜下毛细血管网丰富,血管网之间见散在的多角形或卵圆形间质细胞巢状排列,大小较一致,有慢性炎细胞浸润(图2E);免疫组化检测:AE1/AE3(-),CK7(-),CD10(部分+),Vimentin(+),PAX-8(-),CA-9(+),S-100(+),HMB45(-),CD117(-),Ki-67(5%+),CD34(+),Desmin(-),SMA(部分+),TFE-3(-),PAX-2(+),CAM5.2(-),EMA(部分+),NSE(+),Inhibi-a(+),病理诊断:左肾血管母细胞瘤。
病例3,患者男,36岁,1周前无明显诱因出现右下腹痛,无血尿、腰痛、尿痛。体格检查未见明显异常。实验室检查:D-二聚体1.44mg/L,C反应蛋白7.51mg/L,纤维蛋白原4.34g/L,肿瘤标志物未见明显异常。CTA检查:右肾上极见类圆形不均匀明显强化肿块(图3A),大小约为5.4cm×5.9cm×4.8cm,CT值约264HU,病灶中心位于皮髓质交界处(图3B),病灶内见肾动脉分支进入。手术及病理:患者行腹腔镜下右肾根治性切除术,术中见肾实质内大小约5.0cm×3.0cm×3.0cm灰白肿物,切面灰白灰红,质软,局部呈胶冻样,肉眼观肿物未突破被膜,边界较清。术后病理:光镜下见组织内血窦丰富,肿瘤细胞呈片状弥漫分布于血管网之间,细胞边界清楚,细胞核较大(图3C);免疫组化检测:AE1/AE3(-),PAX-8(+),CA-9(+),CD10(+),CK7(-),CD117(-),GATA-3(-),TFE-3(部分+),HMB45(-),Melan-A(-),Ki-67(<10%+),CK8/18(-),EMA(部分+),NSE(+),S-100(+),CD56(灶+),Sym(-),Vimentin(+),Inhibi-a(+),病理诊断:右肾血管母细胞瘤。
2 讨 论
等线血管母细胞瘤(hemangioblastomas,HB)又称血管网织细胞瘤,是一种组织来源不明的、富于血管网的良性高度血管化肿瘤,好发于中枢神经系统的幕下小脑、脊髓和脑干[1-5]。原发性肾脏血管母细胞瘤(hemangioblastoma of the kidney,HBK)临床罕见,由Nonaka等[6]于2007年首次报道,常发生于中年人,无性别差异,临床多无明显症状,多因体检或其他原因就诊时偶然发现,部分表现为等线腰部不适、腰痛以及肉眼血尿等症状。本文3例患者除1例体检发现外,其余2例分别表现为腰部疼痛和下腹痛,症状不典型。本文3例患者均行肿瘤标志物检查,检验结果均为阴性。
HBK其确切的发病机制目前尚不明确,组组织学上HBK主要由不同成熟阶段的薄壁毛细血管和间质细胞构成,根据间质细胞成分的丰富程度分为细胞型和网状亚型[7-8]。免疫组化检查间质细胞特异性表达S-100蛋白、波形蛋白、NSE和α-抑制素[9-10]。
HBK的CT报道少见,根据本文病例结合以往的相关文献报道,对其影像表现进行总结[3,6,8,11-12]。(1)形态学上,HBK多见于右肾,病灶中心多位于肾皮髓质交界区,多数呈规则的类圆形或圆形的单发肿块,可见完整纤维包膜,边界尚清,局限性生长,体积较大者可向肾内外生长,邻近肾盏受压变窄,但无破坏,亦无肾静脉癌栓、腹膜后淋巴结肿大等恶性征象。(2)影像表现:CT平扫肿瘤呈低、等或略高密度肿块,密度多不均,部分瘤体内出现不规则低密度囊变或坏死区,其病理基础可能为肿瘤生长较快,缺血、坏死所致,偶尔可合并钙化和出血。HBK瘤体内血供丰富,可见单一或多支肾动脉分支供血,皮质期边缘多呈结节样或环形强化,与肾皮质强化程度相似,强化明显,符合其富血供的病理特点,中心坏死区不强化。实质期可向中央填充,仍呈明显强化,但较皮质期强化程度减低,这种向心性填充式的强化提示病灶是血管源性的。少数病例可因瘤内反复出血机化呈轻度强化。(3)鉴别诊断:HBK需与肾透明细胞癌、乏脂肪肾脏血管平滑肌脂肪瘤、肾嗜酸细胞腺瘤等相鉴别。肾透明细胞癌:CT平扫呈稍低或等密度,增强时透明细胞性肾细胞癌呈不均匀明显强化,对比剂廓清较快,动态增强扫描呈“快进快出”特征,常有肾盂及肾周结构侵犯、肾门淋巴结肿大等表现。乏脂肪肾脏血管平滑肌脂肪瘤:CT平扫密度较高,增强后强化均匀,强化程度低于HBK。肾嗜酸细胞腺瘤:肿瘤呈圆形等或低密度区,一般无强化或轻度强化,强化程度低于肾皮质,肿块中央区可见星状瘢痕、坏死及出血导致肿瘤内密度不均匀。
HBK首选外科手术切除,在完整切除的前提下尽可能保留肾单位,由于肿瘤的血管丰富,术前可行血管栓塞术降低术中出血风险[2]。本文3例患者手术后恢复良好,随访均未出现复发。
综上所述,HBK临床罕见,症状不典型,术前容易误诊为癌导致过度治疗,因此正确诊断非常重要,在肾脏肿瘤的鉴别诊断中应考虑到HBK的可能,,而且患者需进一步全面检查评估有无von Hippel-Lindau病相关性肿瘤。CT检查对本病的诊断有参考价值,可明确肿瘤的供血情况,辅助临床正确制定手术方案和治疗后复查,其确诊仍依赖于组织病理学检查。

