根癌农杆菌介导的尖孢镰刀菌遗传转化体系构建
李娟,邱睿,张盈盈,李小杰,李成军,李淑君
研究简报
根癌农杆菌介导的尖孢镰刀菌遗传转化体系构建
李娟1,2,邱睿1*,张盈盈1,李小杰1,李成军1,李淑君1
1 河南省农业科学院烟草研究所,黄淮烟区烟草病虫害绿色防控重点实验室,河南省许昌市永昌大道与青梅路交叉口 461000;2 定西市植保植检站,甘肃省定西市安定区公园路22号 743000
【背景和目的】尖孢镰刀菌()可引起烟草镰刀菌根腐病(Fusarium root rot of tobacco),为明确病原菌致病相关基因。【方法】以烟草强致病性尖孢镰刀菌菌株B-9-1的分生孢子为受体,利用携带潮霉素B(hygromycin B,)质粒的根癌农杆菌()介导转化,获得能够稳定表达绿色荧光蛋白(green fluorescent protein, GFP)的尖孢镰刀菌转化菌株,构建烟草尖孢镰刀菌遗传转化体系。【结果】(1)尖孢镰刀菌的最优转化体系为:潮霉素B最适质量浓度50mg/mL,在25℃条件下,以1 cm宽的条形硝酸纤维膜为载体,将携带有pCAM--质粒的根癌农杆菌摇菌培养至OD600=0.7,与震荡培养24 h获得的浓度为106个/mL的尖孢镰刀菌分生孢子悬浮液在含有200mmol/L乙酰丁香酮的共培养基上共培养48 h。(2)转化子继代培养、PCR检测和荧光显微观察结果表明外源基因成功整合到烟草尖孢镰刀菌基因组中并可以进行稳定遗传表达。(3)Sourthern blot分析结果进一步证明T-DNA成功整合到尖孢镰刀菌基因组中,且60%以上为单拷贝插入。【结论】本研究成功构建了根癌农杆菌介导的烟草尖孢镰刀菌遗传转化体系,为烟草尖孢镰刀菌基因功能及病原菌的致病机制研究提供基础。
烟草尖孢镰刀菌;遗传转化;转化子
烟草镰刀菌根腐病是由镰刀菌属病原菌(spp.)引起的一种真菌性病害,尖孢镰刀菌()是优势致病菌,主要从烟株根部入侵,导致根部变黑、叶片变黄萎靡、维管束腐烂,最终植物整株死亡,严重危害烟叶生产[1]。近年来,该病害在我国烟区发生面积逐年增加,造成的损失逐年加大,特别是河南、云南、福建、湖南等各大烟区发生流行性增强,已成为我国烟区重大病害之一[2-5]。明确病原菌致病基因、病原菌与宿主互作机制等,可为病害精准防控提供新靶标。
遗传转化是分离基因、研究基因功能的重要手段,与原生质体介导的传统遗传转化方法相比,根癌农杆菌介导的遗传转化具有操作简便、转化效率高、遗传稳定等优点[6-8],被广泛应用于真菌基因资源开发等相关研究中[8]。绿色荧光蛋白(green fluorescent protein, GFP)基因在动植物和微生物中都能表达,植物病原菌的绿色荧光标记,可实现其定殖、侵染过程等的实时监测,已成为研究病原菌与植物互作的有效方法[9-10]。目前基于农杆菌介导的病原菌绿色荧光蛋白遗传转化技术已被广泛应用于多种丝状真菌的转化,如假禾谷镰刀菌()[11]、禾谷镰刀菌()[12]、稻瘟病菌()[13]、黑曲霉()[14]等。迄今,关于烟草尖孢镰刀菌遗传转化体系建立的研究未见报道。本研究利用根癌农杆菌介导的遗传转化方法转化烟草强致病尖孢镰刀菌B-9-1菌株,旨在建立烟草尖孢镰刀菌最优遗传转化体系,为烟草尖孢镰刀菌致病基因的筛选及其致病机制的研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
烟草尖孢镰刀菌()B-9-1分离自河南省许昌市襄城县烟草病株根部,经单孢分离及致病性测定后保存在河南省农业科学院烟草研究所菌源库。携带含有绿色荧光蛋白()基因和潮霉素B(hygromycin B,)抗性基因pCAM质粒的根癌农杆菌(),由河南农业大学李洪连老师课题组惠赠。
1.1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖液体培养基(PDB)、LB液体培养基、诱导培养基(IM)及共培养培养基(Co-IM)参照高慧敏的方法配置[15]。使用时,1 L Co-IM中加入0.2 mol/L AS 1 mL,1 mol/L MES 40 mL,0.01% FeSO4(w/v)10 mL。
1.1.3 供试引物、抗生素及生化试剂
供试引物见表1。
抗生素、生化试剂及硝酸纤维膜:潮霉素B(CAS#31282-04-9)、硫酸卡那霉素(CAS#25389-94-0)等抗生素及硝酸纤维膜(Lot#R0HB80049)均购自北京索莱宝科技有限公司;地高辛标记试剂盒(Lot#47754321)购自德国Roche公司,I限制性内切酶购自TaKaRa公司;Ezup柱式真菌基因组DNA抽提试剂盒(Lot#E301KA7837)及其他常规分子生物学试剂购自生工生物工程股份有限公司。
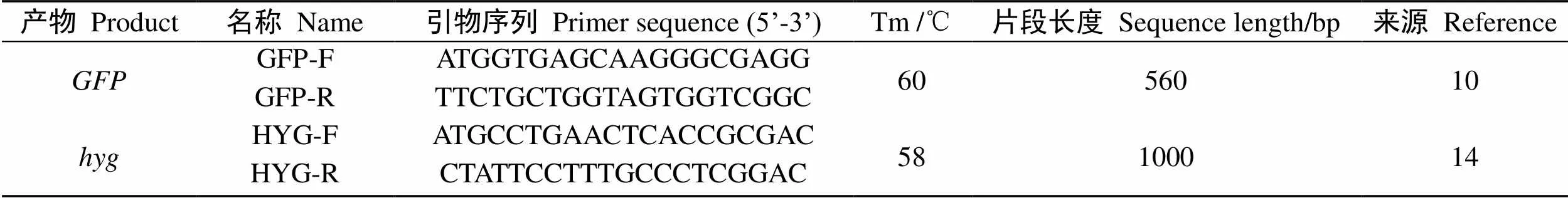
表1 检测引物信息
1.2 试验方法
1.2.1 潮霉素B敏感性测定
从斜面保存的烟草尖孢镰刀菌B-9-1上挑取少许菌丝接种于PDA培养基进行活化培养5 d,采用菌饼接种法,用打孔器在菌落边缘取直径5 mm的菌饼接种于含有潮霉素浓度为0、20、30、40、50、60mg/mL的PDA培养基上,25℃黑暗培养7 d,观察镰刀菌生长状态,筛选能完全抑制尖孢镰刀菌生长的潮霉素B的浓度,每个梯度做3次重复。
1.2.2 根癌农杆菌菌液以及尖孢镰刀菌孢子悬浮液制备
根癌农杆菌菌液的制备:将含有pCAM--质粒的农杆菌菌株在含有卡那霉素(50mg/mL)的LB平板上划线活化,28℃培养48 h,用无菌牙签蘸取单菌落进行菌落PCR,将扩增出和基因的单菌落接种于含有卡那霉素(50mg/mL)的LB液体培养基中,28 ℃、180 r/min振荡培养至OD600=0.5,用IM培养基将其稀释至OD600=0.2后,继续振荡培养至OD600为0.3、0.5、0.7、0.9,备用。
尖孢镰刀菌分生孢子悬浮液制备:将在PDA培养基上活化的尖孢镰刀菌B-9-1用打孔器取菌落边缘3块直径5 mm的菌饼分别接种于3瓶100 mL的PDB培养基中,25℃、180 r/min分别震荡培养24、48、72 h。双层无菌纱布滤除菌丝,将滤液8000 r/min 离心5 min,弃上清,将管底残留的孢子沉淀用无菌水重新悬浮,继续8000 r/min 离心5 min,弃上清,重复3次,备用。
1.2.3 尖孢镰刀菌转化及体系建立
用1.2.2中准备好的农杆菌菌液将1.2.2中制备的镰刀菌孢子悬浮并稀释至106个/mL,取200mL混合液均匀涂布于预先铺有不同形状(1 cm宽条形和直径8.0 cm圆形)无菌硝酸纤维膜的Co-IM培养基上(培养基中乙酰丁香酮浓度分别为200、300和400mmol/mL),25℃分别黑暗培养24、48、72 h后,将硝酸纤维膜翻面转至含有50mg/mL潮霉素B的PDA培养基上,直至菌落长出,挑取单菌落于常规PDA平板上,为初选转化子。
1.2.4 转化子遗传稳定性分析
从1.2.3获得的转化子中随机挑取30个,在常规PDA平板上连续培养5代后,再转接到含有50mg/mL潮霉素B的PDA平板上,以不加潮霉素的PDA平板为对照,观察菌落生长情况,确定转化子的遗传稳定性。
1.2.5 转化子PCR检测
将获得的转化子接种于PDA平板上,25℃培养7 d,收集菌丝,按照真菌DNA提取试剂盒说明提取基因组总DNA,用和的特异性引物,对获得的转化子进行PCR检测,以野生型菌株基因组总DNA为对照。PCR反应体系为:基因组DNA(100 ng/mL)1mL,上下游引物(10mmol/L)各1mL,2×Taq PCR Master Mix 12.5mL,用ddH2O 补足到25mL。PCR反应条件:94℃ 5 min;94℃30 s,表1中Tm退火30 s,72℃ 60 s,34个循环;72℃10 min。1.0%琼脂糖凝胶电泳检测。
1.2.6 转化子荧光显微观察
将获得的转化子接种于PDA培养基上,培养2~3 d,挑取新鲜的菌丝及孢子制成临时玻片,以野生型菌株为对照,在荧光显微镜下观察菌丝及孢子,判断绿色荧光蛋白基因是否整合到尖孢镰刀菌基因组中及其是否正常表达。
1.2.7 Southern印迹杂交(Southern blot)分析
按照地高辛标记试剂盒说明制备DIG标记探针,待测转化子基因组DNA经I单酶切后按照说明书操作程序进行杂交,检测转化子基因组中T-DNA的插入拷贝数。
1.3 数据统计分析
利用DPS 7.05统计软件进行Duncan氏新复极差法(Duncan’s multiple range test)分析。
2 结果与分析
2.1 潮霉素B敏感性测试
潮霉素B敏感性测试结果表明(图1),培养7 d后,潮霉素B浓度为0mg/mL时尖孢镰刀菌可正常生长,潮霉素B浓度≥20mg/mL时B-9-1的生长受到明显抑制,且随着潮霉素B的浓度逐渐加大,抑制作用明显加强。当潮霉素B的浓度≥40mg/mL时完全抑制了尖孢镰刀菌的生长。因为潮霉素B见光易分解,为减少假阳性转化子出现频率,后续研究均采用潮霉素B浓度为50mg/mL开展。
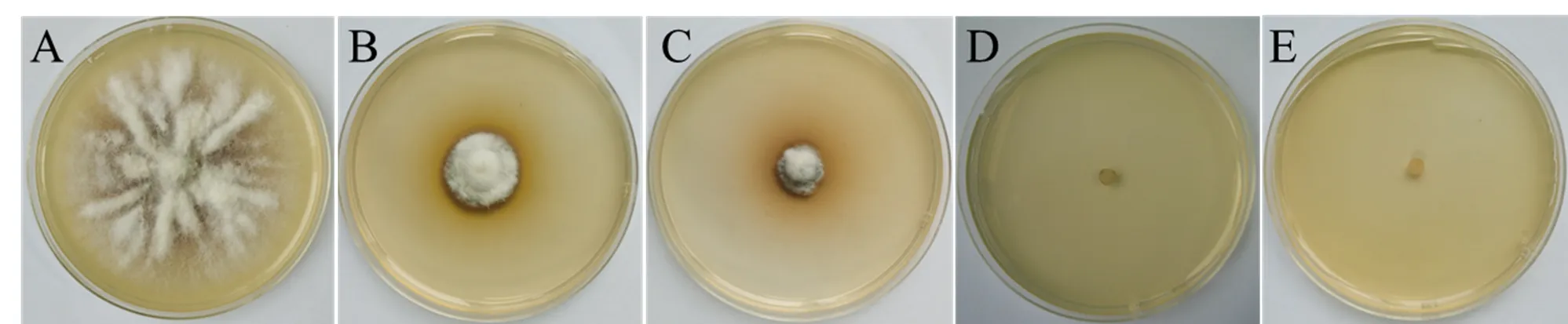
注:潮霉素B的浓度分别是A:0 mg/mL;B:20 mg/mL;C:30 mg/mL;D:40mg/mL;E:50 mg/mL。
2.2 尖孢镰刀菌遗传转化体系建立
对转化受体分生孢子的培养时间、农杆菌菌液浓度、乙酰丁香酮(AS)浓度和共培养的时间以及载体膜形状的优化结果表明,各参数对尖孢镰刀菌的遗传转化均有显著影响(图2),转化受体菌株B-9-1在PDB培养基中震荡培养24 h获得的分生孢子转化效率显著高于其他处理,培养时间长于24 h的孢子悬浮液遗传转化效率均降低;农杆菌菌液OD600=0.7时的转化效率最高,可获得转化子数为223个/106孢子,OD600低于或高于该浓度转化效率均降低;参照其它丝状真菌乙酰丁香酮(AS)浓度为200mmol/mL时,获得的转化子最多,为98个/106孢子,随着乙酰丁香酮浓度增加获得的转化子数量逐渐减少;每皿3个条形硝酸纤维膜时,平均每皿的转化子数目为21个,而当硝酸纤维膜为近培养皿大小的圆形时,平均每皿的转化子数量仅为2个(图3)。因此,尖孢镰刀菌的最优转化体系是在25℃条件下,以1 cm宽的条形硝酸纤维膜为载体,将携带有pCAM--质粒的根癌农杆菌摇菌培养至OD600=0.7,与震荡培养24 h获得的浓度为106个/mL的尖孢镰刀菌分生孢子悬浮液在含有200mmol/L乙酰丁香酮的共培养基上共培养48 h。

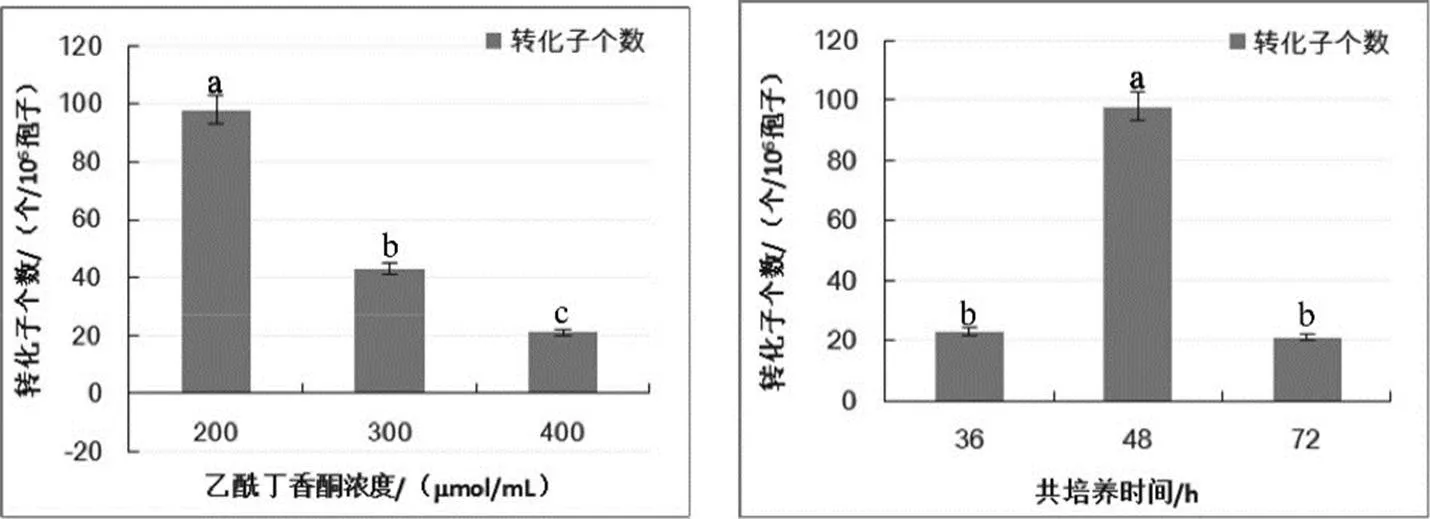

注:图中不同处理中不同小写字母之间表示处理间差异有统计学意义(≤0.05)。在待测指标设置梯度外,其他指标为分生孢子震荡培养24 h、农杆菌OD600=0.7、AS浓度为200mmol/L、共培养48 h、纤维膜为1 cm宽条形。
Note: Value within each column of the same treatment not marked by the same lowercase letters signifies significant difference (≤0.05). In addition to the gradient set for the indexes to be measured,, other indicators are conidia shock culture for 24 h,OD600=0.7, AS concentration of 200mmol/L, co-culture for 48 h and 1cm wide fiber membrane strip.
图2 不同因素(分生孢子培养时间、农杆菌浓度、乙酰丁香酮浓度、共培养时间和硝酸纤维膜形状)对转化效率的影响
Fig. 2 The influence of different factors (Conidia culture time, agrobacterium concentration, Acetosyringone concentration, cocultivation time and shape of hybridization nitrocellulose filter) on transformation efficiency
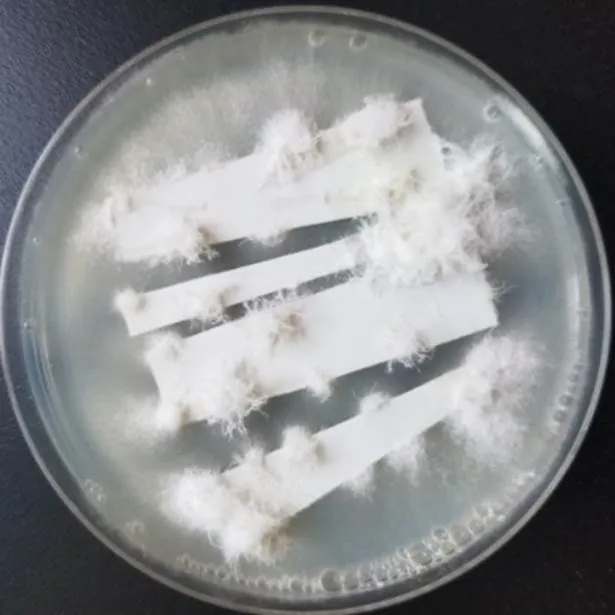
图3 最优条件下转化子获得情况
2.3 转化子稳定性分析
随机挑选的30个B-9-1的转化菌株在常规PDA培养基上连续培养5代后,均可在含有50mg/mL潮霉素B的PDA培养基上正常生长,而野生型菌株不能生长(图4),证明T-DNA成功插入B-9-1的基因组中,并能稳定遗传表达。

2.4 转化子PCR检测
随机挑选20个转化菌株,用和基因引物对进行特异性PCR扩增,除野生型菌株外,所有转化子均可扩增出560bp和1000bp的特异性片段(图5),表明农杆菌质粒中的基因和基因成功整合到尖孢镰刀菌的基因组中。
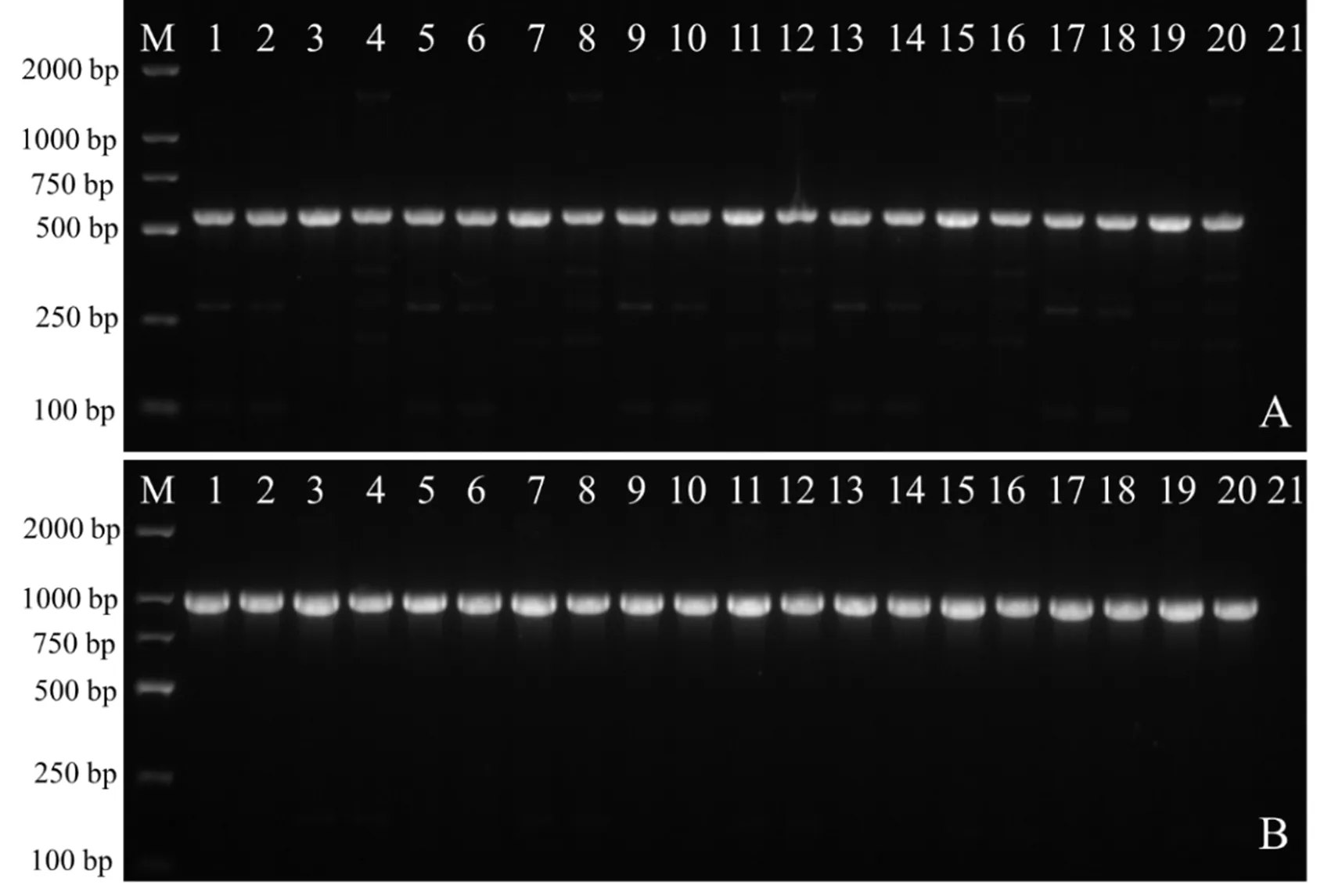
注:A为gfp基因检测;B为hyg基因的检测;M:DL2000 Marker;1~20:转化子;21:ck-野生型尖孢镰刀菌。
2.5 转化子荧光检测
如图6所示,在荧光显微镜下,转化菌株的菌丝、孢子可发出绿色荧光,而野生型菌株的菌丝和孢子则无荧光。说明农杆菌质粒的GFP报告基因已经成功转入尖孢镰刀菌基因组中,并可以正常表达。

图6 转化子荧光显微观察(A为野生型菌株,B为转化子)
2.6 Southern Blot检测
以潮霉素抗性基因片段为探针进行Sourthern杂交,结果显示,随机挑选的6个转化菌株均能检测到特异性条带,其中1、2、3、6为单拷贝,4和5为多拷贝,野生型菌株条带,说明T-DNA成功整合到尖孢镰刀菌基因组中,且60%以上为单拷贝插入。

图7 转化子southern blot检测
3 讨论
根癌农杆菌介导的遗传转化(ATMT)已在真菌遗传转化中得到广泛应用,为真菌寄主互作、侵染过程及菌株的生态学等研究提供了有力的工具[10]。转化效率的高低是评价转化体系的重要指标,不同转化条件直接影响转化的成败和效率[16-17]。不同真菌、甚至同一真菌不同小种之间对遗传转化的条件都有不同的要求[18]。尖孢镰刀菌为烟草镰刀菌根腐病的主要致病菌之一,建立其遗传转化体系,构建突变体库,可为病原菌致病机制和新防治策略提供理论基础和支持。
前人就分生孢子浓度对遗传转化效率的影响开展了较多研究[11,16],但有关分生孢子培养方式、培养时间与遗传转化效率相关性研究鲜见报道。本研究表明,震荡培养24 h后,转化受体培养时间与ATMT转化效率呈负相关,即培养时间越短,越新鲜的分生孢子越有利于转化子的形成。其原因还有待进一步研究。
已有研究表明,随着农杆菌或者受体菌浓度的增加,转化效率明显提高,且两者数量达到一定比例时,可获得最高的转化效率[17]。本研究中,农杆菌OD600在0.3~0.9范围内,农杆菌浓度与转化效率呈现先升后降的倒U型,这与冯泽庆的研究结果基本一致[19],这是因为侵染开始前,农杆菌要附着于受体细胞表面,当附着的农杆菌数量饱和时,再提高其浓度对转化效率影响不大,而农杆菌或者受体细胞浓度过大会对转化造成不良的影响[15],张明星等[20]的研究也证实了这一观点。
共培养时间也是影响遗传转化效率的关键因 素[16]。不同丝状真菌的共培养时间有差异,黄运福等的研究表明少节丛孢菌遗传转化最适共培养时间为60 h[21],杨越寒等的研究表明油菜黑胫病菌最适共培养时间为72 h[22]。本研究中,尖孢镰刀菌与农杆菌的最佳共培养时间为48 h。这与冯庆泽的结果一致[19]。共培养时间太短不能形成转化子,而共培养时间太长容易产生假阳性[23],同时也会由于转化子太大使得转化子不易分辨[17]。
已有研究表明,在一定的浓度范围内乙酰丁香酮(AS)的浓度与转化效率呈正相关,但当乙酰丁香酮浓度达到一定程度会降低转化效率[24]。本实验的研究结果也验证了这一点,当AS浓度高于200mmol/L时,随着AS浓度增加,转化效率下降,这与油菜黑胫病菌、葡萄灰葡萄孢等病原菌的转化研究结果一致[25-26]。本研究还发现共培养时硝酸纤维膜的形状对转化效率也有较明显的影响,用1 cm宽的条形硝酸纤维膜的转化效率为用圆形硝酸纤维膜的近10倍,此前并未有关于硝酸纤维膜形状对转化效率影响的报道,本研究中尖孢镰刀菌B-9-1转化子基本位于硝酸纤维膜边缘,可能与孢子萌发后菌丝穿透力有限有关,靠近硝酸纤维膜边缘较容易穿透,条形纤维膜增加了边缘面积,转化子数量增加,关于导致这一结果的具体原因还有待进一步研究。
4 结论
本研究建立了根癌农杆菌介导的尖孢镰刀菌遗传转化体系,成功将携带和基因的T-DNA整合到尖孢镰刀菌基因组中,转化菌株中的GFP蛋白和潮霉素磷酸转移酶可以正常表达,稳定遗传,为烟草镰刀菌根腐病害主要病原尖孢镰刀菌致病基因的筛选及其致病机制的研究奠定基础。
[1] Berruezo L A, MERCADO CÁRDENAS G E, HARRIES E, et al. Characterization ofspecies associated with tobacco diseases in Northwestern Argentina[J]. European Journal of Plant Pathology, 2018, 151:1065-1079.
[2] 于庆涛,姚廷山. 烟草镰刀菌根腐病研究进展[J]. 安徽农业科学,2018, 46(17): 34-36.
YU Qingtao, YAO Tingshan. Advances in tobacco root rot caused by[J]. Journal of Anhui Agricultural Sciences, 2018, 46(17):34-36.
[3] 田艳艳,王伟杰,苗圃,等. 河南烟草镰刀菌的初步分子鉴定[J]. 烟草科技,2014(11):89-92.
TIAN Yanyan, WANG Weijie, MIAO Pu, et al. Preliminary molecular identification ofinfecting tobacco in Henan[J]. Tobacco Science Technology, 2014(11):89-92.
[4] 姚晓远. 影响烟草根腐病发生的微生态机制及其调控研究[D]. 重庆:西南大学,2019.
YAO Xiaoyuan. Study on the microecological mechanisms and regulation of tobacco root rot[D]. Chongqing: Southwest University, 2019.
[5] 邱睿,李芳芳,徐敏,等. 烟草品种对镰刀菌根腐病的抗性鉴定[J]. 中国烟草学报,2019, 25(4): 59-63.
QIU Rui, LI Fangfang, XU Min, et al. Molecular identification and pathogenicity analysis of tobaccospp. in Henan[J]. Acta Tabacaria Sinica, 2019, 25(4): 59-63.
[6] SØRENSEN L Q, LYSØE E, LARSEN J E, et al. Genetic transformation ofbymediated transformation and the development of a USER-Brick vector construction system[J]. Bmc Molecular Biology, 2014, 15(1): 241-244.
[7] SHAO C, YIN Y, QI Z, et al.-mediated transformation of the entomopathogenic fungus[J]. Fungal Genetics & Biology, 2015, 83:19-25.
[8] 胡懋,曾杨璇,苗华彪,等. 根癌农杆菌介导的真菌遗传转化的研究及应用[J]. 微生物学通报,2021, 48(11):4344-4363.
HU Mao, ZENG Yangxuan, MIAO Huabiao, et al. Research and application of-mediated fungal genetic transformation[J]. Microbiology China, 2021, 48(11):4344-4363.
[9] ZHANG P, XU B, WANG Y, et al.- mediated transformation as a tool for insertional mutagenesis in the fungus[J]. Mycological Research, 2008, 112(8): 943-949.
[10] LORANG, J, TUORI, R, MARTINEZ, J, et al. Green fluorescent protein is lighting up fungal biology[J]. Applied and Environmental Microbiology. 2001, 67: 1987-1994.
[11] 邢小萍,张盼盼,丁胜利,等. 根癌土壤杆菌介导的假禾谷镰刀菌遗传转化体系的优化[J]. 农业生物技术学报,2017, 25(11): 1887-1894.
XING Xiaoping, ZHANG Panpan, DING Shengli, et al. Optimazing of-mediated genetic transformation system in[J]. Journal of Agricultural Biotechnology, 2017, 25(11):1887-1894.
[12] JANSEN C, WETTSTEIN D V, SCHÄFER W, et al. Infection patterns in barley and wheat spikes inoculated with wild-type and trichodiene synthase gene disrupted[J]. Proceedings of the National Academy of Sciences of the USA, 2005, 102(46): 16892-16897.
[13] STEPHANIE, WIDYASTUTI U, WIYONO S. Introduction of the serine green fluorescent protein (sgfp) gene intodc4 isolated fromusing-mediated genetic transformation[J]. Biotropia, 2015, 22(1): 73-79.
[14] BEKKER C D, VELUW G J V, VINCK A, et al. Heterogeneity ofmicrocolonies in liquid shaken cultures[J]. Applied and Environmental Microbiology, 2011, 77(4): 1263-1267.
[15] 高惠敏. 稻瘟病菌液泡运输途径相关基因和的克隆和功能分析[D]. 杭州:浙江大学,2012.
GAO Huimin. The functional analysis of two vacuolar trafficking-related genesandin[D]. Zhejiang University, 2012.
[16] 张盼盼. 农杆菌介导的假禾谷镰刀菌()的遗传转化及突变体库的构建[D]. 郑州:河南农业大学,2017.
ZHANG Panpan.-mediated transformation of theand construction of mutant library[D]. Zhengzhou: Henan Agricultural University, 2017.
[17] 陈东亮,李纪元, 范正琪, 等. 根癌农杆菌介导真菌遗传转化的影响因素及应用[J]. 安徽农业科学, 2010, 38(7): 3317-3320.
CHEN Dongliang, LI Jiyuan, FAN Zhengqi, et al. Influencing factors of transformation in fungi mediated byand its application[J]. Journal of Anhui Agricultural Sciences, 2010, 38(7): 3317-3320.
[18] 高兴喜,杨谦,郭兆奎,等. 影响根癌农杆菌介导的木霉菌遗传转化因素分析[J]. 微生物学通报,2005, 32(1):74-78.
GAO Xingxi, YANG Qian, GUO Zhaokui, et al. Factors influencing-mediated transformation in[J]. Microbiology China, 2005, 32(1):74-78.
[19] 冯泽庆. 根癌农杆菌介导尖孢镰刀菌T-DNA插入突变的研 究[D]. 长春:吉林大学,2018.
FENG Zeqing. Analysis of Fusarium oxysporum based on the-mediated T-DNA insertional mutagenesis[D]. Jilin University, 2018.
[20] 张明星, 尹靖欣, 李丹妮, 等. 农杆菌介导鸡(土从)菌遗传转化体系构建[J]. 食用菌学报, 2021, 28(5): 12-19.
ZHANG Mingxing, YIN Jingxin, LI Danni, et al. Construction of-mediated transformation system insp. J132[J]. Acta Edulis Fungi, 2021, 28(5): 12-19.
[21] 黄运福,贡莎莎,孟庆玲,等. 根癌农杆菌介导的少孢节丛孢菌遗传转化体系研究[J]. 动物医学进展,2021, 42(2): 60-65.
HUANG Yunfu, GONG Shasha, MENG Qingling, et al. Study on-mediated transformation of Arthrosporium oligospora[J]. Progress in Veterinary Medicine, 2021, 42(2): 60-65.
[22] 杨越寒,张静,杨龙,等. 油菜黑胫病菌T-DNA插入诱变因素优化及突变体筛选[J]. 中国油料作物学报,2021, 43(6): 1115-1125.
YANG Yuehan, ZHANG Jing, YANG Long, et al. Optimization of T-DNA insertion-mediated mutagenesis ofand mutant screening[J]. Chinese Journal of Oil Crop Sciences, 2021, 43(6):1115-1125.
[23] TAKAHARA H, TSUJI G, KUBO Y, et al.-mediated transformation as a tool for random mutagenesis of[J]. Journal of General Plant Pathology, 2004, 70(2): 93-96.
[24] TSUJI, G, FUJII, S, FUJIHARA, N, et al. Agrobacterium tumefaciens-mediated transformation for random insertional mutagenesis in Colletotrichum lagenarium[J]. Journal of General Plant Pathology, 2003, 69: 230-239.
[25] 宋培玲,皇甫海燕,史志丹,等. 农杆菌介导油菜黑胫病菌遗传转化[J]. 中国油料作物学报,2021, 43 (2):293-299.
SONG Peiling, HUANGPU Haiyan, SHI Zhidan, et al.-mediated transformation of[J]. Chinese Journal of Oil Crop Sciences, 2021, 43 (2):293-299.
[26] 李廷刚,巩东营. 农杆菌介导葡萄灰葡萄孢遗传转化条件优 化[J]. 山东农业科学,2021, 53 (10):97-101.
LI Tinggang, GONG Dongying. Optimization of-mediated transformation of[J]. Shandong Agricultural Sciences, 2021, 53 (10):97-101.
Construction of-mediated genetic transformation system of tobacco
LI Juan1,2, QIU Rui1*, ZHANG Yingying1, LI Xiaojie1, LI Chengjun1, LI Shujun1
1 Key Laboratory for Green Preservation & Control of Tobacco Diseases and Pests in Huanghuai Growing Area, Tobacco Research Institute, Henan Academy of Agricultural Sciences, Xuchang 461000, China;2 Dingxi Plant Protection and Quarantine Station, Dingxi 743000, China
Tobacco root rot caused byis one of the main devastating diseases in tobacco (L.) production. Identifying the pathogenic genes of plant pathogen could provide new targets for disease accurate control. The objectives of this study are to construct a stable genetic transformation system ofby usingcarrying pCAM-GFP-hyg plasmid to transform the conidia of pathogenic(B-9-1), and obtain the transformant strains of B-9-1 with green fluorescent protein (GFP).(1) The optimal transformation system ofwas obtained under following condition: the optimal lethal concentration of hygromycin was 50mg/mL, co-culturing of the conidia suspension with a concentration of 106/mL (that obtained by shaking culture for 24 h) andwith an OD600value of 0.7 on co-IM agar containing 200mmol/L Acetosyringone under 25℃ for 48 h. (2) The T-DNA was successfully inserted into the genome of, which was capable of conducting stable genetic expression by subculturing, molecular analysis and fluorescence microscopic verification. (3) The results of Sourthern blot analysis further demonstrated that T-DNA was successfully integrated intogenome, and more than 60% was single copy insertion.-mediated genetic transformation of tobaccowas successfully established, which laid foundation for the study of pathogenic mechanism and analysis of pathogenic genes of tobacco.
tobacco; genetic transformation; transformant
Corresponding author. Email:qiurui19840414@hotmail.com
河南省农业科学院基础性科研工作项目“烟草尖孢镰刀菌致病相关基因的筛选与功能研究”(2021ZC25);河南省烟草公司科技项目“烟草根腐病害发生的微生物群落分析和生态风险预警研究”(2020410000270012);河南省农业科学院优秀青年科技基金计划项目“烟草茄病镰刀菌复合群系统发育与致病特性研究”(2022YQ09);河南省农业科学院科技创新团队“烟草主要病虫害绿色防控关键技术研究与应用”(2022TD26)。
李娟(1993—),助理研究员,主要从事烟草镰刀菌根腐病绿色防控相关研究,Tel:0374-4518504,Email:2672717259@qq.com
通讯作者:邱睿(1984—),主要从事烟草镰刀菌根腐病致病机理、监测预警及绿色防控相关研究,Tel:0371-86538118,Email:qiurui19840414@hotmail.com
2022-01-06;
2022-05-26
李娟,邱睿,张盈盈,等.根癌农杆菌介导的尖孢镰刀菌遗传转化体系构建[J]. 中国烟草学报,2022,28(4).LI Juan, QIU Rui, ZHANG Yingying, et al. Construction of agrobacterium tumefaciens-mediated genetic transformation system of tobacco Fusarium oxysporum[J]. Acta Tabacaria Sinica, 2022,28(4). doi:10.16472/j.chinatobacco.2022.005

