基于非靶向代谢组学的红花大金元不同生育期烟叶代谢图谱差异分析
向海英,刘欣,逄涛,曾婉俐,许力,高茜,邓乐乐,张建铎,李雪梅,李勇,孔维松*
基于非靶向代谢组学的红花大金元不同生育期烟叶代谢图谱差异分析
向海英1,刘欣1,逄涛2,曾婉俐1,许力1,高茜1,邓乐乐1,张建铎1,李雪梅1,李勇3,孔维松1*
1 云南中烟工业有限责任公司技术中心,云南省烟草化学重点实验室,云南昆明红锦路181号 650231;2 云南省烟草农业科学研究院,云南昆明圆通街33号 650051;3 江苏省农业科学院农业资源与环境研究所,江苏南京钟灵街50号 210014
【目的】为分析不同生育期烟草烟叶代谢图谱差异。【方法】以烟草品种红花大金元为研究对象,采集团棵期、现蕾期和成熟期烟叶样品,利用LC-QTOF/MS进行代谢指纹图谱检测,利用统计分析方法对差异代谢物进行筛选,基于Spearman相关分析计算代谢物之间的相关性系数,利用MetaboAnalyst软件进行代谢通路富集分析。【结果】(1)不同生育期烟草样品代谢图谱存在明显差异,共鉴定出245个差异代谢物,其中类黄酮、有机酸、氨基酸、核苷、生物碱、脂类等物质种类最多。(2)烟碱及其衍生物,如烟碱-1-氧代、麦斯明、假木贼碱、马钱子碱、新烟碱、2,3'-二联吡啶,均随烟草生育期而逐渐累积,而与烟碱合成相关的前体物质,如精氨酸、亚精胺、腐胺、羟基丁酸等,均随着生育进程逐渐减少,且与烟碱含量显著负相关。(3)与次级代谢物合成相关氨基酸和有机酸等物质在团棵期或现蕾期含量较多,而在成熟期含量较低,与成熟期次级代谢物合成有关。(4)大部分类黄酮和酚酸组分在成熟期时含量较高,可以提高烟草抗病和抗逆能力。(5)相关性分析发现,烟碱含量与谷氨酸、泛酸、吡哆醛、蜜二糖、3-羟基邻氨基苯甲酸和顺式玉米素-o-葡萄糖苷等物质显著正相关,可能是调控烟叶中烟碱含量的重要标志物。【结论】基于代谢组学揭示了不同生育期烟草代谢物变化规律,为优质烟草育种及品质分析提供技术支撑。
烟草;代谢组学;生育期;烟碱;差异代谢物
烟草代谢物非常丰富,理化性质和含量差异较大,给烟草化学及代谢规律研究带来挑战[1-2]。传统烟草化学研究主要集中于某一类化学成分或某几种重要物质,如萜类、生物碱、多酚类等,很难全面系统地阐述烟草代谢网络[3]。因此,研究烟草品质形成过程中各类代谢产物的动态变化及其之间的相互作用关系,将能揭示烟草品质形成的代谢物质基础[4]。
代谢组学可高通量地对样品中小分子代谢物进行快速定性定量分析,已应用于烟草代谢及品质分析[5-7]。Li等基于代谢组学发现不同生育期烟草代谢差异很大,甾醇、氨基酸随生育进程逐渐减少,而生物碱含量逐渐累积[8]。Zhang等发现烟草发育过程中与糖代谢、氨基酸代谢、莽草酸代谢和萜类代谢相关的代谢产物含量均呈先升高后降低的趋势,成熟期烟草中间叶的糖含量最高,而下部叶的有机酸含量最高[9]。Zhao等发现烟草打顶可以促进上部叶片积累次生代谢产物,延缓叶片衰老[10]。Zhao等发现大理地区烟叶中糖磷酸和短链有机酸(柠檬酸、苹果酸、异柠檬酸)含量较多,而许昌地区的烟草烟叶中与莽草酸-苯基丙酸代谢途径相关的防御代谢物含量较高[11]。本研究基于非靶向代谢组学,解析了不同生育期红花大金元烟叶各类物质的累积规律,以期为优质烟草育种及栽培提供依据。
1 材料与方法
1.1 实验材料
采集团棵期长势一致的红花大金元烟株中部第8叶位叶片,现蕾期与成熟期长势一致的中部第10叶位的叶片,每个样品取样量大于5 g,迅速剪碎后,用锡箔纸包裹,放入液氮中,每个时期采集6个生物学重复样本,在实验室内冷冻干燥,研磨粉碎后,-80℃保存备用。
1.2 实验方法
1.2.1 样品提取
准确称量100 mg样品,加入2500 μL提取液(甲醇水,体积比=4∶1),加入瓷珠,震荡提取20 min,12000 rpm离心15 min,使用0.22 μm有机相针孔过滤器过滤后,转移到LC进样小瓶,每个样本各取150 μL混合成QC样本,待LC-QTOF/MS检测。
1.2.2 仪器分析
利用液相色谱串联飞行时间质谱(LC-QTOF/MS,AB Sciex 5600+)测定烟草样品代谢指纹图谱,每个样品均以正电离和负电离模式进行检测,其中正电离模式流动相为0.1%甲酸水溶液和乙腈,负电离模式流动相为5 mmol/L醋酸铵水溶液和乙腈,所有样品均以信息依赖采集(IDA)模式下采集,正电离和负电离模式下的离子源电压分别为5500 V和4500 V,正电离和负电离下的碰撞能量(CE)分别设置为-30 V和30 V。在数据采集之前,将QC样品重复进样5次用于平衡质谱仪,随后每5个样品进行1次QC检测。
1.2.3 数据分析
采用MS-DIAL软件对代谢组学数据进行解卷积,得到不同组分的质谱峰信息,包括保留时间、分子离子峰、同位素质谱峰、二级质谱、峰面积等,采用NIST、METLIN(https://metlin.scripps.edu)、HMDB(https://hmdb.ca/)及本地数据数据库进行检索,对比出峰时间、一级质谱精确质量数及二级质谱谱图[12]。按不同样品中代谢物的峰面积构建代谢物峰表,利用方差分析(ANOVA,<0.05)对3个时期烟草代谢物进行差异显著性分析,基于t-test(<0.05)、偏最小二乘判别分析(VIP值>1)和倍数变化(fold- change>1.20或<0.83)对临近生育期差异代谢物进行筛选。基于Spearman相关分析计算不同代谢物间相关性系数,采用<0.05和|r|>0.7筛选显著相关性代谢物,利用MetaboAnalyst软件(https://www.metaboanalyst. ca/)进行代谢通路富集分析[13]。
2 结果
2.1 差异代谢物分析
利用MS-DIAL软件对质谱数据进行解析,共识别出4086个含有二级碎片的一级质谱峰,其中正模式有3241个,负模式有845个。基于方差分析及质谱数据库比对,共鉴定出245个显著变化代谢物(<0.05),包括44个类黄酮、33个有机酸、28个氨基酸、18个核苷、18个生物碱、12个酚酸、12个脂类、8个糖、6个胺、5个甾醇、4个维生素、4个香豆素、3个激素、32个其他,不同生育期显著变化代谢物丰度如图1所示。邻近生育期烟草样品比较中,现蕾期代谢物含量显著高于团棵期的有52种,主要包括类14个黄酮、11个生物碱、7个有机酸、2个氨基酸等,其中倍数变化大于2的有11种,包括麦斯明、丁二酸、山奈酚-3--松香苷-7--鼠李糖苷、异樱素-7--新橙皮苷、烟碱、红景天苷、降烟碱、新烟碱、山奈酚、柚皮素-7--葡萄糖苷、东莨菪亭;团棵期代谢物含量显著高于现蕾期的有93种,主要包括16个有机酸、13个氨基酸、13个类黄酮、7个酚酸、6个核苷、5个糖、5个脂类、4个生物碱、3个香豆素等,超过2倍的有32种,包括亚麻酸、十四烷酸、2-异丙基苹果酸、乙酸、精氨酸、香豆酰奎宁酸、N-乙酰神经氨酸、香豆酸、N-果糖基焦谷氨酸、苯丙氨酸、矢车菊素胺-3--半乳糖苷、山奈酚-3--葡萄糖苷、腺苷、瓜氨酸、柠檬酸、LPC 18:1、N-甲酰基降烟碱、亚精胺、亚油酸、金丝桃苷、十八烷酸、丝氨酸、3,6-二氢烟酸、乳酸、5'-单磷酸腺苷、谷氨酰胺、儿茶酸、6,7-二羟基香豆素、黄嘌呤、花旗松素、5-氨基戊酸、咖啡酸。成熟期代谢物含量显著高于现蕾期的有58种,主要包括12个类黄酮、12个生物碱、5个有机酸、4个氨基酸、4个核苷、3个酚酸、2个激素、2个糖等,其中倍数变化大于2的有11种,包括吡哆醛、NAD+、泛酸、腺苷、红景天苷、马钱子碱、顺式玉米素--葡萄糖苷、高精氨酸、2,3'-二联吡啶、矢车菊素-3-葡萄糖苷;现蕾期代谢物含量显著高于成熟期的代谢物45种,主要包括10个氨基酸、9个有机酸、4个甾醇、3个核苷、3个类黄酮、3个生物碱、2个脂类等,其中倍数变化大于2的有12种,包括鸟氨酸、玉米黄二呋喃素、-果糖基焦谷氨酸、硫酸茉莉酸、4-甲基-5-羟乙基噻唑、天冬氨酸、苯醚甲环唑、亚精胺、-甘油酸、-烟酰胺单核苷酸、亚油酸。
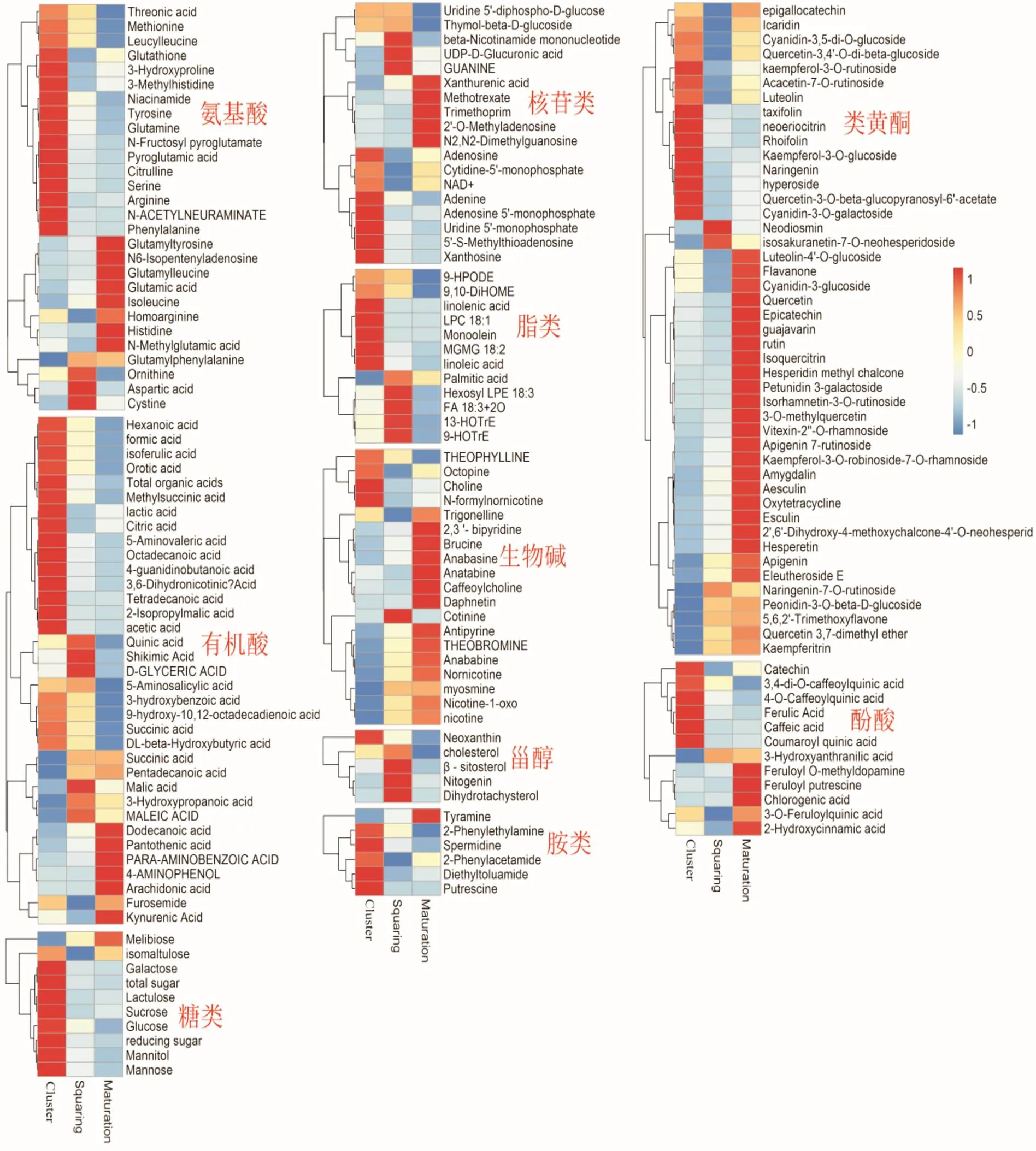
图1 热图分析不同生长期烟草代谢物丰度变化
2.2 相关性分析
代谢物之间的相关性筛选结果表明(图2),共有12110个代谢物对具有显著相关性,其中显著正相关8244对,显著负相关3866对,显著正相关的代谢物对个数远多于显著负相关的代谢物对。显著正相关代谢物对具有相似的化学成分、生物学功能或同属的特征。例如,烟碱及其衍生物之间存在显著正相关性。正相关个数最高的代谢物为槲皮素、对氨基苯甲酸、异槲皮苷、甲花翠素3-半乳糖苷、甲氧基苯唑、5-氨基戊酸、4--咖啡酰奎宁酸、红景天苷、异鼠李素-3--芸香苷、秦皮甲素、烟碱、顺式玉米素-o-葡萄糖苷、马钱子碱。负相关个数最高的代谢物为3-羟基邻氨基苯甲酸、蜜二糖、亮氨酰亮氨酸、东莨菪亭、山奈酚、新烟碱、玉米黄二呋喃素、4-甲基-5-羟乙基噻唑、降烟碱、--羟基丁酸、苯并噻唑、胸腺酚、--葡萄糖、9-HPODE、麦斯明和氢奎尼丁。

注:其中红色为显著正相关,蓝色为显著负相关,白色为无显著差异,后同。
参与烟碱代谢通路代谢物与其他代谢物的相关性分析结果表明(图3),与烟碱含量显著正相关的代谢物有28个,包括9个生物碱、4个类黄酮、3个氨基酸、2个激素等,与烟碱含量显著负相关的代谢物有63个,包括12个氨基酸、11个有机酸、7个糖、4个核苷、4个脂类等,这些代谢物可能是调控烟叶中烟碱累积的重要标志物。
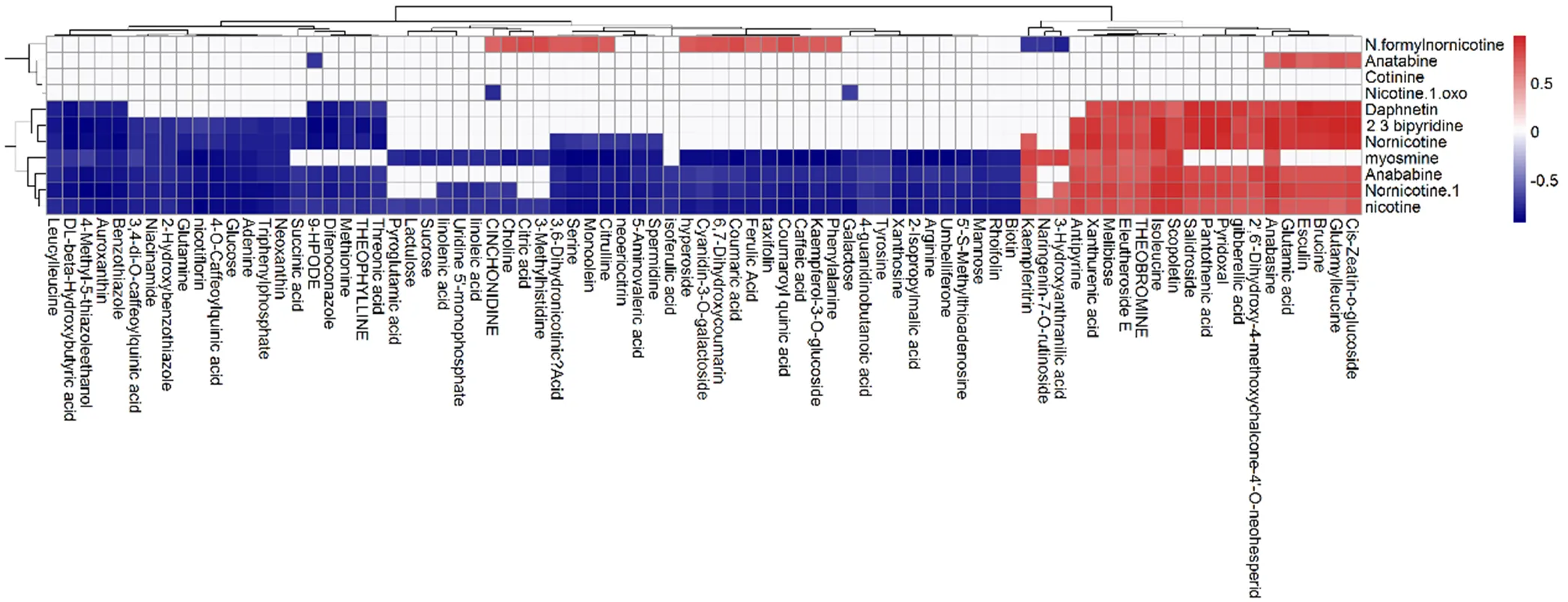
图3 参与烟碱代谢通路代谢物与其他代谢物的相关性分析
2.3 代谢通路富集分析
现蕾期与团棵期比较组中代谢通路富集分析结果表明(图4a),差异代谢物主要富集的代谢通路为亚油酸代谢、异喹啉生物碱生物合成、苯丙氨酸代谢、黄酮和黄酮醇生物合成、精氨酸和脯氨酸代谢、花青素生物合成和维生素B6代谢等。成熟期与现蕾期比较组中代谢通路富集分析结果表明(图4b),差异代谢物主要富集的代谢通路为亚油酸代谢、异喹啉生物碱生物合成、谷胱甘肽代谢、花青素生物合成、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸生物合成、烟酸和烟酰胺代谢等。基于烟碱含量显著相关代谢物的代谢通路富集分析结果表明(图4c),与烟碱含量显著相关代谢物主要富集的代谢通路为亚油酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、异喹啉生物碱生物合成、苯丙氨酸代谢、精氨酸生物合成、精氨酸和脯氨酸代谢、维生素B6代谢、甘氨酸、丝氨酸和苏氨酸代谢、半胱氨酸和蛋氨酸代谢、柠檬酸循环和嘧啶代谢等,这些代谢通路可以作为烟草烟碱代谢的潜在调控通路。

注:(a)现蕾期与团棵期相比差异代谢物的代谢通路富集分析;(b)成熟期与现蕾期相比差异代谢物的代谢通路富集分析;(c)与烟碱含量显著相关代谢物的代谢通路富集分析。
3 讨论
生物碱类物质是烟草的主要成分之一,不仅参与植物的生理代谢,也影响烟叶品质[1]。烟碱是烟叶中含量最多的生物碱组分,本研究发现,烟叶中烟碱含量随着生育进程逐渐累积,与Li等报道的结果一致[8]。此外,本研究还鉴定出17个生物碱组分,其中大部分生物碱含量随着生育进程逐渐累积,且与烟碱含量显著正相关,包括烟碱-1-氧代、可可碱、瑞香碱、麦斯明、咖啡酰胆碱、新烟草碱、假木贼碱、马钱子碱、新烟碱、2,3'-二联吡啶等,这些代谢物大部分参与烟碱合成及代谢[14]。另外少部分生物碱含量随着生育进程逐渐减少,包括胆碱、茶碱、-甲酰基降烟碱,而可替宁在现蕾期含量较高。本研究发现,烟碱合成前体物质精氨酸、亚精胺、腐胺、羟基丁酸均随着生育进程逐渐减少,且与烟碱含量显著负相关,可能是由于烟碱合成而消耗[8, 15]。
氨基酸是烟草初级代谢的重要组成部分,在烟草生理过程中发挥重要作用[16]。本研究发现,大多数与蛋白质合成相关的氨基酸,如丝氨酸、精氨酸、苯丙氨酸、瓜氨酸、谷氨酰胺、谷胱甘肽、酪氨酸,均在团棵期含量较高,而在成熟期含量较低,与Li等报道的结果一致[8],其中精氨酸、苯丙氨酸、谷氨酰胺、酪氨酸是烟碱及次级代谢物合成的重要前体物质[17]。烟草叶片衰老早期游离氨基酸易从老叶转运到幼嫩叶片上,导致成熟期叶片中大部分氨基酸含量减少[8]。此外,本研究还发现少部分氨基酸在成熟期含量较高,包括组氨酸、异亮氨酸和谷氨酸,而胱氨酸、鸟氨酸和天冬氨酸在现蕾期含量较高。鸟氨酸作为烟碱重要的前体物质[18],由于烟碱合成的消耗在成熟期含量显著下降,天冬氨酸可合成鸟氨酸[19],两者变化趋势一致。相关性分析发现,丝氨酸、瓜氨酸、苯丙氨酸、谷氨酰胺、亮氨酰亮氨酸、酪氨酸、苏氨酸、蛋氨酸、3-甲基组氨酸、焦谷氨酸均与烟碱含量显著负相关,而-谷氨酰胺基亮氨酸、谷氨酸、异亮氨酸与烟碱含量显著正相关,这些代谢物可能是调控烟叶中烟碱合成与代谢的重要标志物。基于烟碱含量显著相关代谢物的代谢通路富集分析结果,发现丙氨酸、天冬氨酸和谷氨酸代谢、苯丙氨酸代谢、精氨酸生物合成、精氨酸和脯氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、半胱氨酸和蛋氨酸代谢均可能与烟碱代谢相关,这些代谢通路可作为烟草烟碱合成与代谢的潜在调控通路。
糖和有机酸是烟草构建碳骨架和提供能量所需的代谢资源,也是影响烟草风味的重要因素[20]。苹果酸、柠檬酸和丁二酸是三羧酸循环中的中间代谢物质,但它们的累积趋势不一致,柠檬酸和丁二酸在团棵期含量较多,而苹果酸在现蕾期含量较高,3个有机酸在成熟期时含量均比较少[8]。此外,本研究发现,大多数短链有机酸含量随着烟草生育进程而逐渐减少,如2-异丙基苹果酸、乳酸、5-氨基戊酸、4-胍基丁酸、甲基琥珀酸、犬尿酸、乳清酸、羟基丁酸、己酸、丁二酸,可能是为其他物质提供碳骨架而被消耗,如烟碱、次级代谢物(酚酸、类黄酮、萜类)等[9, 21]。相关性分析发现3,6-二氢烟酸、2-异丙基苹果酸、5-氨基戊酸、乳酸、乙酸、十四烷酸、3-羟基-4-甲氧基肉桂酸、4-胍基丁酸与烟碱含量显著负相关,而泛酸、丁二酸含量与烟碱含量显著正相关,这些代谢物可能是调控烟叶中烟碱代谢的重要标志物。糖类物质中,葡萄糖、半乳糖、甘露糖、乳果糖、蔗糖均在团棵期含量较高,而在现蕾期和成熟期时含量较少,与有机酸变化比较相似,而蜜二糖则随着生育进程逐渐累积,与Li等报道的结果一致[8]。
脂类是细胞膜的主要成分,在信号转导、膜运输和细胞骨架重排等细胞功能中发挥多种作用,同时也是香气组分的重要前体物质[22]。本研究发现,大部分脂类物质均在苗期和现蕾期含量较高,而在成熟期含量较少,与Zhang等报道的结果一致[9]。此外,亚油酸、亚麻酸、单油素、9-HPODE均与烟碱含量显著负相关。
次级代谢产物可介导烟草与环境的相互作用[23]。烟草生物代谢途径主要有苯丙烷代谢途径、异戊二烯代谢途径和生物碱合成途径等[11, 24]。酚酸和类黄酮是苯基丙酸途径的重要合成物质,本研究发现,酚酸组分中,咖啡酸、3,4-咖啡奎尼酸、4-咖啡酰奎宁酸、异芥酸、阿魏酸均在团棵期含量最高,而绿原酸、3-羟基邻氨基苯甲酸、阿魏酰腐胺、阿魏酰邻甲基多巴胺含量均在成熟期最高,且与烟碱含量显著正相关。本研究发现,大部分类黄酮在成熟期含量较高,叶片中类黄酮合成增多导致合成前体物质苯丙氨酸的消耗,致使苯丙氨酸在成熟期含量较低,与Zhang等报道的结果一致[9]。烟叶衰老过程中会产生大量活性氧自由基,烟草会诱导类黄酮化合物的合成以清除自由基,减缓叶片衰老[8]。成熟期烟草叶片中类黄酮累积也有助于提高烟草的抗病、抗逆能力[25-26]。此外,多酚类物质是烟草重要香味组分的前体物质,而成熟期大部分酚酸和类黄酮累积有利于香气组分的合成[27]。相关性分析发现新枇杷苷、花旗松素、山奈酚-3--葡萄糖苷、野漆树甙、金丝桃苷、矢车菊素-3--半乳糖苷与烟碱含量显著负相关,而柚皮素-7--葡萄糖苷、秦皮甲素、山奈酚与烟碱含量显著正相关。
4 结论
本研究基于LC-QTOF/MS的非靶向代谢组学,解析了不同生育期烟草烟叶代谢图谱差异,研究发现(1)不同生育期烟草样品代谢图谱存在明显差异,共鉴定出245个差异代谢物,其中类黄酮、有机酸、氨基酸、核苷、生物碱、脂类等物质种类最多。(2)烟碱及其衍生物,如烟碱-1-氧代、麦斯明、假木贼碱、马钱子碱、新烟碱、2,3'-二联吡啶,均随烟草生育进程而逐渐累积,而与烟碱合成相关的前体物质,如精氨酸、亚精胺、腐胺、羟基丁酸等,均随着生育进程逐渐减少,且与烟碱含量显著负相关。(3)与次级代谢物合成相关氨基酸和有机酸等物质在苗期或现蕾期含量较多,而在成熟期含量较低;脂类和胺类物质均在苗期含量较高,甾醇类物质在现蕾期含量较高;大部分类黄酮和酚酸组分在成熟期时含量较高,利于烟叶保护和香气组分的合成。(4)谷氨酸、泛酸、吡哆醛、蜜二糖、3-羟基邻氨基苯甲酸和顺式玉米素--葡萄糖苷与烟碱含量显著正相关,其可能是调控烟叶中烟碱合成的潜在标志物。
[1] 张丽,姬厚伟,黄锡娟,等. 植物代谢组学及其在烟草上的应用进展[J]. 中国烟草学报,2015, 21(5): 126-134.
ZHANG Li, JI Houwei, HUANG Xijuan, et al. Plant metabolomics and its application in tobacco[J]. Acta Tabacaria Sinica, 2015, 21(5): 126-134.
[2] 王小莉,付博,赵铭钦,等. 代谢组学技术在烟草研究中的应用进展[J]. 中国烟草科学,2016, 37(1): 89-96.
WANG Xiaoli, FU Bo, ZHAO Mingqin. Research of metabolomics in tobacco[J]. Chinese Tobacco Science, 2016, 37(1): 89-96.
[3] 郑庆霞,刘萍萍,陈霞,等. 基于气质和液质联用技术的烟草鲜烟叶代谢组学分析流程[J]. 烟草科技,2019, 52(6): 59-71.
ZHENG Qingxia, LIU Pingping, CHEN Xia, et al. Metabolomic workflow and analysis of fresh tobacco leaves based on GC-MS and LC-MS[J]. Tobacco Science & Technology, 2019, 52(6): 59-71.
[4] 冯吉,余君,蔡长春. 代谢组学在烟草香味物质研究中的应用概况与展望[J]. 湖北农业科学,2012, 51(23): 5248-5252.
FENG Ji, YU Jun, CAI Changchun. Review and prospect of metabonomics in the research of tobacco aroma composition[J]. Hubei Agricultural Sciences, 2012, 51(23): 5248-5252.
[5] 孔宏伟,戴伟东,许国旺. 基于液相色谱-质谱联用的代谢组学研究中代谢物的结构鉴定进展[J]. 色谱,2014, 32(10): 1052-1057.
KONG Hongwei, DAI Weidong, XU Guowang. Advances of metabolite identification in liquid chromatography-mass spectrometry based metabolomics[J]. Chinese Journal of Chromatography, 2014, 32(10): 1052-1057.
[6] 郭凤丹,王兴军,侯蕾,等. 植物代谢组学研究进展[J]. 山东农业科学,2017, 49(12): 154-162.
GUO Fengdan, WANG Xingjun, HOU Lei, et al. Research progress of metabolomics in plants[J]. Shandong Agricultural Sciences, 2017, 49(12): 154-162.
[7] Li Y, Long L, Ge J, et al. Effect of imidacloprid uptake from contaminated soils on vegetable growth[J]. Journal of Agricultural and Food Chemistry, 2019, 67(26): 7232-7242.
[8] Li LL, Zhao JY, Zhao YN, et al. Comprehensive investigation of tobacco leaves during natural early senescence via multi-platform metabolomics analyses[J]. Scientific Reports, 2016(6): 37976.
[9] Zhang L, Zhang XT, Ji HW, et al. Metabolic profiling of tobacco leaves at different growth stages or different stalk positions by gas chromatography-mass spectrometry[J]. Industrial Crops & Products, 2018(116): 46-55.
[10] Zhao JY, Li LL, Zhao YN, et al. Metabolic changes in primary, secondary, and lipid metabolism in tobacco leaf in response to topping[J]. Analytical and Bioanalytical Chemistry, 2018, 410 (3): 839-851.
[11] Zhao YN, Zhao JY, Zhao CX, et al. A metabolomics study delineating geographical location-associated primary metabolic changes in the leaves of growing tobacco plants by GC-MS and CE-MS[J]. Scientific Reports, 2015(5): 16346.
[12] Tsugawa H, Cajka T, Kind T, et al. MS-DIAL: data-independent MS/MS deconvolution for comprehensive metabolome analysis[J]. Nature Methods, 2015, 12(6): 523.
[13] Chong J, Soufan O, Li C, et al. MetaboAnalyst 4.0: towards more transparent and integrative metabolomics analysis[J]. Nucleic Acids Research, 2018, 46(1): 486-494.
[14] 梁思威, 杨锦鹏, 余君, 等. 喷施外源植物生长调节物质对白肋烟烟碱含量及其合成关键酶活性的影响[J]. 华中农业大学学报, 2013, 32(5): 72-76.
LIANG Siwei, YANG Jinpeng, YU Jun, et al. Effects of spraying exogenous YCL2 and Z5 on nicotine content and two key enzymes regulating nicotine synthesis in burley tobacco[J]. Journal of Huazhong Agricultural University, 2013, 32(5): 72-76.
[15] 金云峰,李军营,张建波,等. 烟草烟碱代谢的生化和分子机制及其调控[J]. 基因组学与应用生物学,2015, 34(4): 882-891.
JIN Yunfeng, LI Junying, ZHANG Jianbo, et al. Biochemical and molecular mechanism of nicotine metabolism in tobacco plants[J]. Genomics and Applied Biology, 2015, 34(4): 882-891.
[16] Oliva M, Guy A, Galili G, et al. Enhanced production of aromatic amino acids in tobacco pants leads to increased phenylpropanoid metabolites and tolerance to stresses[J]. Frontiers in Plant Science, 2021, 11: 604349.
[17] Kumar V, Sharma A, Kaur R, et al. Differential distribution of amino acids in plants[J]. Amino Acids, 2017, 49(5): 821-869.
[18] 王威威,席飞虎,杨少峰,等. 烟草烟碱合成代谢调控研究进展[J]. 亚热带农业研究,2016, 12(1): 62-67.
WANG Weiwei, XI Feihu, YANG Shaofeng, et al. Progress on nicotine metabolism regulation in tobacco[J]. Subtropical Agriculture Research, 2016, 12(1): 62-67.
[19] Tzin V, Galili G. New insights into the shikimate and aromatic amino acids biosynthesis pathways in plants[J]. Molecular Plant, 3(6): 956-972.
[20] Fiehn O, Kopka J, Dormann P, et al. Metabolite profiling for plant functional genomics[J]. Nature Biotechnology, 2000, 18(11): 1157-1161.
[21] Hall R D. Plant metabolomics: from holistic hope, to hype, to hot topic[J]. New Phytologist, 2006, 169(3): 453-468.
[22] Koelmel J P, Kroeger N M, Ulmer C Z, et al. LipidMatch: an automated workflow for rule-based lipid identification using untargeted high-resolution tandem mass spectrometry data[J]. Bmc Bioinformatics, 2017(18): 331.
[23] Yamazaki M, Nakajima J, Yamanashi M, et al. Metabolomics and differential gene expression in anthocyanin chemo-varietal forms of[J]. Phytochemistry, 2003, 62(6): 987-995.
[24] Zhang Q F, Liu M Y, Ruan J Y. Metabolomics analysis reveals the metabolic and functional roles of flavonoids in light-sensitive tea leaves[J]. Bmc Plant Biology, 2017(17): 64.
[25] 赵利,钞建宾,郭捷,等. 基于代谢组学技术的植物抗病相关代谢物研究进展[J]. 西北植物学报,2021, 41(6):1071-1078.
ZHAO Li, CHAO Jianbin, GUO Jie, et al. Study on plant resistance related metabolites against pathogenic fungi based on metabolomics[J]. Acta Botanica Boreali-Occidentalia Sinica, 2021,41(6):1071-1078.
[26] Chen FF, Ma RJ, Chen XL. Advances of Metabolomics in Fungal Pathogen-Plant Interactions[J]. Metabolites 2019(9):169.
[27] 陈帅,杨爱国. 烟草重要基因篇14:烟草类黄酮合成相关基因[J]. 中国烟草科学,2016, 37(2): 95-98.
CHEN Shuai, YANG Aiguo. Tobacco flavonoid biosynthesis and related genes[J]. Chinese Tobacco Science, 2016, 37(2): 95-98.
Differential analysis of metabolic profiles of Honghua Dajinyuan tobacco leaves in different growth stage based on untargeted metabolomics
XIANG Haiying1, LIU Xin1, PANG Tao2, ZENG Wanli1, XU Li1, GAO Qian1, DENG Lele1, ZHANG Jianduo1, LI Xuemei1, LI Yong3, KONG Weisong1*
1 Yunnan Key Laboratory of Tobacco Chemistry, R&D Center of China Tobacco Yunnan Industrial Co., Ltd., Kunming, 650231, China;2 Yunnan Acedemy of Tobacco Agriculture Science, Kunming 650051, China;3 Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
The difference of metabolic profiling of tobacco leaves in different growth stages was investigated using untargeted metabolomics.Tobacco leaves in cluster, budding and maturation stages were collected and analyzed by LC-QTOF/MS. Statistic analysis was conducted to test the significance of difference in the metabolites among different groups of tobacco leaves. Pathway analysis was performed on the MetaboAnalyst web-based software. The associations among metabolites were defined by Spearman correlation analysis.(1) There were significant differences in the metabolic profiles of tobacco samples in various growth stages. A total of 245 differential metabolites were identified, among which flavonoids, organic acids, amino acids, nucleosides, alkaloids and lipids were the dominant types. (2) Nicotine and its derivatives, such as 2,3'- bipyridine, nornicotine, myosmine, anababine, nornicotine and anatabine and nicotine-1-oxo were gradually accumulated with maturation process; However, some synthesis precursor substances of nicotine such as arginine, and spermine, putrescine, 3-hydroxybutyric acid, exhibited the opposite trends. (3) The contents of amino acids and organic acids related to the synthesis of secondary metabolites were higher in cluster stage or budding stage than in the mature stage. (4) Most flavonoids and phenolic acids were higher in maturation stages, which could effectively improve resistance of tobacco plants to diseases and external stress. (5) Correlation analysis showed that the levels of glutamic acid, pantothenic acid, pyridoxal, meliciose, 3-hydroxyo-aminobenzoic acid and zeaxin-o-glucoside were significantly positively correlated with nicotine content, suggesting that these metabolites might be important markers for regulating nicotine synthesis in tobacco leaves.This study reveals the change of tobacco metabolites in various growth stages, which provides technical support for tobacco breeding and quality analysis.
tobacco; metabolomics; growth stages; nicotine; differential metabolites
Corresponding author. Email:529029676@qq.com
中国烟草总公司科技重大专项“烟草物质代谢相关核心基因的编辑文库构建及素材创制”(No.110202001028(JY-11));云南中烟工业有限责任公司科技项目“两个烟草生物碱关联编辑素材的精细化筛选研究”(No.2020JC03);云南省烟草化学重点实验室开放课题“烟草高通量靶向代谢组学方法开发及在育种素材中的应用”(No.2021539200340239)
向海英(1983—),博士,副研究员,主要研究方向:烟草生物技术,Email:casexhy@126.com,Tel:0871-68319513
孔维松(1975—),Tel:0871-68319513,Email:529029676@qq.com
2021-11-22;
2022-04-01
向海英,刘欣,逄涛,等. 基于非靶向代谢组学的红花大金元不同生育期烟叶代谢图谱差异分析[J].中国烟草学报,2022,28(4). XIANG Haiying, LIU Xin, PANG Tao, et al. Differential analysis of metabolic profiles of Honghua Dajinyuan tobacco leaves in different growth stage based on untargeted metabolomics [J]. Acta Tabacaria Sinica, 2022, 28(4). doi:10.16472/j.chinatobacco.2021.236

