龙血素B碳桥结构修饰对其选择性调节离子通道蛋白功能的影响
尹世金,张旭,赵倩茹,骆滨,王强,戴康
(中南民族大学 药学院,武汉430074)
传统名贵中药龙血竭具有活血化瘀、治疗氧化应激损伤、抗炎和抗肿瘤等功效[1-2].龙血素B(loureirin B,LrB,图1)是龙血竭中极具代表性的活性分子,近年来有龙血素B 调控不同疾病的相关报道.2004年刘向明等初次揭示龙血竭对河豚毒素敏感型(tetrodotoxin-sensitive)钠离子通道电流的影响主要是由其成分龙血素B 所产生的[3],奠定了龙血素B 镇痛作用的基础,也为后续研究者探索龙血素B 的作用机制提供了借鉴意义.2007 年刘向明等又发现龙血素B可以明显抑制辣椒素诱发的辣椒素受体电流,影响痛觉信息的传入[4],2013年该团队补充龙血竭及其成分龙血素B可浓度依赖性地降低辣椒素诱导的TRPV1 受体电流的峰值幅度[5],使龙血竭的镇痛作用通过动物模型得到证实,同时揭示了龙血素B 可抑制TRPV1 受体电流发挥镇痛作用.2014年尹世金等发现龙血素B 可通过阻断Kv1.3 通道,抑制植物血凝素(PHA)诱导活化的Jurkat T 细胞释放IL-2,从而介导免疫抑制作用[6],为基于龙血素B开发自身免疫性疾病药物提供了思路.2021年石书娟等报道了龙血素B 还可通过抑制STIM1/Orai1 通道发挥其免疫抑制作用[7].2018 年发现龙血素B 通过抑制KATP通道和细胞内钙的流入促进胰岛素分泌[8],2021年发现龙血素B可激活胰高血糖素样肽-1 受体(GLP-1R)并促进大鼠胰岛细胞瘤细胞(Ins-1)分泌胰岛素[9],这两项研究揭示了龙血素B 的降血糖作用.2018 年陈素等补充了龙血素B 可通过激活腺苷酸环化酶(AC)和蛋白激酶A(PKA)的AC/cAMP/PKA 途径调节DRG 神经元中的TTX-R 钠通道[10],这一结论也可用来解释龙血素B 的其他药理作用.龙血素B 可通过调节miR-148-3p 的表达促进大鼠肝星状细胞(HSCs)的凋亡并抑制Wnt/βcatenin 信号通路发挥抗肝纤维化作用[11],通过抑制Pin1/TGF-β1 信号传导来减轻心脏纤维化[12].综上所述,龙血素B具有多种生物药理学活性,但对各种通道或受体作用的特异性较差,临床用药易产生副作用,这些在临床上可能存在的副作用成为了亟待解决的问题.天然药物活性成分的发掘和改造一直是药物化学研究中的重点,许多天然药物成分的物理化学性质、毒副作用等限制了其在临床上的应用[13],这使得药物分子结构修饰成为新药研发的一个重要途径[14-15].本研究拟通过合理的结构修饰来提高龙血素B 在离子通道上的选择性,为天然产物龙血素B的成药性提供基础.
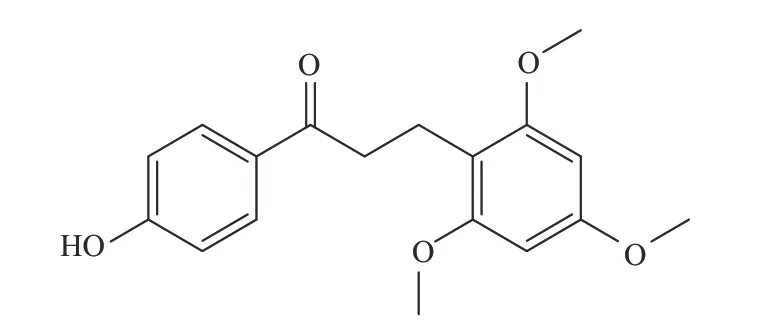
图1 龙血素B化学结构Fig.1 The chemical structure of loureirin B
1 材料和方法
1.1 仪器与材料
三用紫外分析仪(ZF-1A 型,上海勤科);600 MHz 核磁共振波谱仪(TMS 内标,Bruker 公司);液相高分辨质谱联用仪(UPLC-Q Exactive 型,Thermo公司).
2,4,6 -三甲氧基-4′-苄氧基查尔酮(自制);三溴化硼(Aldrich);对乙酰氧基苯甲酸(Aldrich);1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)、1-羟基苯并三唑(HOBT)、2,4,6-三甲氧基苄胺(乐研试剂);薄层色谱硅胶、薄层色谱板(青岛海洋化工厂);石油醚、二氯甲烷、乙酸乙酯、四氢呋喃、浓盐酸、碳酸钠(国药集团).
1.2 两种碳桥修饰产物的合成及结构鉴定
1.2.1 OB(具有α,β -不饱和双键的龙血素B 衍生物)的合成
合成路线如图2所示,50 mL的三口烧瓶装上搅拌器并放入冰水浴中,向反应容器中加入20 mL 二氯甲烷,1.56 g(0.002 mol)2,4,6-三甲氧基-4′-苄氧基查尔酮,搅拌的同时慢慢加入2 mL 三溴化硼溶液,避光反应0.5 h后,得到红色溶液及沉淀.将反应液倾入50 mL 冰水中,用饱和碳酸氢钠调pH 至中性,抽滤后滤液用二氯甲烷进行萃取,提取二氯甲烷层并干燥得到粗产物,用柱色谱法分离得到棕黄色粉末状固体即OB.

图2 OB的合成路线Fig.2 Synthetic route of loureirin B with OB
1.2.2 AB(具有酰胺键的龙血素B衍生物)的合成合成步骤分两步进行(图3).
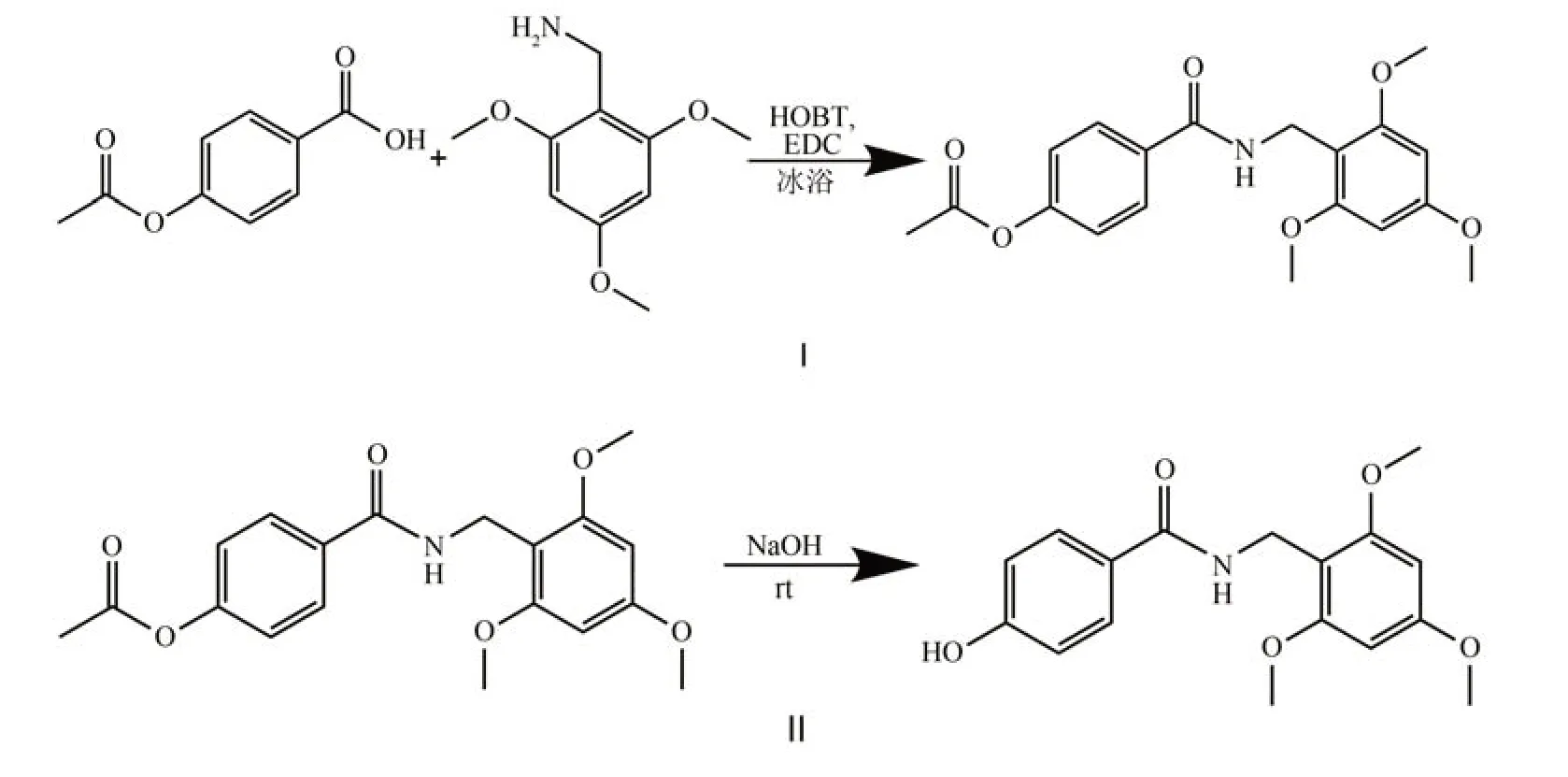
图3 AB的合成路线Fig.3 Synthetic route of AB
(Ⅰ)50 mL 的三口烧瓶装上搅拌器并放入冰水浴中,依次加入25 mL 二氯甲烷、2.2 g(0.012 mol)对乙酰氧基苯甲酸、2.3 g(0.015 mol)1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)和1.6 g(0.012 mol)1-羟基苯并三唑(HOBT),装上干燥管搅拌2 h 后,加入1.6 g(0.008 mol)2,4,6-三甲氧基苄胺继续搅拌过夜.反应完毕后依次用饱和碳酸钠溶液(15 mL×3)、稀盐酸(15 mL×3)洗涤,减压浓缩得到粗产物,用柱色谱法分离得到白色粉末状固体即4-乙酰氧基-N-(2,4,6-三甲氧基苄基)苯甲酰胺.
(Ⅱ)25 mL 的圆底烧瓶放入搅拌子,依次加入10 mL 四氢呋喃水溶液(四氢呋喃∶水= 4∶1)、2.8 g(0.008 mol)4-乙酰氧基-N-(2,4,6-三甲氧基苄基)苯甲酰胺和0.4 g 氢氧化钠,室温磁力搅拌1 h,反应完毕后用稀盐酸调pH 至中性,减压浓缩去除四氢呋喃,用乙酸乙酯进行萃取,提取乙酸乙酯层减压浓缩,得到白色结晶状固体即AB.
1.2.3 两种改造产物的结构鉴定
“嗯,皮特手下的女爪牙。”克里斯蒂娜冲着站在房间另一头的人群意味深长地点点头。莫莉和克里斯蒂娜一样高,但她们的相似点也仅限于此。莫莉肩膀很宽,有铜色的皮肤,还有一个蒜头鼻。
分别取5 mg OB 和AB 溶于氘代DMSO 中,通过核磁共振氢谱(1H NMR)、碳谱(13C NMR)进行结构表征.另以乙腈作为溶剂配制10 μg/mL 浓度用于质谱(MS)测定.
1.3 龙血素B 及其改造产物对钾、钠离子通道的作用测定
1.3.1 记录液及实验用药
实验用药:LrB、OB、AB 均为自主合成.实验用LrB 和OB 以细胞培养级DMSO 溶解并配制成30 mmol/L的母液,AB以细胞培养级DMSO溶解并配制成30 mmol/L、300 mmol/L 两种母液.用于膜片钳实验的浓度以配制好的细胞外液稀释而成.
DMSO(细胞培养级二甲亚砜,AppliChem Panreac),D-PBS 缓冲液、Opti-MEM 培养基、DMEM高糖培养基、胰蛋白酶溶液(gibco),FBS(胎牛血清,翌圣科技),青霉素-链霉素溶液(HyClone),HighGene转染试剂(ABclonal),Lipofectamine2000 转染试剂(Vazyme),插入mKv1.3 通道编码基因的pIRES2-EGFP 质粒、pIRES2-EGFP 质粒(武汉大学李文鑫教授实验室提供),pcDNA3-Nav1.7 质粒(OriGene),0.125%多聚赖氨酸溶液(0.125%Poly-cysteine)、半胱氨酸(Biosharp),HBSS溶液(Sangon Biotech),分散酶(Roche),木瓜蛋白酶(Worthington Biochemical),胶原蛋 白 酶(Sigma-Aldrich).NaCl、KCl、MgCl2·6H2O、CaCl2·2H2O、D-Glucose、EGTA、HEPES、KOH、NaOH、CsF、CsCl、NaHCO3、三磷酸腺苷二钠(以上试剂均购自Sigma-Aldrich).
用于记录Kv1.3 通道电流细胞外液(mmol/L)含KCl 5,NaCl 140,CaCl2·2H2O 2,MgCl2·6H2O 1,HEPES 10,D-glucose 10,用NaOH 溶液将体系pH 值调至7.4.用于记录Kv1.3通道电流电极内液(mmol/L)含KCl 140,HEPES 10,MgCl2·6H2O 1,EGTA 1,Na2ATP 3,用KOH 溶液将体系pH 值调至7.2.用于记录钠通道电流细胞外液(mmol/L)含KCl 2.5,NaCl 145,CaCl2·2H2O 1.5,MgCl2·6H2O 1.2,HEPES10,D-glucose 10,用NaOH 溶液将体系pH 值调至7.4.用于记录钠通道电流电极内液(mmol/L)含CsCl 145,HEPES 10,MgCl2·6H2O 4,EGTA 10,Dglucose 10,Na2ATP 2,用CsOH 溶液将体系pH 值调至7.2.
1.3.2 细胞培养及转染
将HEK293-T 细胞(武汉大学典藏中心)经胰蛋白酶消化分散后接种到24孔板中,用含10%的胎牛血清和1%青霉素-链霉素溶液的DMEM 培养基在5%CO2、37 ℃的培养箱中培养.用Opti-MEM 分别稀释已插入mKv1.3通道编码基因的pIRES2-EGFP质粒和HighGene转染试剂(Nav1.7通道方法:用Opti-MEM分别稀释pcDNA3-Nav1.7 通道编码基因及pIRES2-EGFP 质粒和Lipofectamine2000 转染试剂),将二者于5 min 后混匀,静置18 min 后将混合物加入预先培养的HEK293-T 细胞中转染,钾通道转染12 h 后将细胞消化均匀接种到盖玻片上进行电生理实验;钠通道转染24 h 后使用完全培养基进行置换,48 h后可进行电生理实验.
1.3.3 DRG的分离与培养
于六孔板中铺上适量的盖玻片,经100 μL/片多聚赖氨酸(0.125% Poly-cysteine)包被45 min.脱颈椎法处死昆明种小鼠(SPF 级,购于湖北省疾控中心),将脊柱迅速剪下放入HBSS 中.洗掉血渍,将脊柱沿着背部对剖成两半,浸泡在预冷的HBSS 中3 min.在体视镜下取出神经节,剪掉神经纤维,只留下神经元部分.放入已配制好的消化酶Ⅰ中,37 ℃消化10 min,期间每隔0.5 min 上下颠倒混匀几次,室温2400 r/min 离心1 min.弃上清,加入消化酶Ⅱ,37 ℃消化10 min,期间每隔0.5 min 上下颠倒混匀几次,室温2400 r/min 离心1 min.弃上清,向离心管中加入1 mL 高糖DMEM 完全培养基来终止酶消化反应,4000 r/min 离心细胞1 min.弃上清,加入适量高糖DMEM 完全培养基重悬细胞,每片80 μL 体系接种在盖玻片上,放入37 ℃5% CO2培养箱中培养2 h 待细胞贴壁后,补充2 mL 高糖DMEM 完全培养基到培养孔中,12 h后进行膜片钳实验.
1.3.4 膜片钳实验
全细胞电压钳用AXOPATCH 200B 放大器进行实验记录,实验温度20~25 ℃,ExClamp 软件完成实验参数设置、数据采集与细胞刺激模式.微电极玻璃毛细管经程控玻璃电极拉制仪拉制,玻璃微电极抛光仪抛光,灌注电极内液后稍加正压,入液电阻控制在2~5 MΩ.用电动微操纵器(SMX 型,SENSAPEX 公司)将电极慢慢靠近目标细胞进行钳制,待细胞形成高电阻封接到GΩ 后,进行快电容补偿,稍加负压使其细胞膜破裂,再进行慢电容补偿和串联电阻补偿.钾通道在全细胞膜片钳模式下将细胞膜电位钳制在-60 mV,每10 s 给予400 ms 步长、+50 mV 的去极化电流刺激以激活HEK293T 细胞膜上的Kv1.3 通道电流(钠通道在全细胞膜片钳模式下将细胞膜电位钳制在-80 mV,从-60 mV起施加10 mV步幅递增、100 ms步宽的去极化方波刺激至+60 mV,确定能够激发DRG 和HEK-293T 细胞最大钠电流的激活电压,再固定该刺激电压值以50 ms步长、间隔时间5 s进行连续去极化方波刺激).待电流稳定后,将给药头靠近细胞开始给药,同时记录细胞膜上通道电流变化情况.
1.3.5 数据处理与分析
所有的实验数据都用均数±样本标准误(mean±SEM)表示,其中n表示独立实验次数.不同实验组之间差异采用one-way ANOVA(单因素方差分析)检验或t-检验统计分析,用P≤0.05 作为数据差异性显著的标准.放大器Patch Clamp采集到的电流数据用Origin8 软件分析及作图,软件Igor Pro 4 对数据进行量效曲线拟合.小分子化合物对电压门控性离子通道电流的抑制程度,用Hill 方程进行拟合得到化合物的半数有效抑制浓度即IC50值.
2 结果
2.1 两种碳桥修饰产物的结构及表征
OB 的名称为E-1-(4-羟基苯基)-3-(2,4,6-三甲氧基苯基)丙-2-烯-1-酮,棕黄色粉末状固体,产量0.31 g,产率49.36%,分子式C18H18O5.
1H NMR(500 MHz,DMSO-d6)δ 10.31(s,1H),8.03(d,J= 15.7 Hz,1H),7.91-7.87(m,2H),7.86(d,J= 15.7 Hz,1H),6.92-6.85(m,2H),6.32(s,2H),3.92(s,6H),3.86(s,3H);烯键氢耦合常数:Jab=15.7(Hz),故双键为反式结构.13C NMR(126 MHz,DMSO-d6)δ 188.16,163.06,161.67,161.28,134.02,130.56,129.89,120.42,115.40,105.22,91.05,56.12,55.59;HRMS(ESI)Calcd for C18H19O5[M+H]+:315.3450,Found:315.1225.
AB 的名称为4-羟基-N-(2,4,6-三甲氧基苄基)苯甲酰胺,白色结晶状固体,产量2.02 g,产率81.70%,分子式为C17H19NO5.
1H NMR (600 MHz,DMSO-d6) δ 9.88(s,1H),7.72-7.66(m,3H),6.76-6.70(m,2H),6.24(s,2H),4.32(d,J= 4.4 Hz,2H),3.77(d,J=11.7 Hz,9H);13C NMR(151 MHz,DMSO-d6)δ 166.06,160.99,160.23,159.71,129.67,125.79,114.99,106.28,91.17,56.19,55.72,32.88;HRMS(ESI) Calcd for C17H20NO5[M+H]+:318.34100,Found:318.1338.
2.2 龙血素B 及两种新衍生物对HEK-293T 细胞上外源性Kv1.3通道电流的影响
电压门控钾通道1.3型(Kv1.3)是一个公认的功能性标志,也是具有吸引力的治疗自身免疫性疾病的药理学靶点[16].本课题组前期实验证明了龙血素B 对Kv1.3 通道具有较强的药理学活性[6](图4(a)).本实验结果表明,30 μmol/L OB 能有效地抑制外源性表达在HEK-293T 细胞上的Kv1.3通道电流,这种抑制效应能部分洗脱(图4(c)),证明其具有可被机体有效代谢的性质且排除细胞状态问题导致的电流变化;30 μmol/L AB 对Kv1.3 通道电流几乎没有影响.对实验数据进行统计分析,结果显示这3种化合物对Kv1.3 通道电流的抑制作用呈浓度依赖性.通过Igor Pro 4 中的Hill 方程拟合其对Kv1.3 电流的剂量依赖曲线[图4(b)(d)(e)],得到LrB、OB 和AB抑制Kv1.3 电流的IC50值分别为(5.18±0.91)μmol/L、(7.89±1.78)μmol/L 和(3.58±1.14)mmol/L(表1).结果表明,和LrB相比,合成的OB衍生物阻断Kv1.3通道的效应得到了保持,AB 阻断Kv1.3通道的效应几乎丧失.

图4 龙血素B及其衍生物对Kv1.3钾通道电流的影响及剂量依赖曲线(n=5)Fig.4 Effects and dose-dependent curves of loureirin B and its derivatives on Kv1.3 potassium channel currents(n=5)

表1 龙血素B及其衍生物对Kv1.3通道电流的半数有效抑制浓度(n=5)Tab.1 50%effective inhibitory concentration of loracerin B and its derivatives on Kv1.3 channel current(n=5)
2.3 龙血素B 及两种新衍生物对DRG 细胞膜上TTX-S型钠离子通道电流的影响
DRG 细胞能感知和调控痛觉信息并将信号传入痛觉中枢脊髓[17],细胞膜上表达的多种类型电压门控钠通道在疼痛感知和信号传导中扮演着重要角色[18].鉴于初级感觉神经元细胞膜上的TTX-S型钠通道在疼痛发生机制中的重要作用[19],研究选择了直径大于30 μm 的DRG 细胞,着重测定了3 种化合物对这一类型钠通道的作用.实验结果表明,30 μmol/L LrB 完 全 抑 制 了DRG 细 胞 膜 上 的TTX-S 型钠电流(图5(e)),100 μmol/L AB 可明显抑制DRG 细胞膜上的TTX-S 型钠电流(图5(c)),且给药后可使DRG 细胞钠通道电流激活曲线向去极化方向移动(图5(d)),使钠通道的半数激活电压值升高,不易被激活从而发挥镇痛作用.50 μmol/L OB(化合物溶解度受限,最大溶解浓度50 μmol/L)对DRG 细胞膜上的TTX-S 钠电流和电流激活曲线均影响较小[图5(a)(b)].
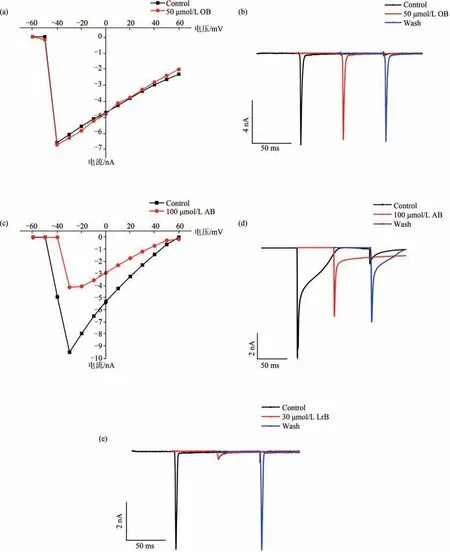
图5 龙血素B及其衍生物对DRG细胞膜上TTX-S型钠通道的IV曲线和最大激活电流的影响Fig.5 Effects of loureirin B and its derivatives on the IV curve and maximum activation current of TTX-S-Type sodium channels on DRG cell membrane
2.4 龙血素B新衍生物对HEK-293T细胞上外源性Nav1.7通道电流的影响
TTX-S型钠通道Nav1.7几乎特异性地表达在哺乳动物初级感觉神经元上[20],与其他类型TTX-S 钠通道不同的是,表达有Nav1.7 的初级感觉神经元对外来刺激更具敏感性[21],使得Nav1.7 成为感觉神经元兴奋的第一级联效应感受器[22],Nav1.7 因此成为研发新型镇痛药物的重要靶点[23].为排除哺乳动物DRG 细胞膜上其他类型钠通道对这两种改造产物药理效应的干扰,本研究单独将Nav1.7 通道编码基因和EGFP质粒共转染,外源性表达在HEK-293T细胞膜上,通过电生理实验证实这两种衍生物的药理活性.结果表明50 μmol/L AB 可有效抑制外源性的Nav1.7 电流(图6(a)),活性优于OB(图6(c)),且抑制作用呈现浓度依赖性,通过Igor Pro 4 中的Hill方程拟合AB 对Nav1.7 电流的剂量依赖曲线(图6(b)),得到其抑制Nav1.7 电流的IC50值为59.81±2.93 μmol/L.AB 既能阻断DRG 细胞膜上TTX-S 钠通道,也能高效阻断外源性表达的Nav1.7 通道.上述研究结果提示对龙血素B 进行结构修饰,可在增加选择性的同时保留阻断Kv1.3 或Nav1.7 通道的药理学活性,结构改造的龙血素B 衍生物可以作为优良离子通道调节剂用于后续的实验研究.
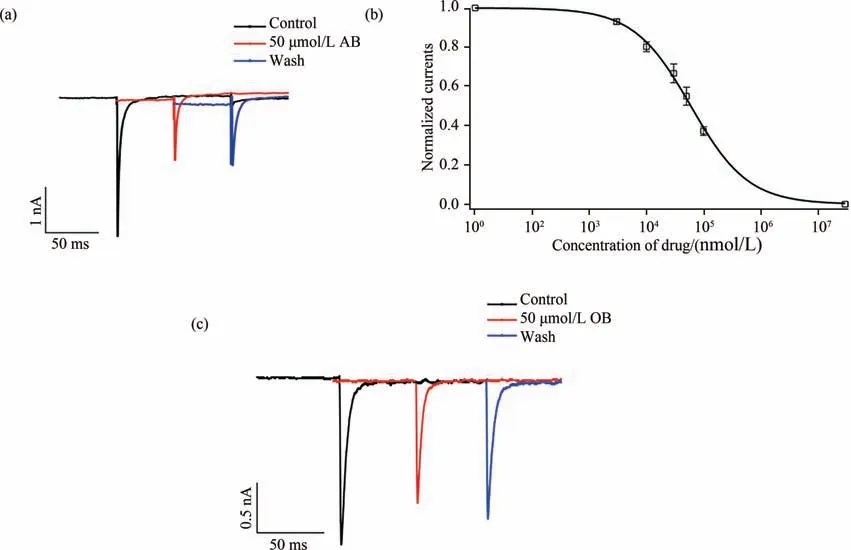
图6 OB和AB对HEK-293T细胞上外源性Nav1.7通道电流的影响Fig.6 Effects of OB and AB on exogenous Nav1.7 channel currents in HEK-293T cells
3 结语
二氢查尔酮类化合物龙血素B(LrB)能够阻断哺乳动物初级感觉神经元上河豚毒素敏感型(TTX-S)钠离子通道,从而产生良好的镇痛效应[3],并进一步发现LrB 能够阻断哺乳动物外源性和内源性Kv1.3 通道[6],可以推断出其对离子通道的选择性较差,限制了在临床上的使用.本文以2,4,6-三甲氧基-4′-苄氧基查尔酮和2,4,6-三甲氧基苄胺为原料,将LrB 碳桥上两个可旋转单键的丙酰键成功改造为具有α,β -不饱和双键、碳桥不可旋转的LrB 衍生物(OB)和碳桥具有一个可旋转丙酰胺键的LrB 衍生物(AB).并以LrB 为对照药,应用膜片钳技术初步测定了AB、OB 在HEK-293T 和DRG 细胞上的钾、钠离子通道功能,揭示碳桥的刚性/柔性结构是否会对龙血素B 的选择性产生影响.结果表明,OB 保留了对于Kv1.3 通道的阻断活性,与LrB 阻断Kv1.3通道的药理学活性相当,减弱了对DRG 和Nav1.7 通道的活性;AB 则相反,它对于Kv1.3 通道的阻断活性几乎丧失,却保留了对于DRG 和Nav1.7 通道的阻断活性.两种龙血素B 衍生物对离子通道的作用均具有一定的选择性,具有较高的参考价值和研究意义.此次改造也可看出,具有酰胺键的半刚性结构和具有α,β -不饱和双键的完全刚性结构对钾、钠离子通道的作用存在很大的差异,可以推断碳桥的刚性/柔性结构对LrB 的选择性确实存在着不可忽视的影响.除此之外,这些活性变化还可能与氨基和碳碳双键的电负性、极性和形成氢键的能力相关,需要后续一些工作来进行补充.本文探究的碳桥结构修饰产生的离子通道药理学方面的性质变化,为后期龙血素B 衍生物的研究及应用提供了借鉴意义.

