乙烯利对苦瓜幼苗内源激素代谢及相关调控基因表达的影响
焦 阳,马 英,张 振,吴汉东,李跃飞
(锦州医科大学 食品与健康学院,辽宁锦州 121000)
植物生长调节剂是一类与植物激素类似的化学物质,在植物生长、发育等多个生理过程中表现显著的调控作用,具有安全、作用面广、用量少、见效快等特点,是近代生理学和农业科学上的一项重大研究进展。以吲哚丁酸和萘乙酸为标志,天然、人工合成的植物生长调节物质已经陆续应用到农业生产中[1]。乙烯利是20世纪90年代人工合成的一种化学物质,其主要成分为2-氯乙基磷酸,通过对植株进行喷施等处理,能够释放出气态乙烯发挥功能。外源乙烯(ethylene)在植物生长发育期间,如果实成熟、叶片脱落、植株矮化生长、花芽分化等过程均可产生显著的调节作用[2]。同时,乙烯作为一种信号因子可以诱发植物内源激素代谢过程发生变化[2],如孙亮等[3]对百合鳞茎组织进行外源乙烯的处理,发现对其组织内的脱落酸(ABA)、赤霉素(GA)、生长素(IAA)的含量均产生了显著影响。这种现象在施用外源ABA、GA对葡萄和刺五加的处理过程中同样得到了证实,表明内源激素的合成与外源调节物质之间存在着明显的互作效应[4-5]。
外源生长调节物质作用于植物后,会引发基因表达水平的改变,进而影响相关内源激素的代谢过程。乙烯生物合成途径中两个重要的限速酶1-氨基环丙基-1-羧酸(ACC)合成酶(ACS)、氧化酶(ACO)的表达水平与乙烯产量间密切相关,在对西瓜[6]、中国南瓜[7]、番茄[8]、树莓[9]、菠萝[10]等作物进行外源乙烯利处理后,两种酶的表达丰度均出现了显著提高,大大提升了乙烯的产率,表明乙烯利可以有效刺激作物内源乙烯的合成。同时,有研究表明,外源乙烯利对厚皮甜瓜幼苗叶片中IAA和GA的合成具有抑制作用,对ABA的合成具有促进作用[11];乙烯利对转基因油菜角果和种子发育阶段的内源激素GA和IAA的生成均具有抑制作用,推测乙烯与内源植物激素相互作用,调节油菜籽角果和种子的发育和生长[12];西瓜幼苗在喷施乙烯利后,体内IAA、ABA、GA的含量均低于对照[13];黄瓜幼苗经乙烯利处理后,茎尖组织中的IAA、ZT含量上升,而GA3则表现为降低,有利于雌性花芽的分化[14]。
苦瓜为葫芦科作物,外源乙烯可以调控苦瓜幼苗的生长发育以及花芽分化[15]。当前的相关报道更多侧重于对植株农艺性状以及内源激素含量的分析,虽鉴定了个别调控基因,但从整体分子调控网络的角度,阐述乙烯利对内源激素代谢过程的研究仍较为缺乏。因此,本研究对苦瓜幼苗进行乙烯利处理,在分析内源激素含量的基础上,结合高通量测序(High-throughput sequencing)技术,从基因转录水平挖掘相关信息,获得苦瓜应对外源乙烯诱导的内源激素代谢靶点,初步明确相关调控基因的作用特点,进而为生产上调控瓜类作物的生长发育奠定理论基础。
1 材料和方法
1.1 试验材料
本试验以苦瓜常规品种“绿爵士”为试材,在辽宁省农业科学院(41.7898°N,123.4206°E)日光温室内播种,常规管理后出苗。在幼苗3~4叶期挑选生长势一致的植株,将其分为对照组(CK)与处理组(ET)两部分,分别对叶片喷施蒸馏水和160 μL/L 的40% (v/v)乙烯利溶液,共喷施2次,2次间隔3 d。在末次处理后的第48小时采样用于转录组测序分析(图1),末次处理后第7天采样用于植物激素含量的测定。每一处理的样品随机选取10株幼苗,采集嫩叶和茎尖组织进行混合,经液氮速冻后置于-80 ℃超低温冰箱冻存备用,实验共设置3次生物学重复。
1.2 测定指标及方法
1.2.1 1-氨基环丙基-1-羧酸(ACC)含量的测定称量约0.2 g植物样品,于液氮中研磨后转移至50 mL离心管中,加入5 mL去离子水,在超声清洗仪中水浴30 min。然后于4 ℃下离心(10 000 r·min-1)5 min后取上清液,将上清液pH调至4.0。加入20 mL氯仿振荡混匀,4 ℃下离心(10 000 r·min-1)5 min,取上清液过MCX小柱,并以2 mL甲醇,1 mL去离子水,5 mL氨水(1 mol·L-1)淋洗柱子。过0.22 μm滤膜,用于高效液相色谱串联质谱(HPLC-MS/MS)检测。HPLC分析条件:色谱柱(100 mm×2.1 mm×1.7 μm),A相流动相为水/甲醇(98/2,V/V)(添加0.05%甲酸和5 mmol·L-1乙酸铵),B相流动相为乙腈,流速为0.3 mL·min-1。MS/MS条件:气帘气15 psi,雾化温度400 ℃,喷雾电压4 500 V,雾化器压力65 psi。
1.2.2 ACS活性测定称量约2.0 g植物样品,于液氮中研磨后转移至预冷的15 mL离心管中,加入3 mL的Tricine提取液震荡。4 ℃下离心(10 000 r·min-1)3 min,取2.4 mL上清液加入到预冷的15 mL离心管中。过GE Sephadex去盐柱去除样品中原始ACC,以3 mL的Tricine柱洗液洗脱柱子,收集粗酶液。取1.5 mL粗酶液加入150 μL反应buffer及150 μL的SAM溶液作为反应底物,25 ℃下温浴2 h,加入200 μL的HgCl2溶液终止反应。过0.22 μm滤膜,用于高效液相色谱串联质谱(HPLC-MS/MS)检测,以新生成的ACC来计算ACS的活性。HPLC分析条件:色谱柱(100 mm×2.1 mm×1.7 μm),A相流动相为水/甲醇(98/2,V/V)(添加0.05%甲酸和5 mmol·L-1乙酸铵),B相流动相为乙腈,流速为0.3 mL·min-1。MS/MS条件:气帘气15 psi,雾化温度400 ℃,喷雾电压4 500 V,雾化器压力65 psi。
1.2.3 内源激素IAA、GA3、tZR含量的测定准确约1.0 g植物样品,于液氮中研磨后加入10 mL异丙醇/盐酸提取缓冲液,4 ℃震荡30 min,再加入20 mL二氯甲烷震荡30 min。于4 ℃下离心(13 000 r·min-1)5 min后取下层有机相。避光下氮气吹干有机相,以400 μL甲醇(添加0.1%甲酸)溶解。过0.22 μm滤膜,用于高效液相色谱串联质谱(HPLC-MS/MS)检测。HPLC分析条件:色谱柱(150 mm×2.1 mm×2.7 μm),A相流动相为甲醇(添加0.1%甲酸),B相流动相为水(添加0.1%甲酸),梯度洗脱流速为0~1 min时20%A,1~9 min时80%A,10~10.1 min时20%A,10.1~15 min时20%A。MS/MS条件:气帘气15 psi,雾化温度400 ℃,喷雾电压4 500 V,雾化器压力65 psi。
1.2.4 转录组高通量测序使用Trizol法提取6个试验样本的总RNA,使用Bioanalyzer 2100和RNA 1000 Nano LabChip Kit分析总RNA的产量和纯度,获得质量合格的样本用于文库的构建。使用Oligo(dT)寡聚磁珠富集纯化RNA,将其片段化后反转录为cDNA,创建最终的cDNA文库,在Illumina Hiseq-4000高通量测序平台上机检测。
1.2.5 生物信息学分析对原始转录本(raw reads)去除接头序列以及低质量碱基信息,获得有效转录本(clean reads)。采用从头组装的方式,使用Trinity 2.4.0进行转录本的整合[16]。将组装后的Unigenes通过DIAMOND比对到Non-redundant(Nr)、Gene Ontology (GO)、Swiss-Prot、Kyoto Encyclopedia of Genes and Genomes (KEGG)以及eggNOG数据库[17]。通过TPM值计算Unigenes的表达量,以“FDR < 0.05”和“log2FC ≥ 1”为阈值,筛选两个文库间的差异表达基因(DEGs)。利用GOseq和KOBAS对差异表达基因进行GO和KEGG通路富集分析。
1.2.6 差异表达基因的qRT-PCR分析参考转录组中的TPM值,选择8个差异表达基因,利用Primer Premier6.0软件设计引物,进行荧光定量PCR分析(表1)。提取样本总RNA,检验RNA产量及纯度,对质量合格的RNA进行反转录。根据第1链合成试剂盒(TaKaRa,日本)中的反应体系和条件合成cDNA,以β-Actin基因作为内参基因,在Bio-Rad IQ5 Real Time PCR系统(Bio-Rad,美国)上进行实时定量检测,采用20 μL反应体系,按2-ΔΔCt算法计算各差异基因的相对表达量[18]。

表1 qRT-PCR分析引物序列Table 1 Primers used for qRT-PCR analysis
2 结果与分析
2.1 外源乙烯利对苦瓜幼苗内源激素含量和ACS活性的影响
苦瓜幼苗经过叶面喷施乙烯利后,内源激素的代谢受到影响,内源激素含量发生了显著的变化(表2)。其中,与对照(CK)相比,外源乙烯利处理苦瓜幼苗嫩叶和茎尖的1-氨基环丙基-1-羧酸(ACC)含量与ACS的活性均表现为显著上升的趋势,分别提升了23.2%和19.7%。由于ACS是ACC生物合成的限速酶,而且ACC是乙烯生物合成的直接前体,所以二者含量的升高有利于内源乙烯的合成。同时,外源乙烯利处理苦瓜幼苗的两种植物激素IAA和tZR含量也比相应对照显著上升,分别提高了57.5%和42.0%。与之相反,处理组幼苗GA3的含量却比对照出现了显著的下降,降幅达到了88.7%。上述结果表明,外源乙烯利处理能够显著诱发苦瓜幼苗激素水平的变化,同时诱导乙烯合成前体物质ACC含量和ACC生物合成限速酶ACS活性的显著提高,从而促进内源乙烯的合成。

表2 外源乙烯利处理下苦瓜幼苗内源激素含量和ACS活性的变化Table 2 Endogenous hormonal contents and ACS activity of the bitter melon seedlings under exogenous ethephon treatment(ET)
2.2 外源乙烯利处理苦瓜幼苗转录组测序分析
通过对6个cDNA文库进行转录组测序分析,共产生原始数据49.66 Gb。其中clean reads数目介于53 195 286~55 924 028之间,测序Q30值大于95%,GC含量大于45%,表明测序质量良好(表3)。对转录本进行组装后,最终鉴定到了46 026个基因,平均长度494 bp。经过与各数据库进行比对分析,在Nr、Pfam、Swiss-Prot、eggNOG、GO和KEGG数据库中分别有59.37%、45.74%、41.88%、57.1%、51.86%和25.64%的基因得到了注释。BLASTx比对结果显示,同源序列命中比率最高的几个物种分别为甜瓜(11385)、黄瓜(10580)、花烛属红掌(478)、葡萄(456)和水稻(446)。

表3 cDNA文库RNA-seq 测序结果Table 3 Summary of sequencing results based on RNA-seq from six cDNA libraries
进一步通过差异表达量分析,共获得了1234个差异表达基因(DEGs),其中679个为上调表达,555为下调表达。GO富集分析显示,共有980个DEGs得到了有效富集,包括具有“分子功能”的545个,“细胞原件”的179个,“生物代谢过程”的909个。此外,共有570个DEGs在KEGG库中得到了有效富集,这些基因可以整合到118条代谢通路当中。其中包括植物-病原互作途径(63DEGs)、植物激素信号转导(41DEGs)、苯丙素的生物合成(39DEGs)、淀粉及糖代谢(35DEGs)、氨基糖和核苷酸糖的代谢(31DEGs)(图2)。
2.3 外源乙烯利处理苦瓜幼苗参与内源激素合成的差异基因
为了进一步明确乙烯利诱导了哪些功能基因,进而影响内源激素的生物合成,基于数据库比对信息,我们筛选了与激素代谢相关的差异表达基因(表4)。其中,在乙烯生物合成途径中,共鉴定到了6个显著上调表达的DEGs,包括1个ACS基因、1个ACO基因、3个HMT3基因,这些基因的表达趋势与激素含量的变化情况一致。对于生长素合成途径,1个ALDH基因和1个TAA1基因出现了显著下调,另一个基因UGT74B1表现为显著的上调。由于生长素合成途径较为复杂,通常包含4条支路,因此上述基因的表达可能暗示着代谢支路发生了变化。与细胞分裂素代谢相关的基因表达水平也出现了改变,2个与其合成相关的CYP735A基因表达受抑,负责将细胞分裂素转化为其他代谢产物的2个CKX基因则大幅度上调表达。对于GA的代谢途径,只鉴定到1个参与其生物合成的上调表达基因KAO1,此外,通过对差异基因进行筛选,发现2个抑制其活性的CYP736A12-like基因高倍数上调表达。
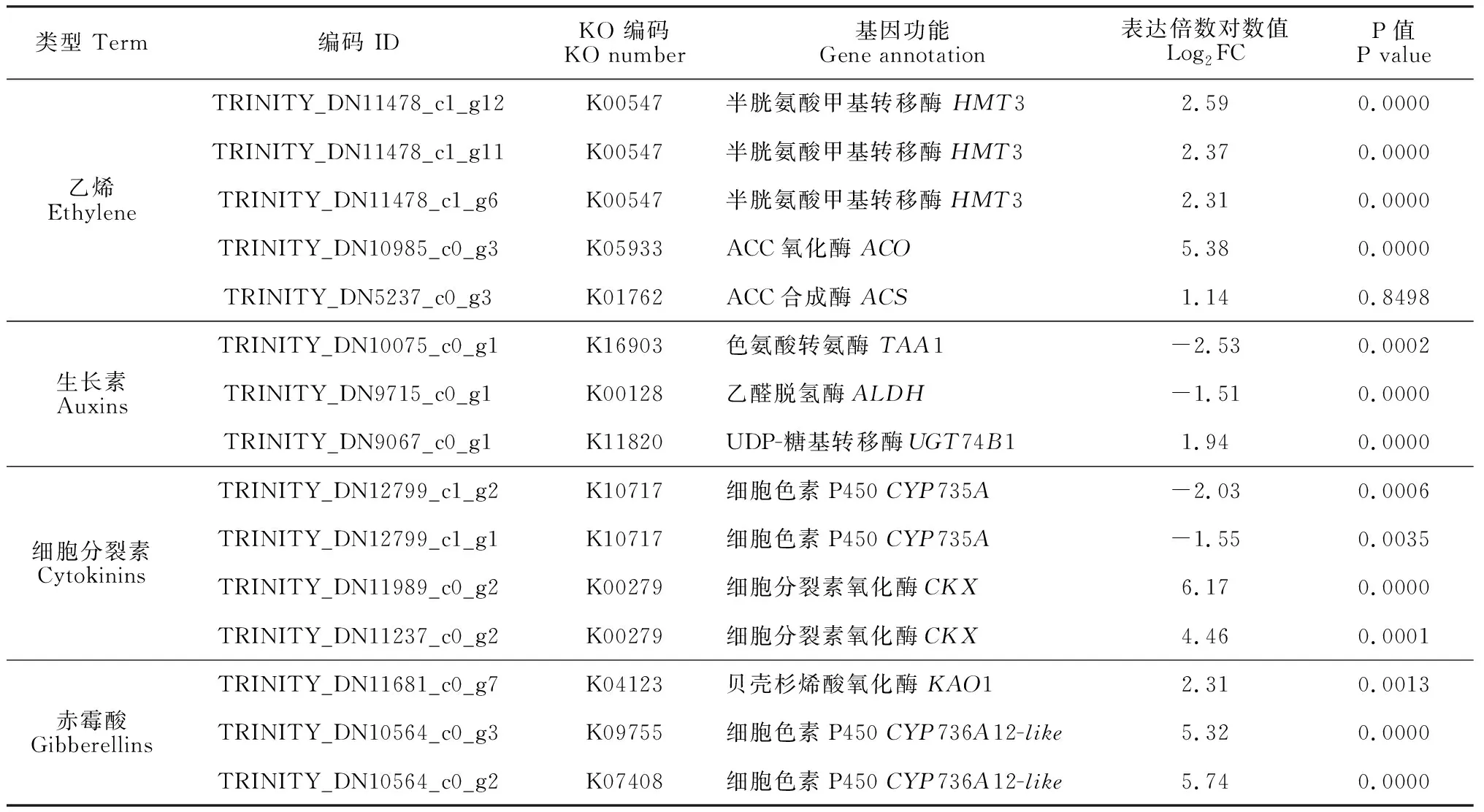
表4 与内源激素代谢相关的差异表达基因Table 4 Differentially expressed genes involved in hormonal metabolism
2.4 外源乙烯利处理苦瓜幼苗参与激素信号转导的差异基因
内源激素通常以信号转导的方式诱导下游一系列基因进行表达。通过对KEGG通路数据库中map04075进行分析发现,在乙烯的信号转导路径当中,共有1个EIN3基因和11个ERF基因显著上调表达。在生长素通路当中,3个负调控基因AUX/IAA的表达活性下降,1个ARF基因、1个GH3基因和3个SAUR基因表现为活性的上升。对于细胞分裂素通路来说,只获得了1个上调表达的负调控基因A-ARR。在GA信号通路中,3个植株矮化基因GID1、1个PIF3基因表达活性显著升高(表5)。上述参与激素应答的基因表达丰度的改变,表明乙烯利处理不仅影响内源激素的生物合成,同时也间接影响了下游基因的相应功能。
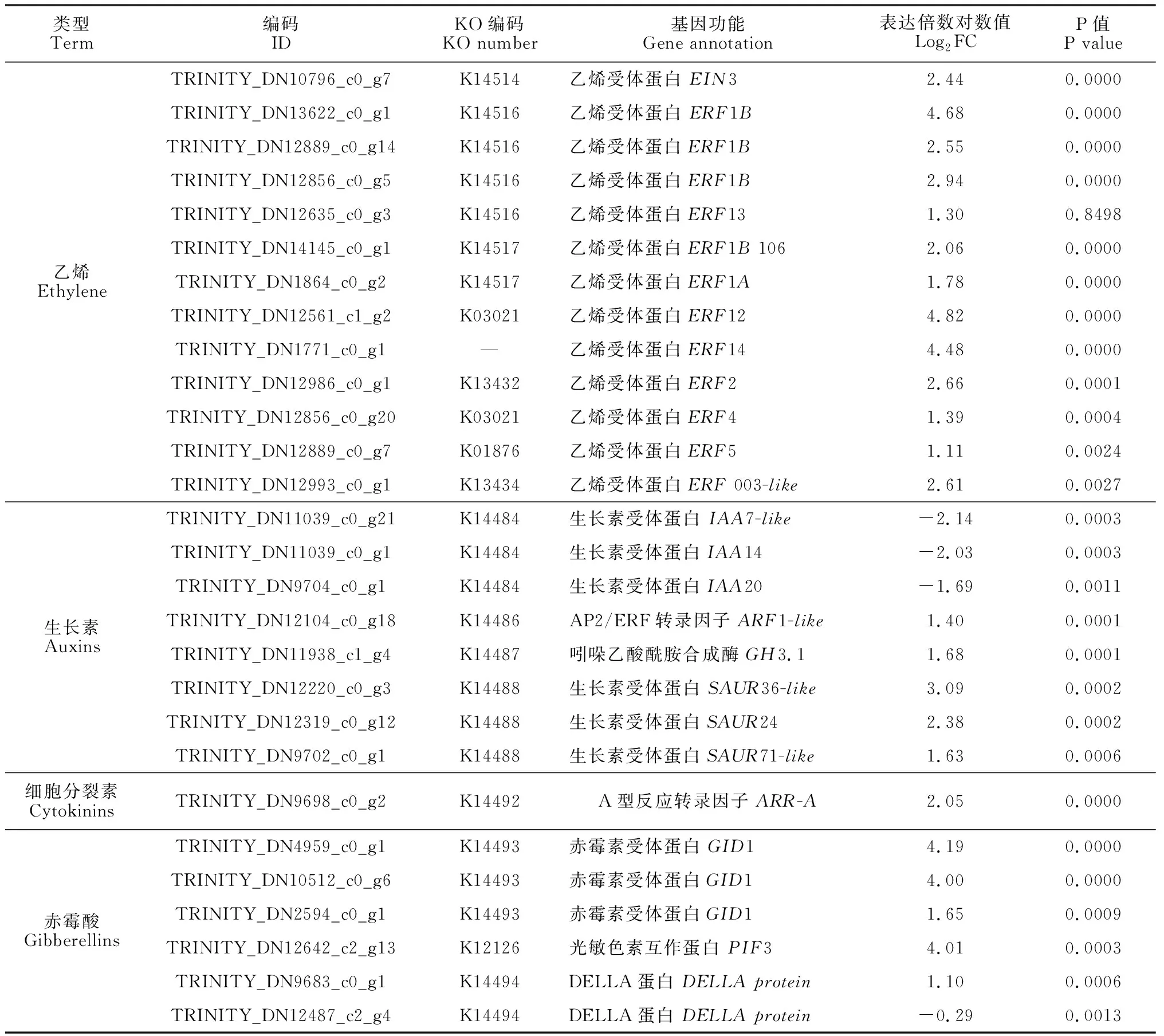
表5 与内源激素信号转导相关的差异表达基因Table 5 Differentially expressed genes involved in phytohormone signal transduction
2.5 外源乙烯利处理苦瓜幼苗差异表达基因的qRT-PCR分析
为了验证转录组测序的准确性,挑选了8个基因进行荧光定量表达分析,主要包括β-葡萄糖苷酶基因、细胞分裂素代谢调控基因CKX3、乙烯合成基因ACO1、细胞色素类基因CYP77A3等。结果显示,上述8个基因的表达趋势与转录组log2FC值变化趋势一致,其中4个为上调表达,4个下调表达,表明本次转录组获得的数据信息较为可靠(图3)。
3 讨 论
植物的生长发育受多种因素的调控,包括内因和外因的影响。外部因素主要体现为生长环境,包括温度、光照、水分、土壤、养分等多个条件,组织器官的发育需要合适的环境条件。内部因素则主要以植物激素的形式扮演着极为重要的“调节器”作用,在极低的浓度下即可诱发植物产生显著的生理反应,并表现为相应的农艺性状改变。本研究中,外源乙烯利诱发了苦瓜幼苗几种激素含量发生显著变化。作为乙烯生物合成的直接前体物质及其生物合成限速酶,ACC的含量与ACS的活性均显著升高。在番茄和大麦等作物幼苗中,施用乙烯利或者ACC均可以升高内源乙烯的含量,这与本研究结果一致[9,19]。生长素可以促进植株器官组织的发育,本研究中IAA的含量也表现出显著的升高趋势,陈学好等[14]的研究也表明,黄瓜幼苗经乙烯利处理后组织内IAA的含量出现了升高。Swarrp等[20]以拟南芥幼苗为试材,经外源乙烯处理后,IAA含量同样表现为升高的趋势。但也有一些作物在经过乙烯利处理后IAA的含量出现了下降,我们推测可能是由于实验对象的不同或者取样时期的差异所导致。细胞分裂素主要通过细胞数目的增殖和茎尖组织的快速分化调节植株的生长发育,其中两种类型iP-type 和tZ-type通常被认为具有显著生理活性[21],本研究中苦瓜幼苗经乙烯利处理后tZR的含量出现了显著升高,表明外源乙烯与细胞分裂素之间存在着正向的互作关系。GA在植物的发育过程中主要调控植株的高度与种子的萌发,本研究中GA3的含量在乙烯利的作用下出现了显著的下降,这与大多数研究结果相符[11-12]。孙义甫等[22]在早前的研究中曾指出,乙烯利与GA间存在着明显的抗拮作用,适当浓度的GA溶液喷施黄瓜幼苗可以有效逆转乙烯利对幼苗形态的影响。
内源激素含量的改变为进一步开展相关研究提供了条件,结合激素代谢的变化趋势,我们对乙烯利处理后的苦瓜幼苗进行了Illumina测序等后续研究。以往关于苦瓜的研究报道,对于乙烯利的作用模式基本局限于生理水平的研究,并没有深入探讨其对分子调控网络的影响,因此,从分子层面认识苦瓜应答外界乙烯刺激的研究具有重要理论意义。测序结果显示,与激素代谢相关的功能基因出现了差异表达。首先在内源乙烯的代谢过程中,S-腺苷-L-蛋氨酸(SAM)是其生物合成途径的重要起始物质,同时也是合成ACC的前体物质,本研究发现了3个表达水平显著升高的HMT3基因,该类基因可以有效促进SAM的生物合成[23]。此外,ACO和ACS是乙烯合成途径中的重要限速酶,二者的表达丰度在处理组中均出现了较大的提升,尤其是ACO1基因的表达倍数很高。上述结果表明,内源乙烯含量的升高主要源于SAM的累积以及ACO和ACS基因的正向调控。
对于植株的生长发育,生长素与细胞分裂素主要通过细胞体积的增大与细胞数目的增殖两种方式进行调控。生长素的生物合成包括IAOx、TRA、IAM和IPA四条途径[24]。本研究中2个与IAOx途径相关的基因ALDH和TAA1出现了下调表达,而与IPA途径有关的基因UGT74B1却出现了上调表达。联想到之前实验结果中IAA含量的增加,推测在外源乙烯的处理下苦瓜幼苗IAA的合成主要集中于IPA途径,且合成水平有较大的增强。对于细胞分裂素的变化,理化分析与转录组测序并不一致,HPLC-MS/MS检测结果显示tZR的含量比对照组有显著升高,但tZR合成的限速酶基因CYP735A表达水平却出现了下降。同时,促进tZR转化为其他代谢产物的CKX基因却表现为显著的上调表达。对于上述研究结果,我们分析可能与tZR较特殊的合成过程有关。已有研究证实tZR主要在植物的根中合成,然后经由木质部运输至地上叶片中[21]。在对地上植物组织进行乙烯利处理后,可能诱发了某种反馈机制,当叶片中与tZR生物合成相关的基因表达受抑时,根部tZR的合成代谢出现强化并更加集中地转移至叶片中,来弥补由于转录受抑带来的不利影响,从而使叶片部位保持较高的tZR含量。
赤霉素属于四环二萜类化合物,迄今为止已发现一百多种类型。其中主要以GA1、GA3、GA4、GA7等结构类型具有显著的生理活性,尤其以GA3的研究和应用最为广泛[25]。外源乙烯对内源GA的影响较多表现为抗拮作用,本研究也发现苦瓜幼苗中GA3含量在乙烯利处理后出现了显著下降,降幅达到了88.7%。但测序结果显示,控制GA3合成的相关功能基因并没有出现显著的下调表达。值得注意的是,在激素信号转导途径中,多达11个ERF家族转录因子出现了表达水平的升高,其中有多个表现出极高的表达倍数;Dubois等[26]和Plett等[27]的研究发现,ERFs基因的上调表达可以诱发生理活性型GAs含量下降,进而导致植株表现出明显的矮化生长现象。另外,我们在统计高倍数表达的差异基因时,发现了2个与GAs代谢间接相关的P450CYP736A12基因,前人研究表明在拟南芥幼苗中超表达这类基因可以使生理活性型GAs的含量出现下降,从而引发植株茎节的短缩[28]。鉴于此,我们推测本研究中外源乙烯利虽然没有在转录水平影响GA3的生物合成,但转录后调控机制(Post-translational regulation)很可能以诸如ERF等转录因子介导的方式,使活性GA3出现分解,进而导致其含量的下降。
除上述参与内源激素合成的基因受到影响之外,激素信号转导的相关基因也出现了表达水平的改变。植株在经历乙烯利处理后,内源激素诱导信号通路中一系列调节因子差异表达,使植株发育过程中的细胞体积、数目,茎杆长度,以及侧根发育等表观性状出现变化。这些调节因子中不乏有类似ERFs的基因,还能以反馈调控的方式影响内源激素(如GA3)的代谢水平。总体来讲,本研究从分子代谢水平上获得了大量外源乙烯利对苦瓜作物的作用靶点,并探讨了基因可能存在的调控功能。将来可以从中挑选某些感兴趣的基因进一步开展功能验证等后续工作,从而更加深刻地揭示乙烯类物质对瓜类作物的调节机制。

