黄连素对PCOS大鼠肠道菌群以及LPS/NF⁃κB信号通路的影响
赵粉琴,丁晓楠,安明霞,赵艳,刘洁颖
(甘肃中医药大学,甘肃 兰州 730000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是内分泌代谢异常综合性疾病[1],高雄激素、胰岛素抵抗(insulin resistance,IR)为代谢异常表型,卵巢功能障碍为生殖异常表型[2]。其病因不单单仅限于下丘脑-垂体-卵巢轴功能紊乱,肠道菌群的改变导致糖脂代谢紊乱也不容小觑[3]。研究表明,肠道菌群多样性的紊乱可能通过改变短链脂肪酸(short chain fatty acid,SCFA)、脂多糖(lipopolysaccharide,LPS)等小分子的产生,活化核因子κB(nuclear fac⁃tor-κB,NF-κB)炎症信号通路[4],刺激产生胰岛素抵抗和糖脂代谢紊乱导致肥胖,同时这些小分子物质经神经及体液系统上传信号至大脑中枢(包括下丘脑及垂体),最终导致促性黄体生成素(LH)及雄激素(T)分泌异常增加[5],高雄激素血症可能是引起PCOS肠道菌群生态失调的独立因素之一[6],胰岛素抵抗导致肥胖是PCOS重要的病理生理学基础,卵泡发育异常是PCOS的核心病理特征,肠道菌群失调是诱因,通过来改善患者肠道菌群失调,可能有助于PCOS的治疗[7]。目前对于PCOS疾病的治疗仍以减体质量和改善激素紊乱状态为主,但激素的副作用以及长期用药的局限性,限制了其在临床应用,因此寻求一种新的治疗策略就显得尤为重要。
研究表明黄连素可通过调节肠道微生态[8-10]、改善胰岛素抵抗[11]和机体慢性炎性从而达到降脂、降糖、减体质量作用。黄连素是否也会通过改善PCOS肠道菌群失调,治疗PCOS慢性炎性状态而达到平衡激素分泌紊乱状态呢?本研究旨在探讨肠道菌群与PCOS代谢异常之间的相关性,以及黄连素对肠道菌群以及LPS/NF-κB信号通路干预效应,为PCOS疾病的治疗提供新思路和方法。
1 材料及方法
1.1 材料
1.1.1 试验动物 雌性SPF级SD大鼠6周龄60只,体质量为(200±20)g,由甘肃中医药大学实验动物中心提供,实验动物许可证号:SYXK(甘)2004-0006。
1.1.2 药品和试剂 来曲唑(2.5 mg/片,江苏恒瑞医药股份有限公司,国药准字H19991001),黄连素(0.1 g/片,北京中新制药厂,国药准字H11020962),盐酸二甲双胍片(0.5 g/片,中美上海施贵宝制药有限公司,国药准字H20023370),达英-35(炔雌醇环丙孕酮片,每片含2 mg醋酸环丙孕酮和0.035 mg炔雌醇,拜耳医药保健有限公司,国药准字J20140114),羧甲基纤维素钠(CMC)(国药集团化学试剂有限公司,国药准字H20181203),性激素和炎性因子试剂酶联免疫试剂盒购自江苏菲亚生物科技有限公司LH(MM-0624R1),FSH(MM-0566R1),T(MM-0624R2),E2(MM-0575R1),P(MM-0551 R1),白细胞介素1β(IL-1β,MM-0047R2),γ干扰素(IFN-γ,MM-0198R2),肿瘤坏死因子α(TNF-α,MM-0180R2),脂多糖(LPS,MM-0647R2),电子分析秤(赛多利斯科学仪器(北京)有限公司,京制00000246号),(欣舒测AB-103G血糖仪,批号:CZ119799)。
1.2 试验方法
1.2.1 试验分组、造模以及药物干预 动物造模:用来曲唑1 mg/(kg·d),连续灌胃3周,以阴道脱落细胞显示动物处于动情间期为造模成功;将大鼠随机分为对照组(K)、PCOS模型组(M组)、二甲双胍组(E组)、黄连素组(H组)、达英-35组(D组)以及黄连素+二甲双胍+达英-35组(3药物合用,HED组),每组10只。二甲双胍组:二甲双胍剂量为0.135 g/(kg·d),70 kg人的剂量1.5 g/d;黄连素组:黄连素剂量为0.216 g/(kg·d),换算成大鼠剂量0.108 g/(kg·d),70 kg人的剂量1.2 g/d,相当于人的剂 量 的2倍[12-13];达 英 组:达 英-35剂 量 为0.18 mg/(kg·d),70 kg人的剂量按照醋酸环丙孕酮2 mg/d剂量用药;黄连素+二甲双胍+达英-35组:3药物合用;连续灌胃28 d。
1.2.2 观察指标及检测方法
1.2.2.1 大鼠体质量变化 每7 d测体质量一次,早晨添加饲料前测定。
1.2.2.2 大鼠血清性激素、空腹胰岛素、血糖、LPS以及炎性因子水平的检测 末次给药后禁食12 h,取尾尖血测血糖。其余检测血清指标在处死前心脏取血1.5 mL,在4℃以3 000 r/min离心10 min,吸取上层血清移入EP管。采用ELISA 96孔检测法检测血清卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)、雌激素(E2)和孕酮(P);炎性因子和脂多糖(LPS)按试剂盒操作步骤进行,使用酶标仪在450 nm波长进行吸光度(OD)检测。计算稳态模型胰岛素抵抗指数(homeostatic model assessment for insulin resistance,HOMA-IR)。HOMA-IR公式为:
HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5
1.2.2.3 16s rDNA扩增子焦磷酸测序肠道菌群分析 每个粪便样品的冷冻试样(约5 g),采用SDS裂解液冻融法进行DNA提取,基因组DNA通过PowerMax提取试剂盒(MoBio Laboratories,Carls⁃bad,CA,USA)提取,采用Barcode的16s rRNA基因V4区引物,PCR产物用AMPure XP Beads(Beckman Coulter,Indianapolis,IN)纯化,并且使用PicoGreen dsDNA,Assay Kit(Invitrogen,Carlsbad,CA,USA)进行量化。定量后使用Illlumina Nova⁃seq 6000 pair-end 2×150 bp平台测序。
1.3 统计方法
所有数据用SPSS 20.0版统计学软件,数据用均数±标准差(±s)表示,用One-Way ANOAY方差分析,组间比较采用LSD法和Dunnett法分析,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 大鼠体质量变化分析
如图1,各组大鼠体质量随时间呈上涨趋势,与对照组比较,PCOS模型大鼠体质量每周时间点都增加(P<0.01);与模型组比较,给药后,随着时间延长,大鼠体质量逐渐下降,黄连素组第7天,其他药物的第28天,大鼠体质量下降最显著(P<0.05)。
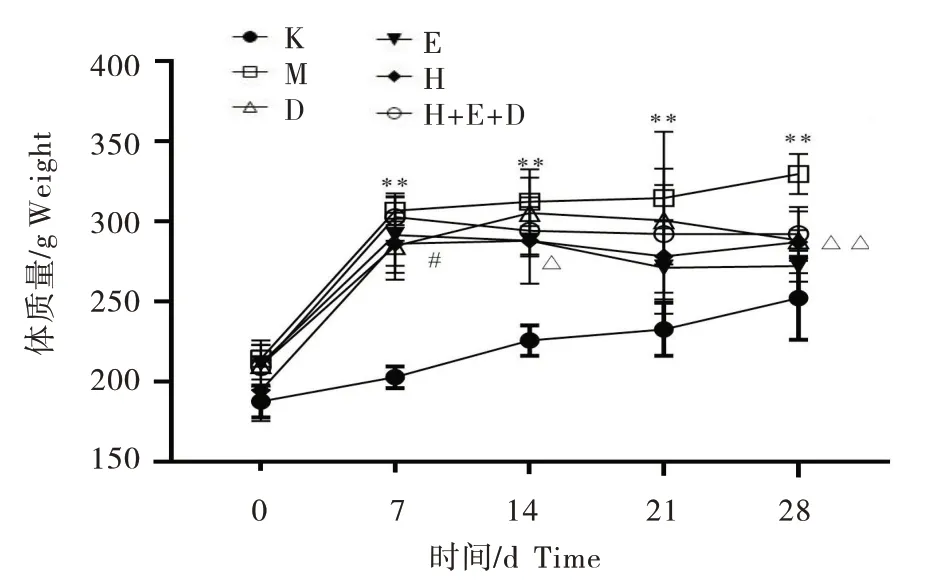
图1 各组大鼠体质量变化分析Figure 1 Changes of weight in rats
2.2 大鼠血清性激素水平变化分析
由图2可知,相对于对照组,PCOS模型组大鼠有较高的LH、T水平以及LH/FSH比值(P<0.01);药物能降低模型组大鼠血清LH、T水平和LH/FSH比值,尤以黄连素组、三药连用组对T水平和LH/FSH影响最显著(P<0.05),而对血清FSH、E2和P水平影响不明显。

图2 各组大鼠激素水平比较Figure 2 Changes of FSH,LH、E2、T and Pin rats
2.3 大鼠血清胰岛素含量、胰岛素指数(HOMAIR)、脂多糖(LPS)、IL-1β、INF-γ和TNF-α变化分析
与对照组比较,PCOS组大鼠血清胰岛素、脂多糖、IL-1β、INF-γ和TNF-α含量和HOMA-IR明显增加(P<0.01,0.05);与模型组比较,达英-35组、二甲双胍组和黄连素组大鼠血清HOMA-IR、脂多糖、IL-1β、INF-γ和TNF-α含量降低,尤以血清IL-1β黄连素组和三药连用组降低较为显著(P<0.05)。结果见表1。

表1 大鼠血清胰岛素含量、HOMA-IR、LPS、IL-1β、INF-γ和TNF-α变化Table 1 Changes of LPS、IL-1β、INF-γand TNF-αin rats(n=10)
2.4 肠道菌群的变化
2.4.1 OUT聚类分析 通过韦恩图分析发现,属水平上在2 221个属中找出对照组92个、模型组58个、达英组155个、二甲双胍组112个、黄连素组157个、三药连用组249个(图3-A)。Ternary三元相图优势物种分析,模型组优势物种为普氏菌属(Prevotella),黄连素组优势物种为拟杆菌属(Bacteroides),三药连用优势物种为苏黎世杆菌科(Turicibacter)(图3-B)。组间丰度曲线,折线长短与OUT菌落丰富度,折线平缓程度与群落组成的均匀度,折线陡峭与群落丰度差异呈正相关。说明模型组OUT数量少,丰度差异小,均匀度低,药物组OUT数量增加,丰度差异大,均匀度高(图4)。菌群alpha分析结果显示,与对照组比较,模型组菌群多样性指数Shannon指数、Simpson指数和丰富度Chao指数下降(P<0.05),但是各组之间无统计学差异(P>0.05,图5)。NMDS图对不同样本的微生物群落结构进行Beta多样性分析,同类样本菌群聚为一起,肠道菌群结构组成在PC2和PC1维度上均存在显著的统计学差异(P=0.017<0.05)(图6)。PC1总变异率为24.95%,PC2总变异率为12.02%,说明模型组和药物组菌群存在差异。

图3 OUT肠道菌群分类Figure 3 OUT intestinal flora classification
图4 样本间和组间的丰度曲线图Figure 4 Abundance curves between samples and groups

图5 OUT肠道菌群Alpha多样性分析Figure 5 OUT Alpha diversity analysis of intestinal flora

图6 各组样本肠道菌群PCoAFigure 6 Intestinal microflora PCoA of each group
2.4.2 肠道的微生物菌群分类分析 如表2,图7所示,与对照组比较,PCOS组门、纲、目、科、属水平群落数量都显著减少(P<0.05);与模型组比较,药物治疗后不同分类水平群落组成数量均增加,尤其二甲双胍和黄连素在属和种水平菌数量增加(P<0.05)。如表3,图8所示,在门(phylunm)水平上,相对于对照组,PCOS组拟杆菌门、放线菌门和疣微菌门相对丰度以及拟杆菌门/厚壁菌门比值下降(P<0.05),而厚壁菌门相对丰度上升(P<0.05);二甲双胍提高了模型组大鼠拟杆菌门相对丰度(P<0.05),达英-35减低模型组大鼠厚壁菌门相对丰度,提高拟杆菌门/厚壁菌门比值(P<0.05),黄连素提高模型组大鼠疣微菌门相对丰度(P<0.05)。

图7 肠道菌群不同分类水平群落组成数量Figure 7 Composition of intestinal flora at different classification levels

图8 门水平各组样本肠道菌群的相对丰度Figure 8 Relative abundance of intestinal microflora at phylum leve
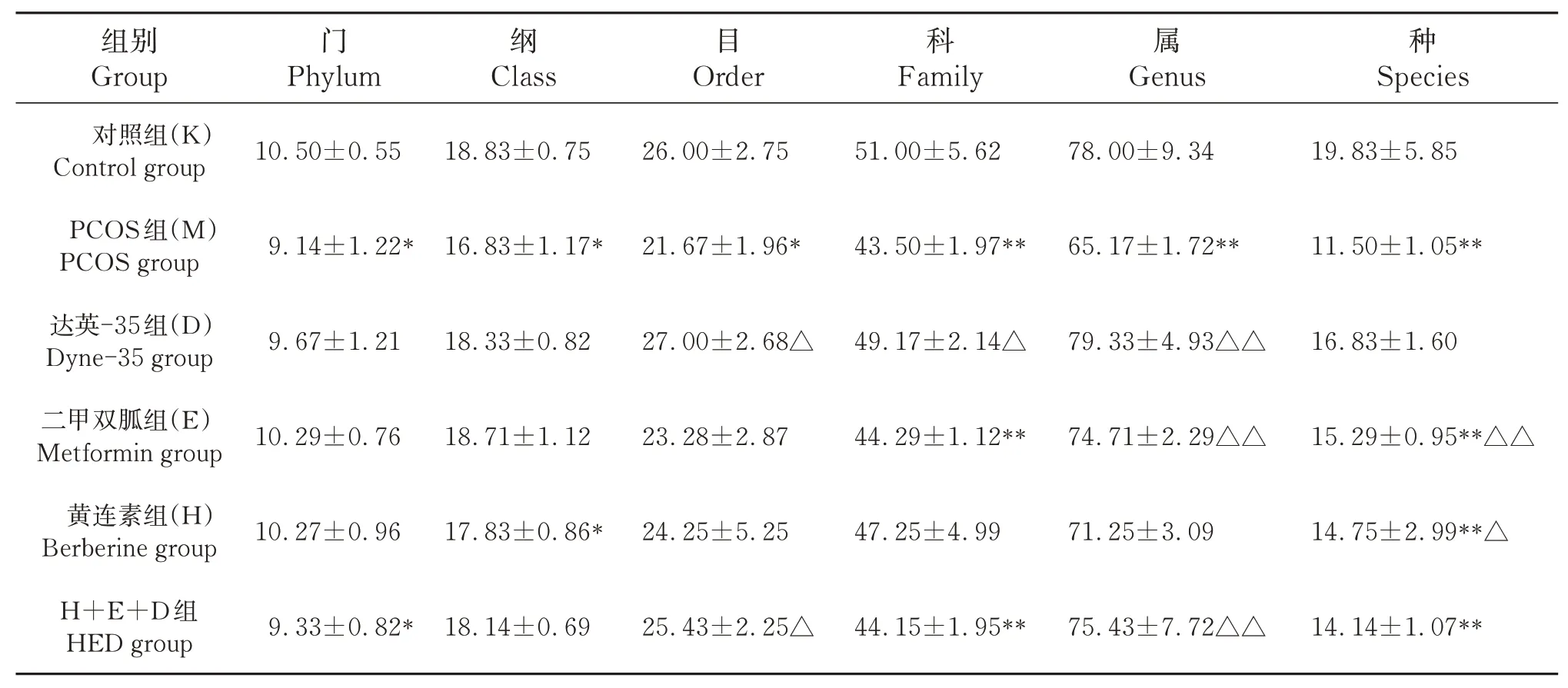
表2 各组菌群门、纲、目、科、属、种类群落组成量比较(n=10)Table 2 Comparison of community composition of phyla,class,order,family,genus and species in each group(n=10)
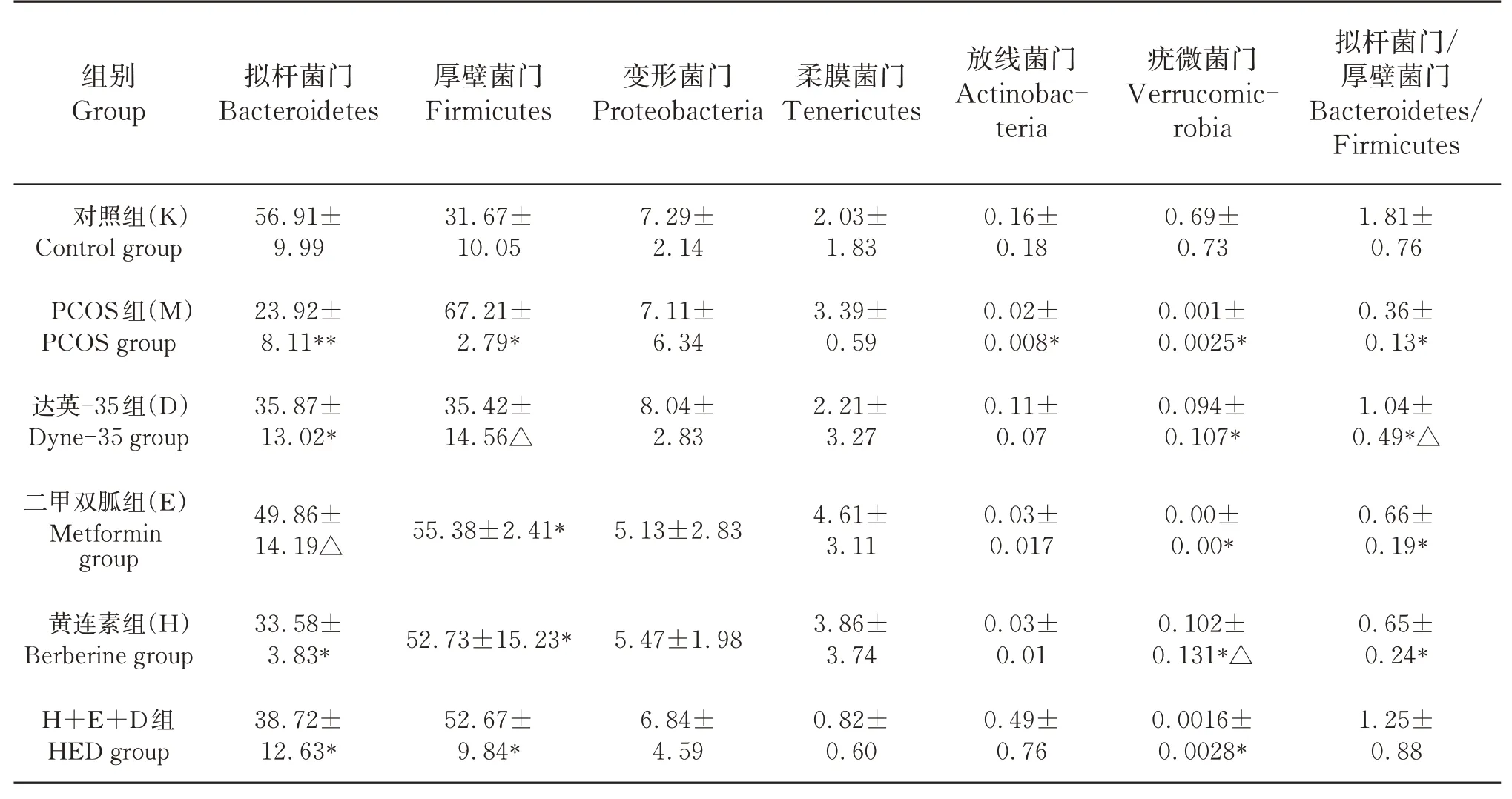
表3 物种门水平上相对丰度比较(n=10)Table 3 Comparison of relative abundance at phylum level(n=10) %
2.4.3 肠道菌群属水平分析 如表4和图9所示,属分类相对丰度占比,结合图10属聚类热图,与对照组比较,PCOS模型组拟杆菌属、粪球菌属、萨特氏菌属、乳酸菌属相对丰度明显降低于正常组(P<0.01,P<0.05),而普氏菌属(P<0.01)、颤螺菌属和厌氧菌属相对丰度增加;与模型组比较,达英-35、二甲双胍和黄连素组拟杆菌属和萨特氏菌属相对丰度明显增加(P<0.05),尤其是黄连素对萨特氏菌属相对丰度增加较为显著(P<0.01)。聚类热图分析双歧杆菌属(Bifidobacterium)对照组占比为(0.033%),相对丰度明显高于PCOS模型组(0.000 3%),达 英 组(0.014%),二 甲 双 胍 组(0.001 8%),黄连素组(0.000 53%)相对丰度高于模型组,尤其是三药组(0.097%),相对丰度明显高于模型组。
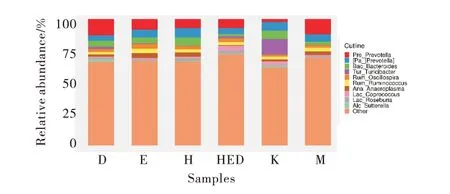
图9 属水平各组样本肠道菌群的相对丰度Figure 9 Relative abundance of intestinal microflora at genus level

图10 肠道菌群属水平的聚类热图Figure 10 10 Cluster heat map of intestinal flora at genus level
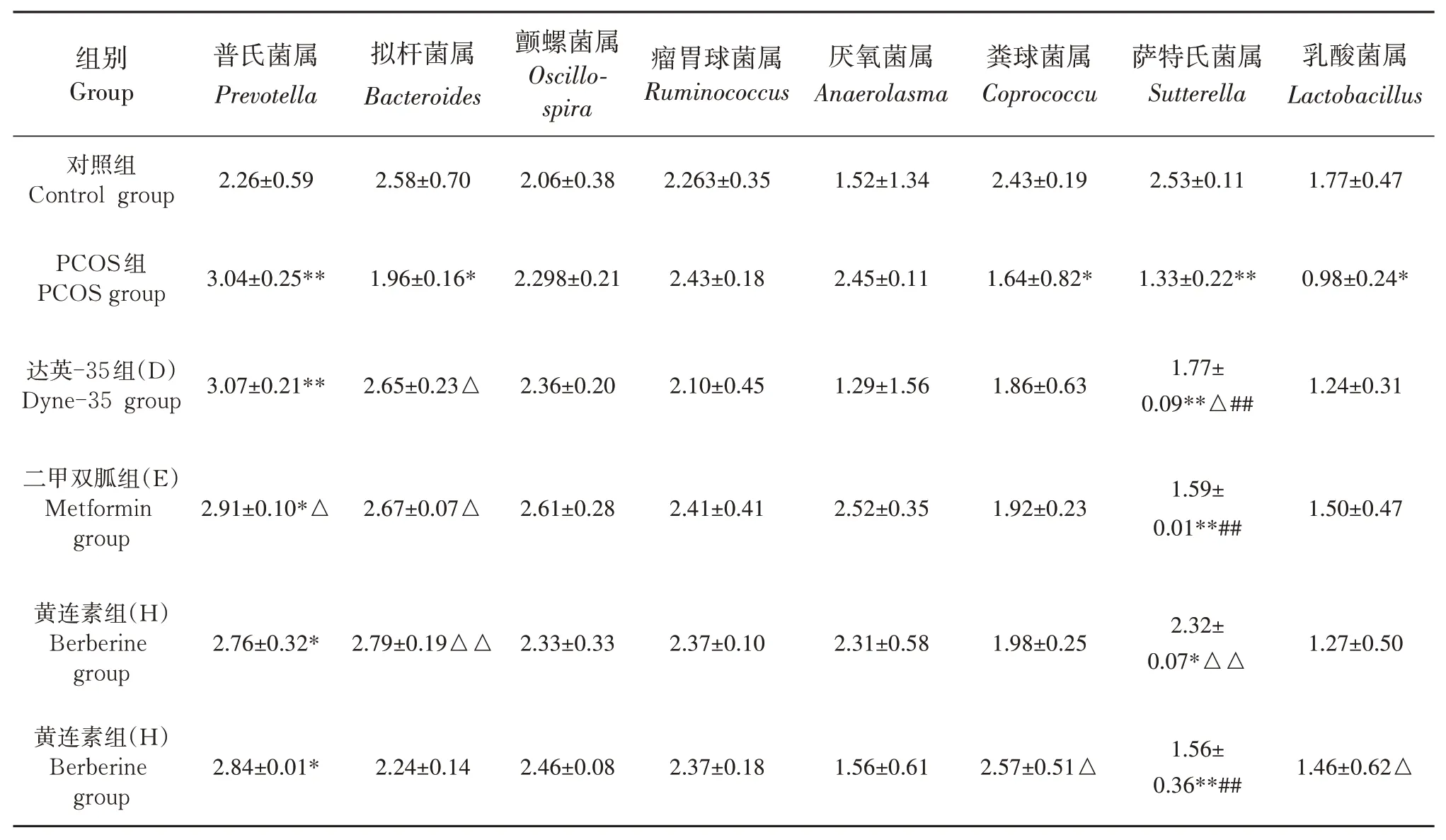
表4 物种属水平上相对丰度比较(n=10)Table 4 Relative abundance of species at genus leve(ln=10) %
2.4.4 各组间菌群差异分析 本研究利用LEfSe方法在各组之间寻找差异菌种(图11)和进化分支图(图12),结果显示:有19个菌种相对丰度在两组间存在差异(LDA>2),其中达英组产气杆菌(Aero⁃coccaceae)和凸腹真杆菌(Eubacterium)相对丰度高于对照组,黄连素组拟杆菌(Bacteroides)相对丰度高于对照组,三药连用双歧杆菌科(Bifldobacteria⁃ceae)、双歧杆菌(Bifldobacteriacles)、双歧杆菌(Bifl⁃dobacterium)、放线菌(Actinobacteria)、棒状杆菌属(Corynebacterium)、巨球菌(Megasphaera)、棒状杆菌科(Corynebacteriaceae)相对丰度高于对照组。达英组代表物种为产气杆菌(Aerococcaceae),黄连素组代表物种为拟杆菌(Bacteroides),三药连用代表物种为双歧杆菌(Bifldobacteriaceae)、双歧杆菌(Bi⁃fldobacteriacles)、放线杆菌(Actinobacteria)、棒状杆菌属(Corynebacterium)。
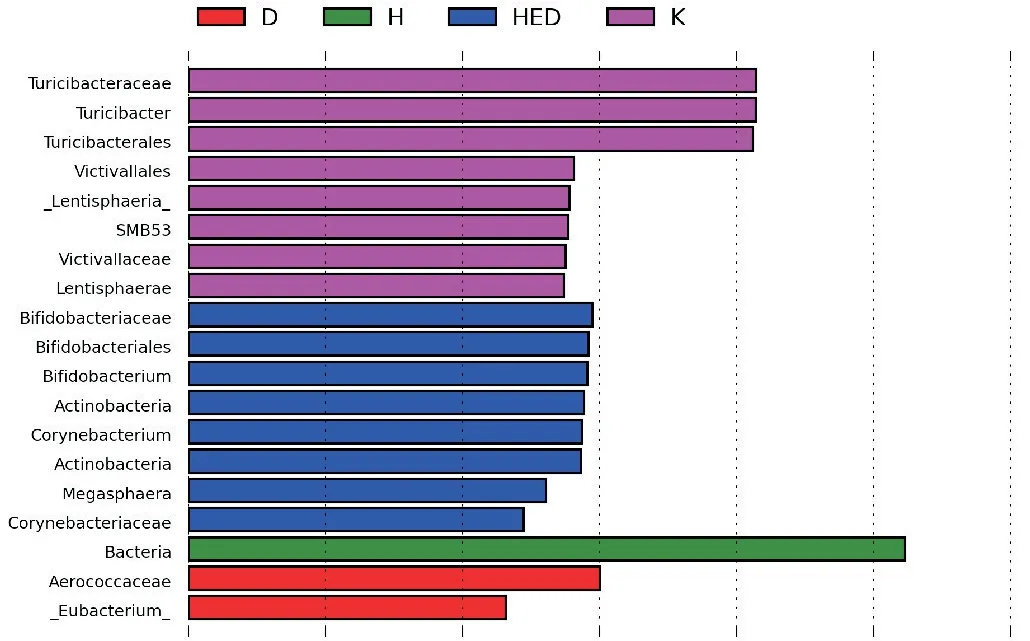
图11 各组样本肠道菌群LDA值分布柱状Figure 11 Columnar distribution of LDA values of intestinal flora

图12 各组样本肠道菌群特有物种分析Figure 12 Analysis of intestinal microflora unique
2.4.5 基于BugBase的5类表型分类比较 如表5所示,与正常组比较,PCOS模型组需氧菌(Aerobic)和革兰氏阳性(Gram Positive)下降(P<0.05);厌氧菌(Anaerobic)、革兰氏阴性(Gram Negative)和潜在的致病性(Potentially Pathogenic)增加(P<0.05);与模型组比较,二甲双胍组、黄连素组和HED组革兰氏阴性(Gram Negative)和潜在的致病性(Potentially Pathogenic)下降(P<0.05),革兰氏阳性(Gram Positive)增加(P<0.05),尤其是三药连用效果最佳。

表5 基于BugBase分类比较(n=10)Table 5 Classification comparison based on BugBase(n=10) %
3 讨论
已经有研究表明,肠道菌群在PCOS发病中有着重要作用。多囊卵巢综合征(PCOS)表现出月经紊乱、卵泡发育障碍、高雄激素肥胖[14]、胰岛素抵抗(IR)(占50%~70%)[15-16]、心血管疾病[17]以及糖脂代谢等问题[18]都与肠道菌群失调密切相关,而且肥胖和胰岛素抵抗加重了高雄激素血症的症状,形成了促进多囊卵巢综合征发展的恶性循环[19]。
本研究结果显示PCOS模型大鼠体质量升高,血清睾酮(T)、黄体生成素(LH)以及LH/FSH明显升高,肠道菌群菌属减少,群落组成的丰富度和均匀度降低,导致肥胖[20-21]的“胖菌”厚壁菌门及放线菌门比例增高,“瘦菌”的拟杆菌门、放线菌门和疣微菌门相对丰度下降。有益菌拟杆菌属、乳酸菌属、双歧杆菌属和萨特氏菌属相对丰度减低,而致炎菌普氏菌属和瘤胃球菌属、颤螺菌属和厌氧菌属相对丰度增加,与Lindheim等的[22]研究一结果致。PCOS肠道菌群失调,致病菌大量繁殖,产生大量内毒素脂多糖(LPS),使肠道黏膜屏障受损,引发炎症性肥胖以及胰岛素抵抗,同时过多脂多糖入血,激活NF-κB信号,释放炎性因子,血清IL-1β、INF-γ和TNF-α水平明显增加,干扰胰岛素信号表达,导致过多胰岛素分泌即IR,IR反过来加重肥胖以及PCOS的发生[23-24]。
给予药物干预后,模型大鼠体质量下降,睾酮水平、LH水平下降,胰岛素分泌减少,LPS、IL-1β、INF-γ和TNF-α水平明显减少,尤以黄连素作用最显著,黄连素可以下调NF-κB活性[25],抑制炎症因子(IL-1β、INF-γ)的分泌,同时也是胰岛素增敏剂[26],通过TNF-α抗体中和TNF-α,可以改善肥胖大鼠的胰岛素抵抗。同时肠道菌群的丰富度和均匀度增加,在门水平提高拟杆菌门、放线菌门和疣微菌门相对丰度,在属水平拟杆菌属、乳酸菌属、双歧杆菌属和萨特氏菌属等有益菌属相对丰度提高,而普氏菌属、瘤胃球菌属、颤螺菌属和厌氧菌属等致病菌属相对丰度下降。这与黄连素[27]增加了肠道拟杆菌相对丰度,显著抑制粪肠球菌的生长,增加有益菌乳酸菌和双歧杆菌的生长[28-29]有关。萨特氏菌属、拟杆菌属、普氏菌属、乳酸菌属和双歧杆菌属除了能抑制有害微生物生长,还可以产生短链脂肪酸(SC⁃FAs)[30]。短链脂肪酸作用有抗炎、保护肠黏膜功能、调节胰岛素和胰高血糖素分泌,调节肠道免疫反应[31]。而且黄连素可以大幅度增加疣微菌门的嗜黏蛋白阿克曼菌(Akkermansia muciniphila)相对丰度,研究发现该菌与肥胖呈负相关[32],增加该菌丰度可改善与肥胖相关的代谢异常,改善伴有肥胖、胰岛素抵抗及降低血浆脂多糖的作用[33],这可能是黄连素治疗肥胖型PCOS的主要作用机制。
综合以上研究,二甲双胍和黄连素明显改善胰岛素抵抗和减轻体质量,达英-35可以改善性激素分泌紊乱状态。黄连素和三药联合在改善激素和炎性因子分泌紊乱及调整肠道菌群失调等方面作用明显。但是,黄连素改善PCOS大鼠肠道菌群可能只是一方面作用,是否可以作为长期管理PCOS的药物,还有待以后进一步研究。

