陶融型白酒正常和退化窖泥细菌群落多样性解析及其理化影响因素
黄润娜,侯建光,崔璐芸,胡晓龙,刘延波,韩素娜*,李 华,王晓毅,刘 琳,付 蕊
(1.河南仰韶酒业有限公司,河南 三门峡 472400;2.郑州轻工业大学 食品与生物工程学院,河南 郑州 450000;3.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州 450046)
陶融型白酒是具有河南地域和仰韶文化特色的创新产品,以陶泥窖为发酵容器,其酿造工艺特点可概括为“三曲九粮、四陶九甑、深养两藏、自成一格”。窖泥富含氮、磷、钾、腐殖质等重要成分,具有高含水量、低含氧量等特征[1-2],可以为微生物的生长、繁殖提供营养。窖泥微生物经过长期的驯化、变异,种类不断丰富,形成了窖泥功能菌微生态菌群系[3-5],是白酒酿造过程中重要的微生物来源,特别是厌氧菌群[6]。这些微生物群落可以代谢出影响白酒质量的风味化合物[7-8]。
窖池退化是一个长期积累的过程,引起窖池老化的原因主要有酒醅酸度过高、窖泥配料不合理、窖泥发酵不平衡等,这些因素导致生成的乳酸钙、乳酸亚铁、乳酸铜和乳酸镁等在窖壁上沉积[9],影响白酒品质[10-11]。目前,对窖泥的研究主要集中在浓香型白酒窖泥,包括对窖泥的感官评价、理化指标、微生物群落分析和应用等方面的研究,而对窖池上、中、下、底层不同空间位置窖泥的微生物变化及其与理化指标关联性的研究较少。余有贵等[12]通过对老化窖池与常规窖池窖泥的特性与发酵性能进行比较,发现老化窖池的窖泥因理化指标的变化,直接影响微生物的正常代谢,导致酒质降低和产酒量下降;HU X L等[13]研究发现,随着窖泥质量的提高,梭状芽孢杆菌纲(Clostridia)、拟杆菌纲(Bacteroidia)和甲烷杆菌纲(Methanobacteria)等物种的丰富度及微生物群落多样性显著增加,pH、NH4+和有效磷水平相应增加;王艳丽等[14-15]研究发现,退化窖泥中的钙、铁含量均高于正常窖泥和优质窖泥,乳酸杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、雷尔氏菌属(Ralstonia)和诺卡氏菌属(Nocardia)的相对含量低于正常窖泥;胡晓龙等[16-17]研究发现,随着窖泥质量的提高,微生物群落的香农(Shannon)指数及Chao1指数显著增加;罗雯等[18]研究发现,趋老熟、老熟窖泥中梭菌属(Clostridium)为主要优势菌群,而新窖泥、趋老化窖泥、老化窖泥中,假单胞菌属(Pseudomonas)为绝对优势菌属。
目前,关于陶融型白酒窖泥的研究鲜有报道。解析陶融型白酒窖泥细菌群落结构及其随质量、空间位置的变化规律,对陶融型白酒的生产应用具有重要意义。因此,本研究以陶融型白酒退化窖池和正常窖池上层、中层、下层及窖底窖泥为研究对象,采用高通量测序技术解析窖泥细菌群落多样性和组成及其空间分布特征,并通过冗余分析(redundancy analysis,RDA)对影响细菌群落的理化因素进行了分析,以期阐明陶融型白酒窖泥微生物细菌菌群组成及其随质量及空间位置的变化特征。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥样品:陶融型白酒酿造车间。
1.1.2 试剂
酚酞、邻苯二甲酸氢钾、氢氧化钠、无水乙醇、无水亚硫酸钠、无水葡萄糖、氨水、抗坏血酸(均为分析纯):天津市凯通化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、氯化钾(均为分析纯):生工生物工程股份有限公司;硫酸、盐酸(均为分析纯):洛阳昊华化学试剂有限公司;重铬酸钾(分析纯):洛阳市化学试剂厂;苯酚(分析纯):天津市永大化学试剂有限公司;氯化铵(分析纯):烟台市双双化工有限公司;次氯酸钠(分析纯):天津市津东天正精细化学试剂厂;酒石酸锑钾、亚硝基铁氰化钾(均为分析纯):天津市科密欧化学试剂有限公司;钼酸铵(分析纯):天津亨鑫化工有限公司;氟化铵(分析纯):天津市大茂化学试剂厂;硼酸(分析纯):天津市登科化学试剂有限公司;磷酸二氢钾(分析纯):成都市科龙化工试剂厂;2,4-二硝基酚(分析纯):上海化学试剂有限公司;Magen HiPure Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:广州美基生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
UV BlueStar A紫外分光光度计:北京莱伯泰科仪器股份有限公司;TGL-20M高速冷冻离心机:上海卢湘仪离心机仪器有限公司;PB-10 pH计:德国Sartorius公司;MP200A精密电子天平:上海良丰仪器仪表有限公司;101-1电热鼓风干燥箱:北京中兴伟业仪器有限公司;DF-1集热式恒温磁力搅拌锅:金坛市中大仪器厂。
1.3 实验方法
1.3.1 窖泥样品的采集
窖泥样品均取自陶融型白酒酿造车间。根据退化窖池窖泥(黄色、酯香弱等)和正常窖池窖泥的感官特征(香气正、手感细腻、带有明显酯香、酒香等)选取退化窖池(A)和正常窖池(B)[19]。随机选取正常使用的3口退化窖池和3口正常窖池,每口窖池选取窖壁上层(位置1)、中层(位置2)、下层(位置3)及窖底(位置4)窖泥(图1);每层选取1个窖泥样品,并将2类窖池相同位置的窖泥分别混匀作为该窖池的代表性样品。即正常窖池、退化窖池各取4个代表样品,即上层A1和B1、中层A2和B2、下层A3和B3和窖底A4和B4窖泥,共计8个窖泥样品。将每份窖泥样品分为2份于-20 ℃冰箱保存,1份用于高通量测序分析,1份用于理化性质分析。
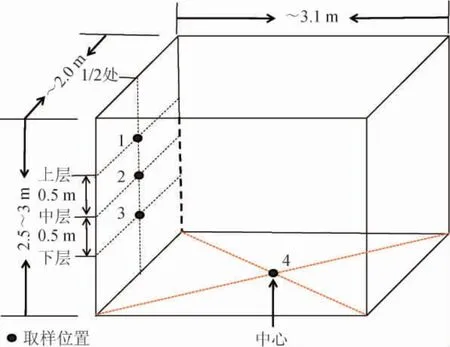
图1 窖泥取样位置Fig. 1 Sampling location of pit muds
1.3.2 理化指标的测定
含水量:参照李俊辉等[20]的烘干法测定;pH:参照李俊辉等[20]的电位法测定;总酸含量:采用酸碱中和滴定法测定[21];铵态氮含量:采用靛酚蓝比色法测定[22];有效磷含量:参照农业行业标准NY/T 1121.7—2014《土壤检测第7部分:土壤有效磷的测定》测定。
1.3.3 窖泥宏基因组提取及Illumina Miseq高通量测序
利用Magen HiPure Soil DNA Kit试剂盒并参照说明书提取窖泥样品的总DNA,采用Qubit 2.0荧光定量仪测定其浓度和纯度。将合格的DNA委托北京百迈客生物科技有限公司完成建库及Illumina MiSeq双端测序。其中16S rDNA扩增子引物对为F(5'-CCTACGGRRBGCASCAGKVRV GAAT-3')和R(5'-GGACTACNVGGGTWTCTAATCC-3'),扩增区域为16S rDNA的V3-V4区。
1.3.4 数据分析
采用Cutadapt(v1.9.1)、Vsearch(v1.9.6)及Qiime(v1.9.1)软件对高通量测序序列进行质控,包括序列拼接,以及去除含有N的序列、引物和接头、质量值<20的碱基、碱基长度<200 bp的序列及嵌合体序列,得到有效序列。使用VSEARCH(v1.9.6)将有效序列进行聚类,将相似性≥97%的序列归为1个操作分类单元(operational taxonomic unit,OTU)。基于OTU分析结果,采用对样本序列进行随机抽平的方法,分别计算Shannon指数、Chao1指数等α-多样性指数反映群落的物种丰度和多样性。基于β-多样性分析得到的4种距离矩阵,使用R语言工具进行主坐标分析(principal coordinates analysis,PCoA)和非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析,进而完成不同样品间细菌群落结构的β-多样性分析。采用软件Canoco 5绘制RDA图谱;采用Heml软件绘制热图。
2 结果与分析
2.1 窖泥样品理化性质的测定
不同窖泥理化指标的测定结果见表1和表2。
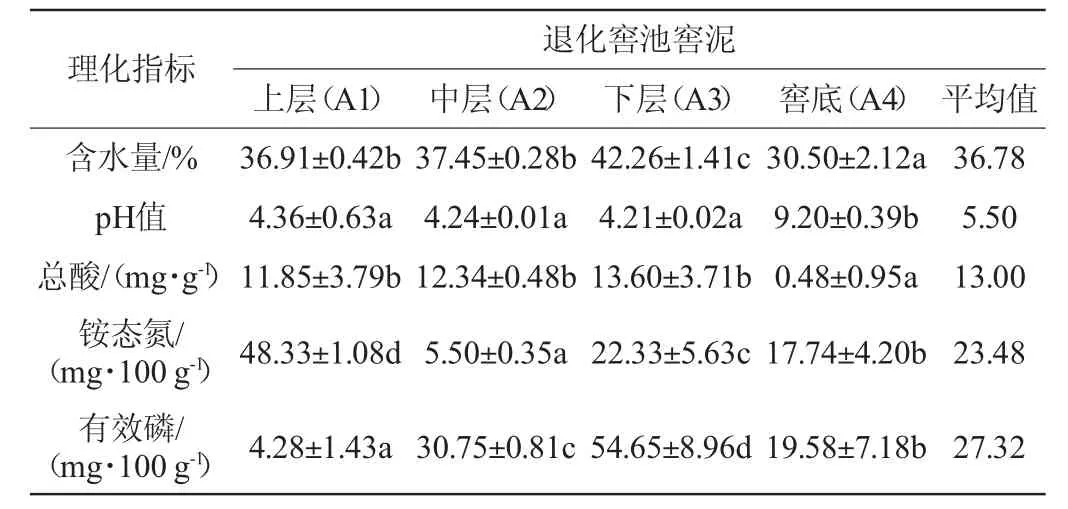
表1 退化窖池窖泥样品理化指标的测定结果Table 1 Determination results of physical and chemical indexes of pit mud samples in degraded pit
由表1和表2可知,退化窖池窖泥含水量(36.78%)低于正常窖池窖泥含水量(38.24%)。分析原因可能是老化窖泥有些许板结,保水能力低于正常窖泥[12]。窖泥的pH值影响微生物的生长繁殖,能反映窖池发酵是否正常,将不同质量窖泥区分开[13,15,23]。本研究中正常窖池的pH值(6.67)与刘梅等[19]研究得到的优质窖泥的pH值更接近于7的结论相符,高于退化窖池的窖泥pH值(5.50)。退化窖池窖壁泥的总酸含量(13.00 mg/g)明显高于正常窖池窖壁泥(平均值0.60 mg/g)。退化窖池窖泥的铵态氮含量(23.48 mg/100 g)低于正常窖池窖泥(35.33 mg/100 g);退化窖池窖泥的有效磷含量(27.32 mg/100 g)高于正常窖池窖泥(18.16 mg/100 g)。

表2 正常窖池窖泥样品理化指标的测定结果Table 2 Determination results of physicochemical indexes of pit mud samples in normal pit
从空间位置来看,正常窖池窖泥和退化窖池窖泥下层的含水量要显著高于其他位置(P<0.05);退化窖池窖底泥样品A4中的pH值要显著高于其他位置(P<0.05),而正常窖池中层窖泥样品B2中的pH值显著高于其他位置(P<0.05);退化窖池窖底泥样品A4中的总酸含量显著低于其他位置(P<0.05),而正常窖池窖泥与之相反(P<0.05);退化窖池中层窖泥样品A2中的铵态氮含量显著低于其他位置(P<0.05),而正常窖池与之相反(P<0.05);退化窖池下层窖泥样品A3中的有效磷含量显著高于其他位置(P<0.05),而正常窖池窖底泥样品B3、B4中的有效磷含量显著高于其他位置(P<0.05)。结果表明,退化窖池窖泥的理化性质发生了一定程度的变化。
2.2 窖泥样品细菌群落α-多样性分析结果
基于OTU数不同窖泥样品的细菌群落的稀疏曲线及α-多样性分析结果分别见图2和表3。

表3 不同窖泥样品细菌群落的α-多样性分析结果Table 3 Analysis results of α-diversity of bacterial community in different pit mud samples

图2 基于窖泥细菌群落OTU数的稀疏曲线Fig. 2 Rarefaction curve based on the number of OTUs of bacterial community in pit mud
由图2可知,当测序深度>10 000条之后,稀疏曲线进入平台期。由于本研究测序深度(≥70 000条)远大于10 000条,且由表3可知,覆盖率均>99%,说明本次测序深度可覆盖样品中绝大多数微生物信息。
由表3可知,退化窖池窖泥样品中的OTU数在505~664个之间,Chao1指数在594.03~723.00之间,Shannon指数在2.97~8.41之间,而正常窖池的OTU数在456~589个之间,Chao1指数在573.79~651.66之间,Shannon指数在4.93~6.20之间。退化窖池各层窖泥的OTU数、ACE指数和Chao1指数均高于正常窖池窖泥;除样品A2外,退化窖池各层窖泥的Shannon指数也高于正常窖池窖泥,这与郭壮等[15,24]的研究结果相似,说明窖泥经过长时间的积累、退化后,其细菌菌群的多样性和丰度均会显著提升。随着窖泥位置深度的增加,OTU数、ACE指数均呈下降趋势。退化窖池窖泥与正常窖池窖泥都是上层(A1、B1)物种丰度(ACE指数、Chao1指数)和多样性(Shannon指数)明显高于其他位置,这可能是由于上层接触空气多,更利于环境微生物的吸附和生长。而退化窖池的窖泥样品A2多样性明显低于其他位置,结合理化分析结果可知,中层窖泥可能退化更明显。
2.3 窖泥样品细菌群落β-多样性分析结果
2.3.1 基于门水平窖泥样品细菌群落组成
基于OTU注释,所有窖泥样品中共检测到33个细菌门和1个古菌门(广古菌门(Euryarchaeota)),不同窖泥样品中的细菌菌群结构见图3。
由图3可知,退化窖池窖泥中有7个优势细菌门(退化窖池窖泥样品平均相对丰度>1%),分别为厚壁菌门(Fir micutes)(64.32%)、拟杆菌门(Bacteroidetes)(12.58%)、变形菌门(Proteobacteria)(9.66%)、放线菌门(Actinobacteria)(2.90%)、互养菌门(Synergistetes)(2.52%)、酸杆菌门(Acidobacteria)(2.11%)、绿弯菌门(Chloroflexi)(1.33%)。正常窖池窖泥中有5个优势细菌门,分别为厚壁菌门(Firmicutes)(67.14%)、拟杆菌门(Bacteroidetes)(26.40%)、变形菌门(Proteobacteria)(2.55%)、放线菌门(Actinobacteria)(1.35%)、互养菌门(Synergistetes)(1.29%)。与已报告的浓香型白酒窖泥中的优势细菌门种类相似[24-27],但本研究中Actinobacteria和Synergistetes在陶融型白酒窖泥中的平均相对丰度略高。

图3 基于门水平窖泥样品细菌菌群结构分析结果Fig. 3 Analysis results of bacterial community structure in pit mud samples based on phylum level
两种窖池窖泥的共有优势细菌门为Firmicutes、Bacteroidetes、Proteobacteria、Actinobacteria、Synergistetes。退化窖池窖泥的Firmicutes和Bacteroidetes的平均相对丰度明显低于正常窖池窖泥,而Proteobacteria、Actinobacteria、Synergistetes、Acidobacteria、Chloroflexi的平均相对丰度与之相反。由此可见,随着窖泥质量的提升,厚壁菌门所占比例有所增大,变形菌门所占比例有所下降,这与吴树坤等[28]的研究结果一致。两种窖池窖泥样品的细菌群落中,都是Firmicutes占主导地位,这类细菌大多数能够产生内生孢子抵抗极端环境,与郭壮等[15,19]的研究结果一致。
从窖池空间位置分析,退化窖池窖泥在门水平上的细菌群落组成具有空间异质性,其中Firmicutes(22.8%~90.6%)随窖池深度的增加均呈先增加后下降的趋势,样品A1中相对丰度最低,由此可知,上层窖泥也有一定程度退化;而Bacteroidetes(4.8%~49.6%)变化规律与之相反,样品A2中相对丰度最低,进一步说明中部窖泥可能退化较明显。
2.3.2 基于属水平窖泥样品细菌群落组成
在属水平,所有样品中共检测到480个可鉴定属及未分类的属,选取每个样品中的优势细菌属(相对丰度>1%),共计59个属进行菌群结构分析,结果见图4。
由图4可知,退化窖池窖泥有9个优势细菌属(退化窖池窖泥样品平均相对丰度>1%),分别为乳杆菌属(Lactobacillus)(21.24%)、嗜蛋白菌属(Proteiniphilum)(6.60%)、氢孢菌属(Hydrogenispora)(3.33%)、己酸菌属(Caproicipro ducens)(3.03%)、氨基酸杆菌属(Aminobacterium)(2.39%)、Syntrophaceticus(2.00%)、类香味菌属(Myroides)(1.53%)、棒状杆菌属(Caldicoprobacter)(1.06%)、Fermentimonas(1.01%);正常窖池窖泥有14个优势细菌属,分别为嗜蛋白菌属(Proteiniphilum)(18.85%)、己酸菌属(Caproicipro-ducens)(11.89%)、佩特里单胞菌属(Petrimonas)(6.23%)、消化链球菌属(Sedimentibacter)(5.31%)、Tepidimicrobium(4.15%)、棒状杆菌属(Caldicoprobacter)(3.06%)、Lutispora(2.77%)、互营单胞菌属(Syntrophomonas)(2.76%)、泰氏菌属(Tissierella)(2.10%)、乳杆菌属(Lactobacillus)(1.98%)、氢孢菌属(Hydrogenispora)(1.70%)、氨基酸杆菌属(Aminobacterium)(1.25%)、梭状芽孢杆菌属(Clostridium)(1.16%)、Christensenellaceae_R-7_group(1.03%)。

图4 基于属水平窖泥样品细菌菌群结构分析结果Fig. 4 Analysis results of bacterial community structure in pit mud samples based on genus level
两种窖池窖泥的共有优势细菌属为Lactobacillus、Proteiniphilum、Caproiciproducens、Hydrogenispora、Aminobacterium、Caldicoprobacter,从窖泥质量来看,退化窖池窖泥中主要优势细菌属(8个样品中总平均相对丰度>1%)乳杆菌属、氨基酸杆菌属、氢孢菌属的平均相对丰度高于正常窖池窖泥,而己酸菌属、嗜蛋白菌属、棒状杆菌属的平均相对丰度低于正常窖池窖泥。有研究发现,随着窖泥质量的提升,乳杆菌属含量显著减少,而己酸菌属等核心属的含量明显增加;菌群变化表现为:以乳杆菌属为单一优势属逐渐过渡到以己酸菌属为主,其他老熟窖泥指示菌如互营单胞菌属、甲烷杆菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)等的相对丰度逐渐增加[13,25,29],这与本研究中窖泥群落的变化基本相符。
从空间位置上看,退化窖池窖泥中Lactobacillus在样品A2中的相对丰度>样品A1>样品A3,其在样品A4中不是优势细菌属;Proteiniphilum在样品A4中的相对丰度最高,在样品A1中不是优势细菌属;Caproiciproducens在样品A3相对丰度最高,在样品A1和A4中不是优势细菌属;Aminobacterium在样品A4中的相对丰度>样品A3>样品A2,分布较均匀,其在样品A1中不是优势细菌属。正常窖池窖泥中Lactobacillus只在样品B1中是优势细菌属;Caproiciproducens在4个样品中都是优势细菌属,在样品中的相对丰度为样品B3>样品B2>样品B1>样品B4;Proteiniphilum在样品B4中的相对丰度最高,样品B1>样品B2>样品B3;Petrimonas在样品中的相对丰度为样品B4>样品B1>样品B2>样品B3。由此可见,不同位置的窖泥样品中细菌群落结构存在较大差异,张明珠等[25,30-31]对浓香型白酒窖泥的研究也发现明显的空间异质性。
2.4 基于OTU不同窖池窖泥细菌群落结构的聚类分析
进一步采用基于OTU数据计算所得的Jaccard距离的主坐标分析和非加权组UPGMA对窖泥样品的β多样性进行揭示,主坐标分析结果见图5。

图5 基于操作分类单元非加权Jaccard距离的主坐标分析Fig. 5 Principal coordinate analysis of OTUs based on unweighted Jaccard distance
由图5可知,PC1的方差贡献率为44.96%,PC2的方差贡献率为18.63%,累计方差贡献率为63.59%,说明这两个主成分可以解释63.59%的信息。正常窖池窖泥样品分布在第一象限,而退化窖池窖泥样品分布在二、三、四象限。由此可见,正常窖池窖泥和退化窖池窖泥样品在空间排布上呈现出明显的区分,说明这两种窖泥细菌群落可能存在较大差异。为了对这一结果进行验证,进一步采用UPGMA对两种窖泥样品的细菌群落结构进行分析,结果见图6。
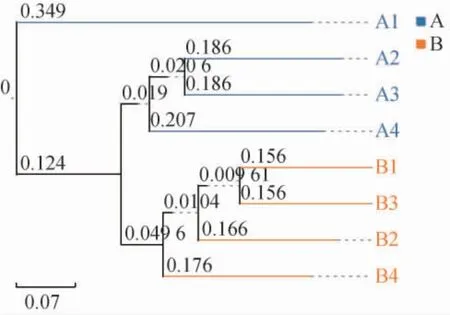
图6 基于操作分类单元非加权Jaccard距离的UPGMA聚类分析Fig. 6 UPGMA clustering analysis of OTUs based on unweighted Jaccard distance
由图6可知,退化窖池窖泥样品A1与其他位置的物种组成差异最大,样品A2和A3物种组成最相似,与窖底泥有一定差异性;正常窖池窖泥样品B1和B3物种组成最相似,与样品B2和B4也有一定差异性。由此可见,两种窖池窖泥样品的细菌群落结构具有差异性,且同一窖池中的窖泥存在空间异质性。
2.5 窖泥理化因子与主要优势细菌属相对丰度的冗余分析
如前所述,空间位置及质量对供试窖泥细菌群落的α-及β-多样性有一定的影响,分析原因可能是,不同位置和不同质量窖泥的理化性质存在差异,是影响微生物群落多样性改变的本质因素[13]。因此,对窖泥样品的理化性质与主要优势细菌属(8个样品中总平均相对丰度>1%)总平均相对丰度之间的相关性进行冗余分析,结果见图7。图中,箭头的长度代表相关性的大小,中心点和窖泥菌群之间的连线与箭头的夹角为锐角表示窖泥优势菌属与相应的理化因子呈正相关,钝角表示负相关[32]。

图7 窖泥理化因子与主要优势细菌属平均相对丰度间的冗余分析结果Fig. 7 Redundancy analysis results between physicochemical factors and average relative abundance of main dominant bacterial genera of pit mud
由图7可知,两个主成分对两者相关性的总解释度为77.24%,且主要集中在Axis1轴上,可将正常窖池窖泥和退化窖池窖泥样品较好的区分开,其中正常窖池窖泥样品只分布在第四象限,退化窖池窖泥样品主要分布在第四象限之外的位置。Axis2轴可以将退化窖池窖泥样品的上部(A1、A2)和下部(A3、A4)区分开。但对主要优势细菌属菌群结构的影响是多个理化因子的综合作用,如正常窖池窖泥样品B1、B3、B4与pH值、含水量和有效磷含量呈正相关,样品B2与pH值、含水量和铵态氮含量呈正相关;退化窖池窖泥中样品A1与pH值、含水量和铵态氮含量呈负相关,样品A2、A3和A4与总酸和有效磷含量呈正相关。条件限制性分析结果显示,有效磷含量(40.5%)和总酸含量(28.5%)对主要细菌属影响较大,然后依次为铵态氮含量(9.6%)>pH值(8.2%)>含水量(4.5%),且只有有效磷含量与主要优势细菌属菌群结构呈显著相关(P<0.05),其他因子均不具有显著性(P>0.05)。此外,有研究表明,总酸与退化窖泥或者新窖泥的菌群呈强烈正相关[13,33],氨态氮、总氮、有效磷含量对微生物群落的影响最大[19]。综上,有效磷、总酸和铵态氮含量可能是影响不同质量窖泥细菌菌群在空间分布的主要理化因子。
3 结论
本研究对陶融型白酒退化窖池和正常窖池中窖泥的理化指标进行测定,结果表明,退化窖池窖泥的含水量(36.78%)、pH值(5.50)及铵态氮含量(23.48 mg/100 g)均低于正常窖池,而总酸含量(13.00 mg/g)和有效磷含量(27.32 mg/100 g)与之相反。通过高通量测序技术解析其细菌群落多样性,结果表明,窖泥中细菌群落存在明显的空间异质性。与正常窖池窖泥相比,退化窖池窖泥中主要优势细菌门厚壁菌门(Firmicutes)(64.32%)、拟杆菌门(Bacteroidetes)(12.58%)以及优势细菌属己酸菌属(Caproiciproducens)(3.03%)、嗜蛋白菌属(Proteiniphilum)(6.60%)、棒状杆菌属(Caldicoprobacter)(1.06%)、消化链球菌属(Sedimentibacter)(0.63%)、Lutispora(0.78%)、互营单胞菌属(Syntrophomonas)(0.68%)、泰氏菌属(Tissierella)(0.57%)、佩特里单胞菌属(Petrimonas)(0.91%)的平均相对丰度较低。通过RDA对影响微生物群落的主要理化因素进行分析,结果发现,有效磷、总酸和铵态氮含量可能是影响不同质量窖泥细菌菌群在空间分布的主要理化因子。本研究在一定程度上增加了人们对陶融型白酒正常窖池窖泥和退化窖池窖泥细菌群落的认识,说明了窖泥细菌群落具有明显空间异质性,对识别退化窖泥及人工窖泥的研制和促进白酒风味形成等可能具有一定的积极作用。

