猪乙型脑炎病毒的分离及鉴定
邵攀峰 尹忠良 孙庆霞 李少丽 朱国坡
(杭州佑本动物疫苗有限公司,浙江杭州 310018)
流行性乙型脑炎(Epidemic encephalitis),又称日本脑炎病毒(Japanese encephalitis virus,JVE ),简称乙脑,是由黄病毒科(Flaviridae)黄病毒属乙型脑炎病毒而引起的一种严重威胁人畜健康的急性中枢神经系统传染病大多数动物成隐性感染,病毒通常在蚊-猪-蚊等动物间循环,猪被认为是JEV最重要的自然增殖动物[1]。猪还是JEV的重要贮存宿主和传染源,人的感染大多是猪群感染JEV经蚊传播而引致的[2]。我国对JEV的研究大多集中在人源和蚊源株,对猪源JEV的报道较少[3]。因此,加大对猪源乙型脑炎病毒研究不仅有利于猪传染病防控,而且对人类乙型脑炎病的防控也具有重要的公共卫生意义。
本研究采集疑似猪乙型脑炎发病养猪场流产胎儿病料组织,取RT-PCR检测阳性样品,经过在BHK-21细胞继代培养、病毒含量测定、病毒中和试验、小鼠致死量测定等试验研究,最终确定分离获得1株猪乙型脑炎病毒,现将研究情况报告如下。
1 材料
1.1 病料
采集妊娠母猪流产胎儿脑组织样品6份,-70℃冻存备用。
1.2 细胞及血清
BHK-21细胞、猪乙型脑炎特异性阳性血清均由杭州佑本动物疫苗有限公司制备和保存。
1.3 主要试剂
DMEM培养基和胎牛血清(FBS)购自GIBCO公司;Mini BEST Viral RNA/DNA Extraction Kit、反转录试剂 盒(RNA PCRKit(AMV)Ver.3.0)、DNA Marker、10×PCR Buffer、Taq 酶、dNTP 等均购自宝生物工程(大连)有限公司。
2 方法
2.1 病毒分离
取流产胎儿病料组织,用无菌生理盐水按1:5(W/V)比例匀浆后制成悬液,反复冻融3次,经5000rpm离心5min,取上清、过滤除菌后-70℃ 冻存,备用。
对流产胎儿病料组织样品用MiniBEST Viral RNA/DNA Extraction Kit和RNA PCRKit(AMV)Ver.3.0)试剂盒进行核酸提取及反转录。利用本实验室建立的猪病PCR检测方法进行猪繁殖与呼吸障碍综合征病毒、猪伪狂犬病病毒、猪细小病毒和猪乙型脑炎病毒筛查。检测猪乙型脑炎病毒特异性引物 P1 5’-GCATCCCAAGCGAAGCAGGAGCC-3’,下游引物 P2 5’-AGCGTCCAATGTTGGTTTGTCG-3’,目的条带 463 bp(E基因部分保守片断),进行RT-PCR扩增。扩增产物在1%琼脂糖凝胶电泳,紫外凝胶成像仪下观察结果。
2.2 病毒细胞培养
将猪乙型脑炎病毒RT-PCR检测为阳性的组织样品按1.5% 比例接种到BHK-21细胞上,35 ℃ 吸附60 min,补加入维持液,置35 ℃,5% CO2培养。在显微镜下观察BHK-21细胞CPE,培养至96 h或细胞病变达75%左右时将培养物反复冻融3次收获,连续继代培养,观察乙脑病毒对BHK-21细胞的病变情况。
2.3 病毒含量的测定
取病毒液用含2% 新生牛血清的DMEM培养液作10倍系列稀释,取10-1~10-7稀释度,每个稀释度接种6孔细胞培养板上已长成良好单层的BHK-21细胞4孔,0.4ml/孔;同时设不接毒的正常细胞对照组。将细胞培养板置37℃、5% CO2条件下吸附90min,吸附结束后弃去细胞培养板中液体,再每孔加入含1% 甲基纤维素的2% 新生牛血清DMEM培养液4.0ml,继续置35℃、5%CO2条件下培养5日,然后弃去细胞培养板中液体,每孔加入固定液(含2.5%重铬酸钾以及5% 冰醋酸的5% 福尔马林溶液)2.0ml室温处理30min,弃去细胞培养板中液体,再每孔加入1% 结晶紫染色工作液2.0ml室温染色20min,弃去结晶紫染色液并用PBS缓冲液(0.015mol/L,pH7.4~7.6)轻轻冲洗3次晾干,当细胞对照无蚀斑出现时进行蚀斑计数,选取每孔蚀斑数在10~100之间的稀释度为基准计算病毒含量(PFU/ml)。
2.4 病毒中和试验
将病毒液用含2% 新生牛血清的DMEM培养液稀释至200PFU/0.4ml,与等量乙型脑炎病毒阳性血清混合后,置37℃中和90min,接种6孔细胞培养板上已长成良好单层的BHK-21细胞4孔,0.4ml/孔;同时设病毒对照孔4孔,每孔接种同条件处理的病毒与含2% 新生牛血清的DMEM培养液混合液0.4ml;正常细胞对照孔4孔,每孔加入含2% 新生牛血清的DMEM培养液0.4ml。将细胞培养板置37℃、5% CO2条件下吸附90分钟,吸附结束后弃去细胞培养板中液体,再每孔加入含1% 甲基纤维素的2% 新生牛血清DMEM培养液4.0ml,继续置35℃、5% CO2条件下培养5日,然后弃去细胞培养板中液体,每孔加入固定液(含2.5%重铬酸钾以及5% 冰醋酸的5% 福尔马林溶液)2.0ml室温处理30min,弃去细胞培养板中液体,再每孔加入1% 结晶紫染色工作液2.0ml室温染色20min,弃去结晶紫染色液并用PBS缓冲液(0.015mol/L,pH 7.4~7.6)轻轻冲洗3次,晾干后用于进行蚀斑观察。
2.5 小鼠致病力试验
将病毒液用DMEM培养液作10倍系列稀释,取10-5、10-6、10-7这3个适宜稀释度,每个稀释度腹腔接种11~13g SPF小鼠5只,0.3ml/只。观察14日,记录各组小鼠死亡数量,按Reed-Muench法计算LD50。
3 结果与分析
3.1 病毒分离
进行猪繁殖与呼吸障碍综合征病毒、猪伪狂犬病病毒、猪细小病毒和猪乙型脑炎病毒核酸物质PCR检测,结果表明,6份样品中猪繁殖与呼吸障碍综合征病毒、猪伪狂犬病病毒、猪细小病毒的病原PCR检测结果均为阴性。6份样品进行乙型脑炎病毒RT-PCR检测,有1份样品扩增出明显条带,有2份样品扩增条带亮度微弱,扩增出目的条带大小相符(463 bp),而阴性对照无条带(图1)。

图1 猪乙型脑炎病毒RT-PCR结果
3.2 病毒细胞培养
RT-PCR检测猪乙型脑炎病毒阳性的3份病料组织样品,接种BHK-21细胞,并进行连续继代培养,显微镜下观察BHK-21细胞病变,结果表明,只有1号样品能造成BHK-21细胞明显而稳定的细胞病变,将1号样品命名为JEV(A6株)。
3.3 病毒含量的测定
JEV(A6株)经过在BHK-21细胞进行连续传代,结果表明,随着病毒在细胞传代适应,病毒含量不断提高,病毒含量可达到106.6PFU/ml。(表1)
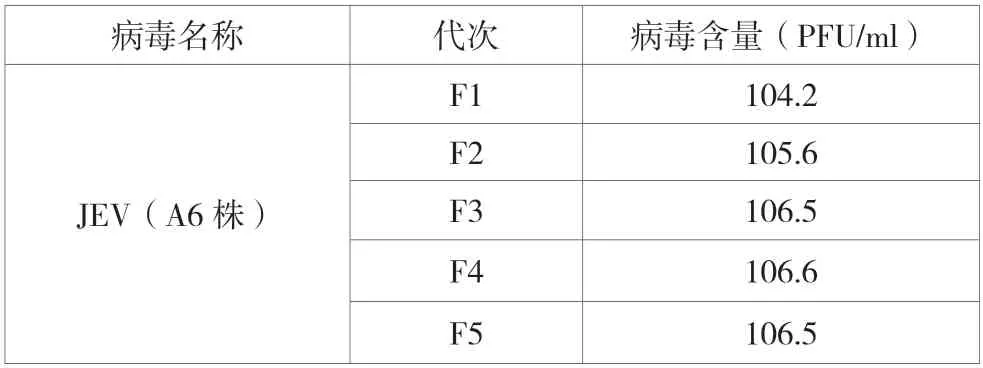
表1 不同代次猪乙型脑炎病毒含量测定结果
3.4 病毒中和试验
将病毒液用含2% 新生牛血清的DMEM培养液稀释至200PFU/0.4ml,与等量乙型脑炎病毒阳性血清混合后接种BHK-21细胞。结果表明,JEV(A6株)病毒对照孔4/4出现CPE;JEV(A6株)与乙型脑炎病毒阳性血清中和均未出现CPE孔;正常细胞对照孔4/4未出现CPE,结果表明JEV(A6株)能够被乙型脑炎病毒阳性血清特异性中和。
3.5 小鼠致死量测定试验
攻毒后观察14日,记录各组小鼠死亡数量,按Reed-Muench法计算LD50(表2)。结果表明,JEV(A6株)能引起小鼠表现有痉挛、战栗、肢体麻痹等脑炎典型发病症状,并且可以造成死亡。
4 讨论
乙型脑炎病的研究大多集中在人源和蚊源,然而猪被认为是JEV最重要的自然增殖动物[1]。猪还是JEV的重要贮存宿主和传染源,病毒通常在蚊-猪-蚊等动物间循环。目前国内猪乙型脑炎病防控只有猪乙型脑炎活疫苗(SA14-14-2株)在售,并且乙型脑炎病毒(SA14-14-2株)也一直用于人乙型脑炎病的防控,存在的生物安全风险值得思考。虽然目前猪乙型脑炎活疫苗(SA14-14-2株)在猪的应用上安全、有效,但是研制开发动物专用乙型脑炎疫苗,丰富动物用乙型脑炎疫苗类别比如猪乙型脑炎灭活疫苗和基因工程疫苗的研发与应用,这样更有利于乙型脑炎病的长期防控和净化。
本研究从猪乙型脑炎发病养猪场流产胎儿病料分离获得1株猪乙型脑炎病毒JEV(A6株)。JEV(A6株)能够在BHK -21细胞上稳定增殖产生细胞病变,经过连续传代培养后病毒含量可达到106.6PFU/ml。JEV(A6株)能引起小鼠表现有痉挛、战栗、肢体麻痹等脑炎典型发病症状,并且可以造成死亡。本研究为进一步开展猪乙型脑炎灭活疫苗及相关研究奠定了基础。

