复方苦参注射液通过增强细胞免疫杀伤作用诱导宫颈癌海拉细胞凋亡
高爱春
宫颈癌是全球女性中第3 个常见的恶性肿瘤, 仅次于乳腺癌和结直肠癌,也是癌症死亡的第4 大原因[1]。目前由于晚期诊断,宫颈癌病人的预后仍然不能令人满意[2]。因此,对于宫颈癌迫切需要寻找新的治疗策略。随着生物疗法的提出及应用,在癌症治疗上取得了一定的进展。生物疗法又称细胞免疫疗法,是利用无毒副作用的天然物质,一方面直接抑制癌细胞增殖,阻止肿瘤的生长;另一方面,激活大量的免疫细胞,靶向攻击肿瘤细胞,诱导肿瘤细胞凋亡,最终达到治疗肿瘤的目的[3]。复方苦参注射液是一种具有广谱抗肿瘤的、广泛应用于临床的中药制剂,目前研究显示,其可减轻宫颈癌病人放化疗的毒副作用[4]。复方苦参注射液能够直接杀伤肿瘤细胞,而且能够增强机体免疫功能,对宫颈癌等恶性肿瘤的治疗具有良好的应用前景[5-6]。但复方苦参注射液对宫颈癌细胞凋亡的研究目前鲜有报道。人白细胞抗原G(HLA-G)由人白细胞抗原(HLA)家族基因编码,目前多项研究证实,HLA-G在多种恶性肿瘤中异常表达,与病人的预后不良和对免疫疗法的抗性相关[7-9]。HLA-G 基因的过表达能够促进宫颈癌细胞增殖、侵袭和迁移,阻碍细胞凋亡,促进宫颈癌进展[10]。因此本实验于2018 年7月至2019 年8 月以复方苦参注射液处理人宫颈癌海拉细胞,探讨其对海拉细胞凋亡的影响以及对HLA-G基因表达调控作用。
1 材料与方法
1.1 材料人宫颈癌海拉细胞(美国ATCC 公司);RPMI-1640 培养基、胰蛋白酶(美国HyClone 公司);复方苦参注射液(山西振东集团金晶制药有限公司);人胆囊收缩素/缩胆囊素八肽(CCK-8)试剂(美国Sigma 公司);胎牛血清(杭州四季青生物工程材料有限公司);Trizol 提取试剂盒、逆转录试剂盒、荧光定量PCR 检测试剂盒(日本TaKaRa 公司);凋亡检测试剂盒(南京建成生物工程研究所);二喹啉甲酸(BCA)蛋白浓度检测试剂盒(碧云天生物技术研究所);聚偏二氟乙烯(PVDF)膜(美国Abcam 公司);电化学发光法(ECL)检测试剂盒(北京百泰克生物技术有限公司);转化生长因子β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)和白细胞介素-4(IL-4)试剂盒(北京雅安达生物技术有限公司);B 细胞淋巴瘤-2(Bcl-2)抗体、Bcl-2 相关X 蛋白(Bax)抗体、活化胱天蛋白酶-3(cleaved-caspase-3)抗体、HLA-G 抗体和二抗(美国CST公司)。
1.2 细胞培养人宫颈癌海拉细胞接种于含10%胎牛血清RPMI-1640 培养基的培养瓶中,置5%二氧化碳、37 ℃培养箱中培养,每天观察细胞生长状态,及时更换新鲜的培养基,待细胞生长密度达90%时,将细胞用0.25%的胰蛋白酶消化,进行传达培养,取对数生长期的海拉细胞进行后续实验。
1.3 实验分组实验设为四组,每组设置3 个复孔,分别为0、100、200、500 mL/L 复方苦参注射液组(浓度梯度设定根据预实验结果)。将对数增殖期的海拉细胞接种于96 孔板中,置37 ℃培养箱中继续培养,24 h 后弃去原培养基,其中0 mL/L 复方苦参注射液组加入含等体积的二甲基亚砜的培养基,其余各组分别加入含终浓度为100、200、500 mL/L复方苦参注射液的培养基。将各组海拉细胞置37 ℃培养箱中继续培养48 h。
1.4 CCK-8法检测各组海拉细胞干预48 h后,分别向每孔细胞中加入10 μL CCK-8 试剂,轻轻混匀,置37 ℃培养箱中继续孵育4 h,用酶标仪检测每孔细胞吸光度,波长为450 nm。实验重复3 次,取均值,以测得的吸光度反映细胞增殖能力。
1.5 平板克隆形成实验各组处于对数生长期的海拉细胞以200/皿接种于60 mm 的培养皿中,于37 ℃培养箱中培养14 d 左右,皿中出现肉眼可见的细胞克隆时终止培养,除去培养上清液,以磷酸缓冲盐溶液(PBS)浸洗2 次,用多聚甲醛(40 g/L)固定15 min,然后使用Giemsa 染色15 min,洗去染液,空气中干燥,在倒置显微镜下观察并计数≥50 个细胞克隆数,计算克隆形成率,克隆形成率=(克隆形成数/200)×100%。

图1 流式细胞仪检测不同浓度复方苦参注射液干预组宫颈癌海拉细胞凋亡情况
1.6 流式细胞术检测细胞周期各组海拉细胞处理48 h后,收集并以0.25%的胰蛋白酶消化细胞,用PBS 洗涤细胞2次,离心去上清,调整细胞浓度为1×106个/毫升,向细胞中添加碘化丙啶(PI)染液,置冰上避光染色30 min,加入等体积的PBS,使用流式细胞仪检测各组细胞周期比例。
1.7 流式细胞术检测细胞凋亡收集处理48 h 后各组海拉细胞,用不含乙二胺四乙酸的0.25%的胰蛋白酶消化细胞,用预冷的PBS洗涤细胞,离心弃上清,分别向各组细胞中添加结合缓冲液500 μL,制成1×106个/毫升的单细胞悬液,再依次加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和PI 各5 μL,避光反应15 min,1 h内上流式细胞仪检测。
1.8 酶联免疫吸附测定(ELISA)检测不同浓度的复方苦参注射液干预海拉细胞48 h 后,收集细胞培养上清液,采用ELISA 检测上清液中TGF-β1、TNF-α 和IL-4 含量。参照ELISA 说明书进行实验操作,后续在酶标仪450 nm 波长处检测,实验重复3次,计算样品中TGF-β1、TNF-α和IL-4含量。
1.9 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测海拉细胞经不同浓度的复方苦参注射液干预48 h 后,收集细胞,以Trizol 提取细胞中总RNA,使用逆转录试剂盒合成互补DNA(cDNA),调整cDNA 浓度,使用荧光定量PCR 检测试剂盒进行扩增,反应条件为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火20 s,72 ℃延伸15 s,共40个循环。反应结束后分析熔炼曲线,得出Ct 值,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用2-ΔΔCt法计算各组海拉细胞中HLA-G mRNA 相对表达水平。HLA-G 引物:正向5’-GAGGAGACACGGAACACCAAG-3’;反向5’-GTCGCAGCCAATCATCCACT-3’。GAPDH引物:正 向5’-GTGAAGCAGGCGTCGGA-3’;反 向5’-AGCCCCAGCGTCAAAGG-3’。
1.10 蛋白质印迹法检测不同浓度的复方苦参注射液干预海拉细胞48 h 后,分别收集各组细胞,添加细胞裂解液,冰上裂解30 min,离心提取细胞中总蛋白。采用BCA 法对蛋白定量后,蛋白样品与加样缓冲液按比例混合,加热致蛋白变性,采用100 g/L的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后采用湿转法将凝胶上的蛋白转移至PVDF 膜上。在50 g/L 脱脂奶粉中封闭1 h,添加一抗(抗Bax 1∶500稀释,抗Bcl-2 1∶500稀释,抗cleaved-caspase-3 1∶800 稀释,抗HLA-G 1∶500 稀释),4 ℃过夜孵育。等渗缓冲盐溶液(TBST)洗膜15 min×3次,加入二抗1∶3 000 稀释,室温孵育1 h,TBST 洗膜15 min×3 次,化学发光,显影,定影,以凝胶成像系统扫描拍照。以GAPDH 进行标定,采用Image J 软件分析各蛋白条带灰度值,计算各组细胞中目的蛋白表达水平。
1.11 统计学方法计量数据均以± s 表示,以软件SPSS 21.0进行统计,采用单因素方差分析比较多组间差异,多组间的两两比较采用SNK-q 检验,P<0.05表示差异有统计学意义。
2 结果
2.1 复方苦参注射液对人宫颈癌海拉细胞增殖抑制的影响与0 mL/L 复方苦参注射液组比较,各复方苦参注射干预组细胞吸光度均降低(P<0.05),克隆形成率明显下降(P<0.05),且具有剂量依赖性(P<0.05)。提示复方苦参注射可明显抑制宫颈癌海拉细胞的增殖。见表1。
2.2 复方苦参注射液可阻滞海拉细胞周期进程与0 mL/L比,100、200、500 mL/L组G0/G1期细胞比例明显升高,S 期细胞比例明显降低(P<0.05),G2/M 期细胞比例无变化(P>0.05)。提示复方苦参注射液能够阻滞宫颈癌海拉细胞周期进程。见表2。
2.3 复方苦参注射液可诱导海拉细胞凋亡0、100、200、500 mL/L 复方苦参注射液组细胞凋亡率分 别 为(6.02±0.35)% 、(14.38±1.06)% 、(20.62±1.57)%、(31.84±2.11)%(F=173.96,P<0.001);与0mL/L 比,100、200、500 mL/L 组细胞凋亡率升高(P<0.05),且随浓度的升高而升高(P<0.05)。提示复方苦参注射液能够呈浓度依赖性的诱导宫颈癌海拉细胞凋亡。见图1。
表1 不同浓度复方苦参注射液干预组对人宫颈癌海拉细胞增殖的影响/± s

表1 不同浓度复方苦参注射液干预组对人宫颈癌海拉细胞增殖的影响/± s
注:①与0 mL/L 比,P<0.05。②与100 mL/L 比,P<0.05。③与200 mL/L比,P<0.05。
组别0 mL/L 100 mL/L 200 mL/L 500 mL/L F值P值重复次数3 3 3 3吸光度2.43±0.11 1.97±0.08①1.41±0.08①②0.92±0.04①②③205.65<0.001克隆形成率/%40.26±3.12 33.97±2.06①27.42±2.18①②19.84±2.03①②③40.44<0.001
表2 不同浓度复方苦参注射液干预组对宫颈癌海拉细胞周期的影响/± s

表2 不同浓度复方苦参注射液干预组对宫颈癌海拉细胞周期的影响/± s
注:①与0 mL/L 比,P<0.05。②与100 mL/L 比,P<0.05。③与200 mL/L比,P<0.05。
组别0 mL/L 100 mL/L 200 mL/L 500 mL/L F值P值重复次数3 3 3 3 G0/G1期69.02±2.06 75.98±2.13①80.24±2.07①②86.21±2.42①②③33.33<0.001 S期23.86±1.17 19.33±1.02①13.49±0.88①②7.21±0.82①②③162.94<0.001 G2/M期7.12±0.61 6.69±0.79 6.27±0.71 6.58±0.69 0.75 0.551
2.4 复方苦参注射液对海拉细胞中Bax、Bcl-2 和cleaved-caspase-3 蛋白表达的影响与0 mL/L 比,复方苦参注射液处理的海拉细胞中Bax 和cleavedcaspase-3 蛋白表达水平上调(P<0.05),Bcl-2 蛋白表达水平下调(P<0.05),且具有剂量依赖性(P<0.05)。表明复方苦参注射液可诱导Bax 蛋白表达,激活胱天蛋白酶(caspase)-3蛋白,抑制Bcl-2蛋白表达。见图2,表3。
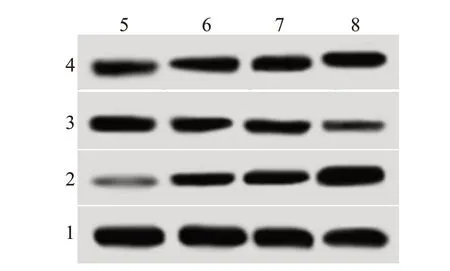
图2 蛋白质印迹法检测不同浓度复方苦参注射液干预组海拉细胞中Bax、Bcl-2和cleaved-caspase-3蛋白水平
表3 不同浓度复方苦参注射液干预组海拉细胞中Bax、Bcl-2和cleaved-caspase-3蛋白水平比较/± s
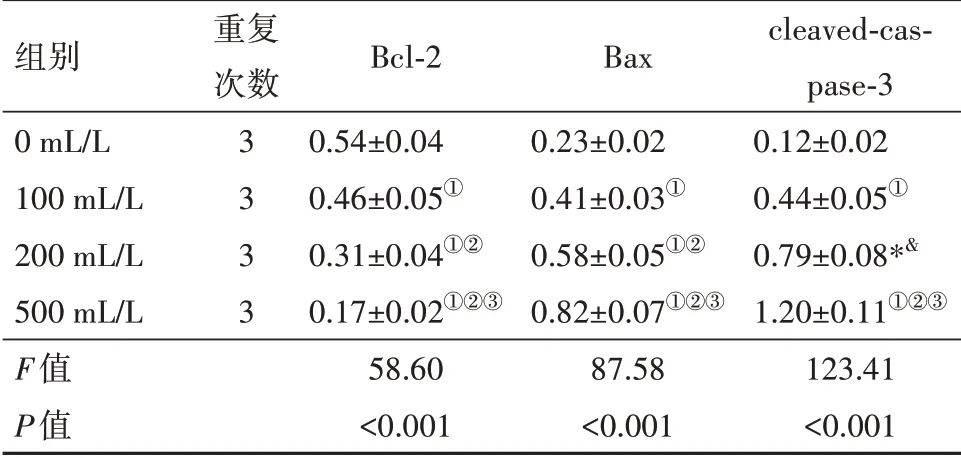
表3 不同浓度复方苦参注射液干预组海拉细胞中Bax、Bcl-2和cleaved-caspase-3蛋白水平比较/± s
注:Bcl-2 为B 细胞淋巴瘤-2,Bax 为Bcl-2 相关X 蛋白,cleavedcaspase-3为活化胱天蛋白酶-3。①与0 mL/L 比,P<0.05。②与100 mL/L 比,P<0.05。③与200 mL/L比,P<0.05。
组别0 mL/L 100 mL/L 200 mL/L 500 mL/L F值P值重复次数3333 Bcl-2 0.54±0.04 0.46±0.05①0.31±0.04①②0.17±0.02①②③58.60<0.001 Bax 0.23±0.02 0.41±0.03①0.58±0.05①②0.82±0.07①②③87.58<0.001 cleaved-caspase-3 0.12±0.02 0.44±0.05①0.79±0.08*&1.20±0.11①②③123.41<0.001
2.5 复方苦参注射液对培养上清液中TGF-β1、TNF-α和IL-4含量的影响与0 mL/L 比,复方苦参注射液处理的海拉细胞上清液中TGF-β1 和IL-4 含量明显降低(P<0.05),TNF-α 含量明显升高(P<0.05)。提示复方苦参注射液可抑制细胞分泌TGFβ1和IL-4,促进TNF-α的分泌。见表4。
表4 不同浓度复方苦参注射液干预组海拉细胞培养上清液中TGF-β1、TNF-α和IL-4含量比较/± s
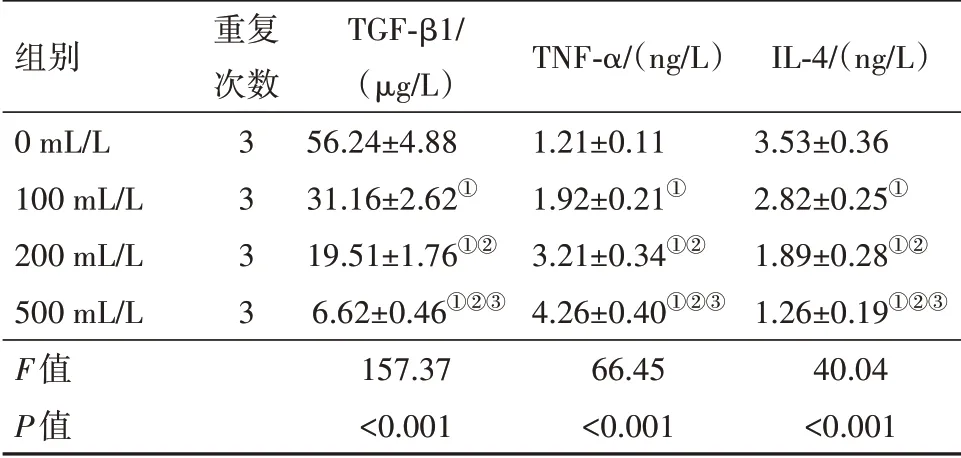
表4 不同浓度复方苦参注射液干预组海拉细胞培养上清液中TGF-β1、TNF-α和IL-4含量比较/± s
注:TGF-β1为转化生长因子β1,TNF-α 为肿瘤坏死因子-α,IL-4为白细胞介素-4。①与0 mL/L 比,P<0.05。②与100 mL/L 比,P<0.05。③与200 mL/L比,P<0.05。
组别0 mL/L 100 mL/L 200 mL/L 500 mL/L F值P值重复次数3333 TGF-β1/(μg/L)56.24±4.88 31.16±2.62①19.51±1.76①②6.62±0.46①②③157.37<0.001 TNF-α/(ng/L)1.21±0.11 1.92±0.21①3.21±0.34①②4.26±0.40①②③66.45<0.001 IL-4/(ng/L)3.53±0.36 2.82±0.25①1.89±0.28①②1.26±0.19①②③40.04<0.001
2.6 复方苦参注射液对海拉细胞中HLA-G 基因表达的影响与0 mL/L 比,复方苦参注射液处理的海拉细胞中HLA-G mRNA 和蛋白表达降低(P<0.05),且具有剂量依赖关系。说明复方苦参注射液能够抑制海拉细胞中HLA-G基因的表达。见图3,表5。
3 讨论

图3 蛋白质印迹法检测不同浓度复方苦参注射液干预组海拉细胞中HLA-G蛋白水平
表5 不同浓度复方苦参注射液干预组海拉细胞中人白细胞抗原G(HLA-G)mRNA和蛋白表达水平比较/± s
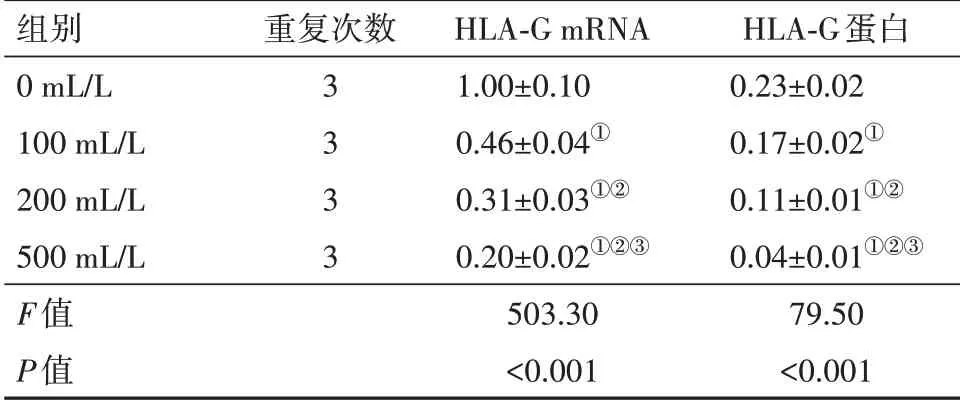
表5 不同浓度复方苦参注射液干预组海拉细胞中人白细胞抗原G(HLA-G)mRNA和蛋白表达水平比较/± s
注:①与0 mL/L 比,P<0.05。②与100 mL/L 比,P<0.05。③与200 mL/L比,P<0.05。
组别0 mL/L 100 mL/L 200 mL/L 500 mL/L F值P值重复次数3333 HLA-G mRNA 1.00±0.10 0.46±0.04①0.31±0.03①②0.20±0.02①②③503.30<0.001 HLA-G蛋白0.23±0.02 0.17±0.02①0.11±0.01①②0.04±0.01①②③79.50<0.001
复方苦参注射液具有多种抗癌活性成分,如苦参碱、脱氧苦参碱、氧化苦参碱及土茯苓等多种天然物质,具有抗癌、抗炎、清热利湿等多种药理学作用。近年来,复方苦参注射液诱导膀胱癌细胞、非小细胞肺癌细胞、肝癌等细胞凋亡的文献较多[11-13]。因此,复方苦参注射液已成为抗肿瘤药物的研究方向之一。本实验证实,复方苦参注射液能够抑制人宫颈癌海拉细胞的增殖,且呈剂量依赖性,阻滞细胞周期,诱导细胞凋亡。说明复方苦参注射液能够抑制海拉细胞增殖,诱导细胞凋亡,具有较好的抗宫颈癌的作用。细胞凋亡蛋白caspase-3 激活形式为cleaved-caspase-3,激活后执行凋亡功能,诱导细胞发生凋亡[14]。Bax 属于Bcl-2 基因家族中促凋亡基因,Bax 基因过表达能够拮抗Bcl-2 的表达,导致细胞趋于死亡[15]。本实验中复方苦参注射液干预的海拉细胞中caspase-3 激活增多,Bax 表达水平升高,Bcl-2 的表达水平下降,提示复方苦参注射液通过调控凋亡相关蛋白表达诱导海拉细胞发生凋亡。
多项研究证实,复方苦参注射液能够调节免疫细胞的表达,增强机体免疫功能,改善肿瘤微环境,间接抑制肿瘤细胞增殖,杀伤肿瘤细胞[16-17]。复方苦参注射液能够增强结肠癌、乳腺癌、宫颈癌等病人的免疫功能,延长病人生存时间[18-20]。报道指出,HLA-G 在肿瘤组织中呈高表达,且在相邻的正常组织中很少发现,这表明HLA-G 与肿瘤生长和进展关系密切[21-22]。多项证据表明肿瘤细胞中HLA-G的上调参与癌症免疫编辑的每个阶段,包括清除、平衡和逃避[23-24]。数据显示,HLA-G 在宫颈癌组织和细胞中呈高表达,发挥免疫耐受的作用[25]。本研究发现复方苦参注射液干预的宫颈癌海拉细胞中HLAG 表达水平下调,提示复方苦参注射液增强细胞免疫功能与抑制HLA-G基因的表达相关。
在肿瘤免疫中,复方苦参注射液可改善T 淋巴细胞亚群和自然杀伤细胞,在平衡Th1/Th2 细胞因子中发挥重要作用[26]。Th1 细胞主导机体免疫功能,TNF-α 主要由Th1 类细胞分泌,IL-4 主要由Th2类细胞分泌。有研究显示,HLA-G 与TNF-α、IL-4和IL-10 共同参与先兆子痫中存在的Th1/Th2 细胞因子失衡与缺乏免疫调节特征相关,导致母亲和胎儿之间的免疫耐受受损[27]。研究指出,阻断HLA-G 导致结核性胸腔积液中T细胞分泌的γ干扰素和TNFα 含量增加[28]。本实验检测结果显示,IL-4 含量明显降低,TNF-α 含量明显升高,提示淋巴细胞向Th1移动,说明复方苦参注射液通过抑制HLA-G 的表达逆转Th1/Th2 失衡增强细胞免疫功能,与上述研究相符。TGF-β1 是一种由活化的T 淋巴细胞或B 淋巴细胞产生的细胞生长转化调节因子,在肿瘤细胞中大量表达。目前报道显示,复方苦参注射液通过抑制TGF-β1 的表达抑制肿瘤细胞的增殖[29]。本实验中复方苦参注射液处理后,TGF-β1 含量降低,提示复方苦参注射液可能通过调控TGF-β1 的表达进而负调控HLA-G参与细胞免疫调节。
综上,复方苦参注射液能够有效诱导宫颈癌海拉细胞凋亡,其作用机制可能与抑制HLA-G 基因表达进而增强免疫细胞对肿瘤细胞的杀伤作用有关。复方苦参注射液成分复杂,究竟何种成分发挥主导作用需进一步实验进行论证,且目前只在单一细胞株中进行探究尚显不足,后续实验将在多个细胞株及动物模型中进一步验证。
(本文图1见插图9-2)

