PEDV变异株的分离鉴定和S1基因序列分析
张 江,马晶晶,高俊锋,韩相敏,吴汉宇,李凯亮,奉中花,赖 志
(1.上海农林职业技术学院,上海 松江 201699 ; 2. 上海创宏生物科技有限公司,上海 松江 201619)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)可引起猪流行性腹泻(Porcine epidemic diarrhea,PED),所有日龄的猪均易感,其中哺乳仔猪最易感,1周龄以内的仔猪感染后临床表现为呕吐和水样腹泻,3~4 d后因脱水而死,病死率平均可达50%,严重者接近100%,日龄较大的猪通常表现为一过性的水样腹泻,持续1周后可自行康复,母猪临床也有仅表现为发热、精神沉郁、乳汁减少和厌食的情况[1-2]。
猪流行性腹泻病毒属于冠状病毒科冠状病毒属,为带囊膜的单股正链RNA病毒,基因组大小约为28 000 bp。其中编码的S结构蛋白可以识别并结合宿主细胞受体,是产生中和抗体的主要靶标蛋白,与病毒入侵宿主细胞和毒力相关[3]。S蛋白是由S1(1~730 aa)亚基和 S2亚基(731~1 383 aa)共1 383个氨基酸组成,其中S1亚基与受体的结合有关,也是诱导产生中和抗体的主要区域。PEDVS基因是PEDV重要的毒力基因,不同毒株之间S1基因高度易变,表现为碱基突变、插入或缺失,其遗传变异性可造成PEDV毒力的改变[4-5],所以PEDV变异毒株和经典毒株的变异主要集中在S1区域,根据PEDVS1基因遗传进化树比对分析可将PEDV分为GⅠ和GⅡ两大分支,GⅠ分支主要由经典株G1和S-INDEL毒株组成,GⅡ分支主要由中国流行变异株G2b及美国、加拿大毒株G2a组成,可以通过对S1基因的鉴别诊断和测序分析判断PEDV属于经典株还是流行变异株,因此临床多以PEDVS1区域比对特征作为疫苗选择的理论依据[6]。
虽然国内发病猪场已经进行了PED疫苗的免疫,但PED仍持续发生且危害严重,说明现阶段仅通过使用疫苗还无法保证猪场的持续稳定,疫苗毒株对不断变异的新流行PEDV毒株存在保护力不足的情况[7-8]。本实验室于2021年7月在江苏某猪场因腹泻死亡的哺乳仔猪群的肠道中分离鉴定出2株PEDV,并对其S1基因进行了扩增和序列分析,希望获得流行毒株PEDV分子变异趋势,为进一步鉴别PEDV疫苗株和野毒株提供理论依据,为丰富PEDV的分子流行病学和疫苗研制提供参考。
1 材料与方法
1.1 细胞及主要试剂 Vero细胞,购自上海创宏生物科技有限公司;DMEM培养液,购自苏州旭太生物工程有限公司,货号:22001;胰蛋白酶,购自生工生物工程(上海)股份有限公司,货号:A003702;RT-PCR一步法检测试剂,购自北京全式金生物技术股份有限公司,货号:AH411;核酸提取试剂盒(吸附柱法),购自龙阔(苏州)生物工程有限公司,货号:SJH9-2;猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒三重实时荧光定量PCR试剂盒,购自龙阔(苏州)生物工程有限公司,货号:SJH60。
1.2 主要仪器 Autopure32A核酸提取仪,杭州奥盛仪器有限公司产品;FQA-48荧光定量PCR仪,杭州博日科技股份有限公司产品;JX-FSTPRP全自动样品组织研磨仪,上海净信实业发展有限公司产品;37XC型光学显微镜,上海蔡康光学仪器有限公司产品。
1.3 试验动物 15头3日龄健康哺乳仔猪,经猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒三重实时荧光定量PCR试剂盒检测结果为PEDV阴性,购自广州市某猪场。
1.4 病料处理 从江苏省2个猪场疑似PEDV发病死亡的仔猪中分别无菌操作各采集1份肠组织,使用组织研磨仪研磨,用DMEM培养液进行5倍稀释制成悬液,-70 ℃反复冻融3次。6 000 r/min离心20 min,分别各取5 mL上清液经0.22 μm微孔滤膜过滤后,加入适量双抗,-70 ℃保存作为接种材料。
1.5 病毒分离 将1.4中处理的2个样品各1 mL接种液分别接种于已长成单层的Vero细胞(10 mL培养液),置于37 ℃ CO2培养箱中吸附1 h,然后倒掉接毒液,新加入含4 μg胰酶的DMEM培养液10 mL,另设1瓶正常细胞作为对照。培养72 h,盲传3代,观察有细胞病变效应(Cytopathic effect,CPE)的继续传代,直至稳定。显微镜观察接毒细胞CPE情况。
1.6 病毒实时荧光定量PCR鉴定 分别将病毒分离液使用猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒三重实时荧光定量PCR试剂盒进行鉴定,操作步骤按试剂盒说明书进行。
1.7 病毒含量测定 按《中华人民共和国兽药典》附录3402中病毒半数致死感染量测定法(Reed-Muench法)测定所分离病毒在Vero细胞上的病毒含量。
1.8 PEDVS1基因检测和分析 取在Vero细胞适应的病毒液,采用反转录PCR(RT-PCR)方法扩增PEDVS1基因进行鉴别诊断和测序分析。
1.8.1 引物合成 利用PEDVS1基因段鉴别引物[9]对分离毒株进行鉴别诊断,获得的扩增片段大小为726 bp时鉴定为PEDV流行变异毒株,扩增片段大小为581 bp时鉴定为PEDV经典毒株,引物由安徽通用生物工程有限公司合成,信息见表1。

表1 PEDV S1基因鉴别引物
1.8.2 病毒RNA提取及RT-PCR检测 使用核酸提取试剂盒提取PEDV RNA,利用表1合成的引物,使用RT-PCR检测试剂扩增PEDVS1基因。RT-PCR反应总体积20 μL:RNA模板2 μL,2×One-step Reaction Mix 10 μL,上、下游引物各0.4 μL,One-Step Enzyme Mix 0.4 μL,ddH2O补至20 μL。RT-PCR反应程序:50 ℃ 20 min;94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。PCR产物用1.5%琼脂糖凝胶电泳检测。
1.8.3S1基因的克隆与序列分析 将PCR扩增产物回收纯化后与pUC57克隆载体连接,转化大肠埃希菌(E.coli) DH5α感受态细胞,菌液经PCR鉴定后送生工生物工程(上海)股份有限公司进行测序。在NCBI网站上挑选并下载GenBank中不同年份的PEDV参考毒株,利用DNASTAR、MEGA生物信息软件对分离株测得的S1基因序列与参考毒株S1基因序列进行比对分析并绘制遗传进化树。
1.9 动物毒力试验 将试验仔猪随机分为3个组,A组、B组和C组,每组5头。其中A组为对照组,B组和C组为攻毒组,每头分别灌服接种分离培养的病毒液(107.0TCID50/mL)2 mL,攻毒后观察仔猪临床症状,统计发病率和死亡率。
2 结果
2.1 病毒分离 将经过除菌处理的肠组织悬液上清液接种于Vero细胞,传至第5代,稳定在24 h时开始出现细胞病变,表现为细胞内形成空泡,变圆皱缩;在36 h时细胞间出现拉丝,间隙增大;48 h时细胞呈梭形,脱落细胞达到60%,表现为典型细胞病变,正常对照细胞没有病变(图1)。

图1 Vero细胞的细胞病变 (200×)
2.2 病毒实时荧光定量PCR鉴定 使用猪流行性腹泻病毒、传染性胃肠炎病毒和轮状病毒三重实时荧光定量PCR检测试剂盒鉴定,2份病毒分离液样品均为猪流行性腹泻病毒阳性,Ct值分别为15.14和13.86,传染性胃肠炎病毒和轮状病毒均为阴性。将获得的2株分离株分别命名为DJCY和DJYJ。
2.3 病毒含量测定 按Reed-Muench法测定所分离的DJCY和DJYJ病毒含量分别为107.80TCID50/mL和108.16TCID50/mL。
2.4 PEDVS1基因检测与分析
2.4.1 PEDVS1基因RT-PCR检测 对出现病变的细胞接毒液使用PEDVS1基因鉴别诊断引物进行RT-PCR检测,出现720 bp左右的目的条带(图2)。

图2 分离株S1 基因的RT-PCR鉴别
2.4.2 PEDVS1基因序列分析 将2株分离株S1基因测序结果与PEDV典型毒株S1基因核苷酸序列进行比对分析。结果显示,DJCY分离株和DJYJ分离株的同源性为99.7%,与经典毒株(ZL29-2015、OH851、DR13、JS2008、CV777、SD-M)的同源性为85.9%~87.5%,与流行变异毒株(MN、AJ1102、CH-JX-JA、JSCZ1601等)的同源性为97.1%~99.2%(图3)。DJCY分离株和DJYJ分离株在S1基因片段内相对于经典株分别有1个氨基酸(3个碱基)的插入和2个氨基酸(6个碱基)的缺失(图4),属于PEDV变异株GⅡ分支G2b型(图5)。

图4 利用DNASTAR软件对流行毒株S1基因与参考毒株S1基因序列部分片段的比较分析
2.5 动物毒力试验 B组和C组攻毒24 h后仔猪全部出现腹泻,发病率均为100%;攻毒后7 d内B组死亡4头,死亡率为80%;C组死亡5头,死亡率为100%;对死亡仔猪进行剖检,小肠肠壁变薄充血、胀气,内有黄色水样粪便和未消化凝乳块(图6),表明DJCY和DJYJ两毒株毒力较强,可作为疫苗检验用强毒。
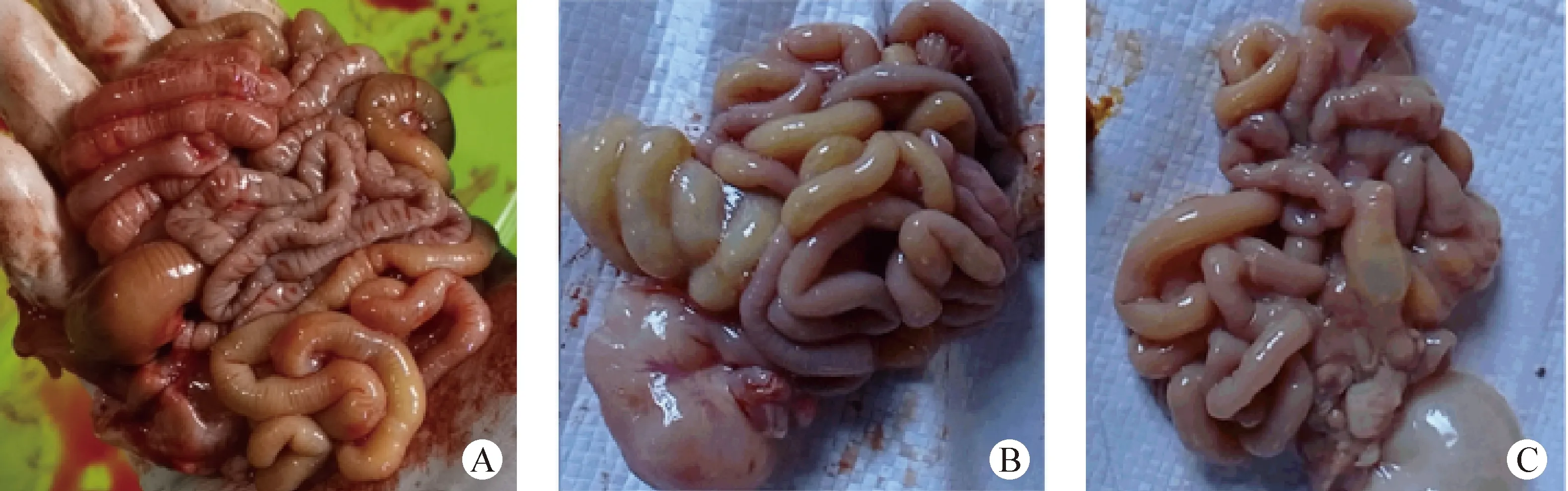
图6 PEDV感染仔猪的临床剖检
3 讨论
本试验所得2株病毒分别分离于江苏2个猪场,均可接种Vero细胞产生细胞病变,通过实时荧光定量PCR鉴定为猪流行性腹泻病毒,用所分离的病毒接种哺乳仔猪均出现典型的猪流行性腹泻症状,体外和体内试验都证实分离毒株均为猪流行性腹泻病毒毒株。
猪流行性腹泻病毒DJCY分离株和DJYJ分离株在Vero细胞上测得的TCID50分别为107.80/mL和108.16/mL,将2个分离株稀释为107.0TCID50/mL,分别接种5只哺乳仔猪均出现典型的猪流行性腹泻症状,发病率均为100%,死亡率分别为80%(4/5)和100%(5/5),发病仔猪的肠道均表现为小肠肠壁变薄、充血等病变。说明分离到的猪流行性腹泻病毒野毒株毒力较强。
本试验分析了江苏省2个猪场2021年7月引起仔猪腹泻的主要病毒性病原的感染情况,检测表明当前引起仔猪病毒性腹泻的主要病原依然是PEDV,这可能与PEDV为RNA病毒,本身变异风险较大有关,因此本试验基于PEDV分离株的高变区S1基因片段进行了遗传进化树和同源性的相关分析,确定当前江苏省PEDV流行株均属于变异毒株。氨基酸序列分析显示,与经典株相比,变异毒株具有特征性的氨基酸插入和缺失。PEDV弱毒疫苗株,在S1基因片段内相对于常见PEDV毒株有4个氨基酸(12个碱基)的插入;经典株相对于变异株分别有1个氨基酸(3个碱基)的缺失和2个氨基酸(6个碱基)的插入,可以此为依据区分疫苗株和变异株[10-12]。
目前国内秋冬季节PEDV仍然高发,粪口传播是主要的传播方式,此外还有乳汁传播、垂直传播和空气传播,同时场内的饲养管理也应得到重视,用具和车辆合理科学的消毒管理、栏舍的干燥温度控制以及员工定员定岗是预防此病必须做到的基础工作。

