条件控制模型在工艺流程复习中的构建与应用
广西 杨伟勇
《普通高中化学课程标准(2017年版2020年修订)》指出,教师应该能运用多种认知模型来描述和解释物质的结构、性质和变化,建立解决复杂化学问题的思维框架。化学工艺流程题综合性强,涉及高中阶段所学的物质结构与性质、化学反应原理、化学实验、水溶液中离子平衡、生产与技术等内容,这需要教师引导学生建立这些关键知识点和具体问题关联的思维模型。本文着重以条件控制为例,从条件的类型、解题思路、答题规范等方面来引导学生,熟悉工艺流程题条件控制可能涉及的问题,在复习过程中利用合适的解题模型,形成规范有序的答题模式。理解、掌握条件控制模型,一方面是教师要落实、渗透化学学科核心素养“证据推理与模型认知”的具体体现;另一方面让学生紧扣模型,不断训练、对比,让学生更清楚地了解自己解题中的优缺点,调动学生学习的积极性,从而提高复习效率。
一、整合条件,构建模型
条件控制的基本思路:为什么这样做?这样做的优点?不这样做的缺点?
(一)调节反应物的浓度
【思维模型】反应物浓度高会怎么样?浓度低会怎么样?
【典型情况答题模型】
1.适当增大反应物酸或碱的浓度,可加快某物质反应(溶解)的速率,提高原料的浸出率;若反应物酸或碱浓度太高导致难以扩散,和生成物都富集于反应物表面,会影响原料的浸出率。

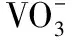
(二)控制溶液的pH
【思维模型】pH的控制在考题中经常出现,其实也可认为是H+浓度改变,调pH的目的是什么?应如何调节?调高?调低?还是调到一定范围?采取的措施、方法是什么?
【典型例题模型】
1.调节溶液酸碱性目的:使某物质溶解或促进(或抑制)金属离子水解形成氢氧化物沉淀(或不沉淀)以便分离,过程中不引入新杂质。
2.pH<7可以是酸或酸性物质,pH>7可以是碱或碱性物质;pH由低调高可通过加碱(或碱性物质)或消耗H+来实现;pH由高调低可通过加酸(或酸性物质)或消耗OH-来实现。如要分离Al3+、Fe3+可以用过量NaOH溶液,强碱过量能溶解氢氧化铝,NaOH溶液不能用弱碱氨水替代;如分离NaAlO2、Na2SiO3可使用过量盐酸,强酸能溶解氢氧化铝,不能用过量CO2。
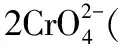
4.pH范围常涉及溶度积Ksp计算。另外缓冲溶液的pH需要保持在一定范围,此问题在制药、电镀等工业常见,中学阶段不介绍。
(三)控制温度
【思维模型】结合工艺流程的目的,考虑某一温度t℃、温度范围(t1~t2℃)、温度的改变(t1℃变为t2℃),影响物质的物理、化学性质,物质发生的物理、化学变化,物质发生的主副反应、正逆反应等,利用物质的性质、化学反应原理等判断措施、操作等的优缺点和合理性。
【典型情况答题模型】
1.升温情况
(1)升温:可促进溶液中气体逸出,降低气体在溶液中的溶解度,或使某物质达到沸点挥发。
(2)加热煮沸:促进水解,聚沉后利于过滤分离;反应前煮沸溶液的原因通常是除去溶解在溶液中的氧气,防止某还原性物质被氧化。
(3)趁热过滤:减少因降温而析出某杂质的量,以提高产品纯度。
(4)反应中采取加热措施的作用:一般是为了加快反应速率或加速某固体的溶解,提高浸出率,或促进某可逆反应的平衡向某个方向移动。
(5)焙烧、煅烧:一般氧气参与反应,可改变物质的结构和组成,使生成的物质能溶解;并使一些杂质在高温下氧化、分解,如煅烧将碳酸亚铁转化为氧化铁。
(6)蒸发、反应时的气体氛围:抑制物质的水解,提高产率。如加热MgCl2·6H2O制取无水MgCl2时,要在HCl的气流中进行,目的是防止MgCl2水解生成Mg(OH)2。
2.降温情况
(1)降温目的:防止物质高温分解,或挥发,或溶解(如H2O2、浓硝酸、浓氨水等);降温可以减少能源成本,降低对设备的要求。
(2)冰水洗涤目的:洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗。
(3)冰水中反应或降温反应目的:防止某物质在高温时会溶解或控制可逆反应平衡移动的方向。
3.控温在某一范围(t1~t2℃)
(1)蒸馏:如海水提溴后蒸馏温度应控制在80~90℃,温度过高,大量水蒸气随溴排出,溴蒸气中水量增加;温度过低,溴不能完全蒸出,回收率低。
(2)控温方式:常用水浴、冰浴或油浴,其优点为容易控温,均匀受热。
(3)可使催化剂的活性达到最好,如微生物、酶作催化剂时温度要在适宜的温度范围内。
(4)防止副反应的发生:如氯气与氢氧化钾在温度范围不同情况下产物不同,按产物要求可设置不同温度范围。
(5)控制固体的溶解与结晶
①从滤液中提取溶解度随温度升高而急剧增大的晶体,如从硝酸钾和氯化钠的混合溶液中提取硝酸钾的方法:蒸发浓缩至有晶膜出现、冷却结晶、过滤、洗涤、干燥。
②从滤液中提取溶解度受温度影响较小的晶体,如氯化钠中有硝酸钾,或随温度降低溶解度增大的晶体的方法:蒸发浓缩结晶、趁热过滤、洗涤、干燥(如氢氧化钙)。
③控制温度缓慢下降,减慢结晶速度,得到较大颗粒的晶体。
(四)控制反应体系的压强
【思维模型】改变压强,对有气体参与或生成的反应,会改变化学反应速率,影响可逆反应平衡移动的方向,一般结合图表判断其对反应的影响。
【典型情况答题模型】
1.减压蒸馏(减压蒸发)的原因:减小压强,使液体沸点降低,防止某物质因温度过高分解或挥发(如氯化铵受热分解)。
2.给原料气加压,可增大气体的溶解度,增大气体与固体(液体)的接触面积,增大反应速率;减压可降低对设备的要求,符合绿色化学要求。结合实际工业生产参数图表分析。
(五)使用催化剂
【思维、答题模型】使用催化剂,可改变反应历程,加快反应速率,提高生产效率,但转化率不变,选用什么催化剂要结合实际生产各参数来确定。
二、真题链接,模型剖析
结合高考真题,了解工艺流程专题条件控制如何设置问题,复习过程心中有数,目标更明确,利用认知模型,使学生认知更有序,更有效。
【例1】(2021·全国甲卷·27节选)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾。回答下列问题:
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10 min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液pH为3.5~4的目的是________,煮沸10 min的作用是______________________________。
【参考答案】过滤 干燥 除尽铁元素并抑制硫酸铜水解 使氢氧化铁胶体聚沉,易于过滤分离
【解析】以硫酸铜溶液制硫酸铜晶体,操作步骤有加热蒸发、冷却结晶、过滤、乙醇洗涤、干燥;其中用乙醇洗涤的原因是胆矾难溶于乙醇,减少其损耗。CuO中含氧化铁杂质,溶于硫酸后会形成铁离子,Cu2+形成沉淀的pH范围是4.7~6.2,Fe3+形成沉淀的pH范围是2.1~3.2,Fe2+形成沉淀的pH范围是7.6~9.6。为使铁元素以氢氧化铁形式沉淀完全,先用氧化剂双氧水把Fe2+氧化为Fe3+,再调溶液的pH到3.2~3.7(题中调pH为3.5~4),使Fe3+全部以Fe(OH)3沉淀的形式析出而Cu2+不沉淀,且不会引入新杂质。Fe3+易水解形成Fe(OH)3胶体,煮沸10 min的目的是使氢氧化铁胶体聚沉,使Fe3+形成沉淀析出,易于过滤分离。
【例2】(2021·全国乙卷·26节选)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。

金属离子Fe3+Al3+Mg2+Ca2+开始沉淀的pH2.23.59.512.4沉淀完全的pH(c=1.0×10-5 mol·L-1)3.24.711.113.8
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______________________________。
(3)“母液①”中Mg2+浓度为________mol·L-1。
(4)“水浸渣”在160℃“酸溶”最适合的酸是________。“酸溶渣”的成分是________、________。
【参考答案】(2)Fe3+、Al3+、Mg2+
(3)1×10-6mol·L-1
(4)硫酸 SiO2CaSO4

三、原创命题,拓宽视野
高考试题大多数是原创试题,在工艺流程专题复习过程中,教师在总结归纳的基础上研发一些原创性试题,引导学生熟悉条件控制的思维模型,引导学生合理训练,利用认知模型,规范答题,对拓宽学生思路也有好处。下面是着重从条件控制命题:
【原创题1】钛合金有很好的耐热强度、低温韧性和断裂韧性,广泛用作飞机发动机零件和火箭、导弹结构件。工业上常用钛铁矿(含FeTiO3、FeO、Fe2O3)制取金属钛并得到副产品绿矾(FeSO4·7H2O)。生产过程如下:
步骤一、用硫酸溶解原料,钛元素转化为Ti(SO4)2、TiOSO4;
步骤二、在溶液中加过量铁充分反应后,过滤除铁,从滤液中经一系列操作分离出副产品;
步骤三、
;
步骤四、煅烧偏钛酸(H2TiO3)即制得二氧化钛;
步骤五、将TiO2和炭粉混合加热至730~830℃,进行氯化处理,并使生成的TiCl4蒸气冷凝;
步骤六、用熔融的镁在保护气中还原TiCl4可得多孔的海绵钛。这种海绵钛经过粉碎、放入真空电弧炉里熔炼,最后制成各种钛材。
已知:FeSO4的溶解度在0℃很小;Ti(SO4)2和TiOSO4可在水中相互转化,Ti(SO4)2溶于冷水且较稳定,在热水中生成TiOSO4,150℃时水解析出白色的偏钛酸H2TiO3沉淀;镁的熔点为649℃,沸点为1 107℃。回答下列问题:
(1)步骤一用的硫酸不能太浓的原因
。
(2)加入铁的目的:
,
此步骤怎么得到副产品
。
(3)补充步骤三:
。
(4)①步骤六的合适温度为________(填选项编号)。
A.约600℃ B.约800℃
C.约1 200℃ D.约1 107℃
②保护气可选________(填选项编号)。
A.N2B.HCl C.Ar D.CO2
【参考答案及解析】(1)硫酸浓度太高导致其难以扩散,和生成的盐都富集于金属氧化物表面,不利于金属氧化物的浸出;原料中有亚铁的存在,在工业条件下,部分硫酸被还原成二氧化硫,浪费原料,所以硫酸浓度不宜过高。(2)加入铁屑,Fe3+被还原为Fe2+,然后将溶液蒸发浓缩,冷却至0℃以下,使得FeSO4·7H2O(绿矾)结晶析出,过滤。(3)根据题中信息,分离出副产品后滤液加热到150℃得偏钛酸沉淀H2TiO3,过滤;(4)①由题中信息可知:镁的熔点为649℃,沸点为1 107℃。温度在(649℃,1 107℃)镁为熔融态,故选B;②镁能与A.N2,B.HCl,D.CO2反应,故选C.Ar。
【原创题2】晶体硅是一种重要的非金属材料,其用途有作太阳能电池板、半导体材料、电脑手机等内存芯片。利用石英(沙子)制备纯硅的主要步骤如下:
步骤一、石英(沙子)与焦炭在电弧炉中冶炼提纯得到98%的工业硅。
步骤二、粗硅与干燥的HCl气体(250~300℃,铜粉催化)反应制得SiHCl3,副产品SiCl4。
步骤三、经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃),因SiHCl3和SiCl4制硅的条件不同,SiHCl3和SiCl4要分离。
步骤四、SiHCl3与过量的H2在1 100~1 200℃的温度下反应制得纯硅。
已知SiHCl3能与水剧烈反应生成(HSiO)2O,SiHCl3在空气中易自燃生成SiO2。回答下列问题:
(1)工业上分离SiHCl3、SiCl4的操作方法为________,控制温度范围为________。
(2)该生产工艺中可以循环使用的物质是________。
(3)工业上准备生产纯硅时,先________;后鼓入纯净干燥的氢气一段时间。原因是________________,最后调到合适的温度范围________,合适的压强才开机生产。
【参考答案及解析】(1)沸点不同互溶的液体与液体分离用蒸馏方法;温度可选(33.0℃,57.6℃),SiHCl3达沸点(33.0℃)挥发出来,而未达SiCl4的沸点(57.6℃)不挥发出来。(2)氯化氢、氢气既是原料也是副产品可循环使用。(3)按生产环境要求,涉及三氯氢硅生产全程需要设备绝对密封,不能进空气,避免自燃和水解,生产纯硅前先检查设备的气密性,用干燥的氢气排净空气、水蒸气等;题中给了SiHCl3与H2的反应条件,应选择反应温度(1 100℃,1 200℃)。


