脱硫废水再生回用对海水循环冷却排水浓缩制盐的影响研究
郭 浩,焦春联,赵达维,王 强,王维珍,陈 冲,尹建华
(1.自然资源部 天津海水淡化与综合利用研究所,天津 300192;2.天津国投津能发电有限公司,天津 300480)
海水循环冷却技术能够有效缓解我国沿海地区淡水资源短缺的现状[1],同时,海水循环冷却系统排放的浓缩海水是海水制盐的优良原料[2-3],发展海水循环冷却技术,不仅能够节约大量淡水资源,还可以实现海水化学资源的有效利用,真正做到海水资源的高效利用。2021年,国家发展改革委印发的《关于推进污水资源化利用的指导意见(发改环资[2021]13号)》要求显著提升工业用水重复利用及资源化利用水平。燃煤电厂普遍采用湿法烟气脱硫技术[4-5],产生大量的脱硫废水,其成分复杂、处理难度大、处理成本高[6-8]。针对此问题,笔者所在课题组开发了一套脱硫废水再生处理后回用于海水循环冷却系统的水处理工艺[9],能够有效提升脱硫废水的重复利用效率。前期研究结果证明,少量脱硫废水再生回用于海水循环冷却系统后,其排水浓缩制成的结晶盐可以满足日晒工业盐的产品质量标准。但是,随着脱硫废水回用量的增大,其对循环系统排水浓缩制盐的影响规律需要开展进一步的研究。文章将原海水与再生脱硫废水掺混配置海水循环冷却系统排水,开展人工模拟蒸发浓缩制盐实验,研究引入再生脱硫废水对海水蒸发浓缩析盐过程的影响规律,并对制得的结晶盐进行理化性质检验,为实现海水循环冷却系统的零排放和海水化学资源的有效利用奠定理论研究基础。
1 材料和方法
1.1 实验用水及水质检测方法
实验用原海水采集自天津区域渤海湾,再生脱硫废水采集自北方某燃煤电厂湿法脱硫废水经二级处理后的产水,两种水样的基本水质指标见表1。
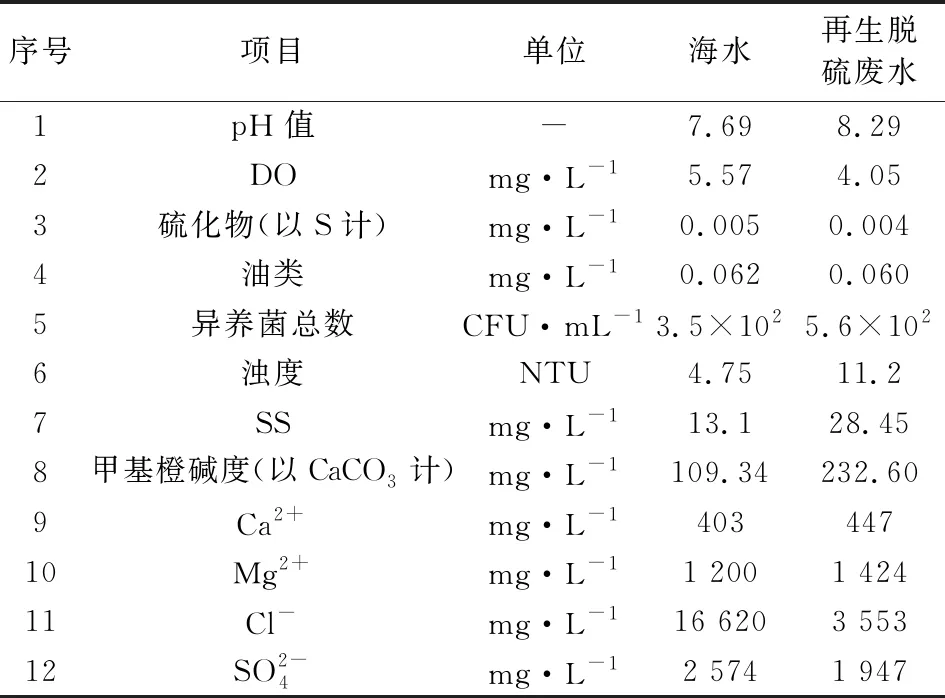
表1 处理后脱硫废水及海水水质检测结果Tab.1 Test results of desulfurization wastewater and seawater quality after treatment
常规水质指标(浊度、盐度、pH值、化学需氧量、氯化物等)参考《GB 17378.4-2007 海洋监测规范 第4部分 海水分析》进行,甲基橙碱度、钙离子、镁离子等采用滴定法进行,金属指标采用分光光度法进行检测。
1.2 蒸发试验
将再生脱硫废水和海水按照特定比例(0.75%、2.00%和3.25%)进行掺混,模拟再生脱硫废水以不同回用比例进入海水循环冷却系统的排水。蒸发实验所需水样体积约为18 L,将其装入直径30 cm、深30 cm的圆筒形透明玻璃反应器中,放置于实验室内光照充分、通风的位置,使水样自然蒸发,试验周期为210 d。试验期间定期检测卤水的pH值、波美度、密度等指标,并取样进行离子浓度的分析检测。待卤水蒸发至25 °Be′后,将前期结晶盐取出,并将上清液转移至2 L烧杯中继续蒸发。最后,将烧杯中蒸发浓缩析出的结晶盐取出,使用离心机甩干,然后进行化学成分检测。
2 结果和分析
2.1 蒸发浓缩析盐规律
(1)硫酸钙、氯化钠析出规律
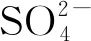
由图2可知,卤水中的Na+和Cl-浓度随着波美比重的升高而升高,当卤水浓缩到一定程度时,Na+和Cl-开始结合生成NaCl晶体而沉积在卤水底部,导致Na+和Cl-浓度不再随卤水的浓缩而上升。由图2可知,三组实验中NaCl晶体析出的波美比重分别为25.2°Be′、25.0°Be′和25.2°Be′,与CaSO4晶体析出的第二个拐点一致,说明NaCl开始大量析出结晶的时候,CaSO4的析出受到抑制,这有利于在此阶段结晶出较纯净的NaCl晶体。同时可以看出,引入再生脱硫废水后,不影响浓缩海水中NaCl晶体的正常析出。


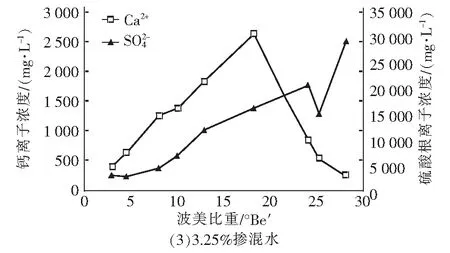
图1 卤水中Ca2+和浓度随波美比重的变化曲线Fig.1 Variations of Ca2+ and concentrations in brine with Baume gravity
三种掺混比例条件下浓盐水蒸发浓缩实验过程中Mg2+和K+的析出规律见图3。由图3可知,Mg2+和K+浓度随波美比重的上升而上升,当NaCl晶体开始析出后,两种离子的浓度都显著提升,说明两种离子不会显著析出进而影响NaCl晶体的纯净度。
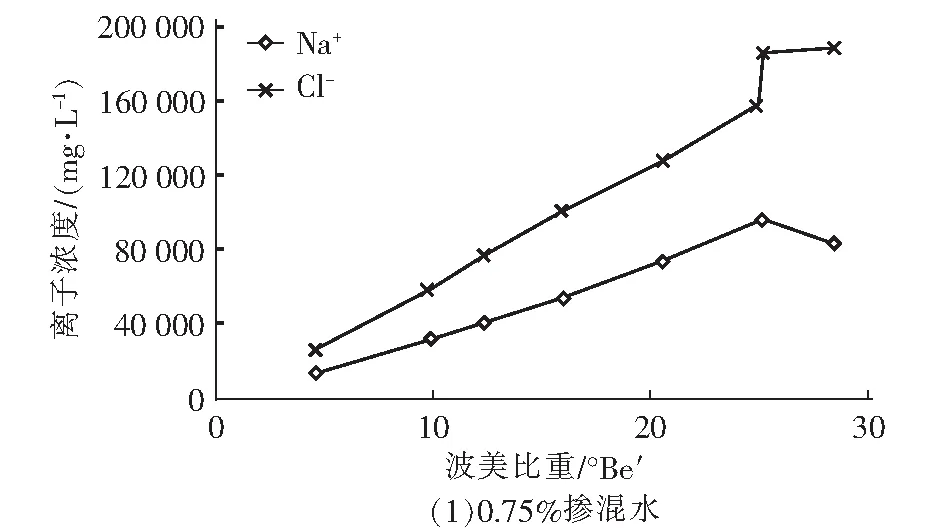
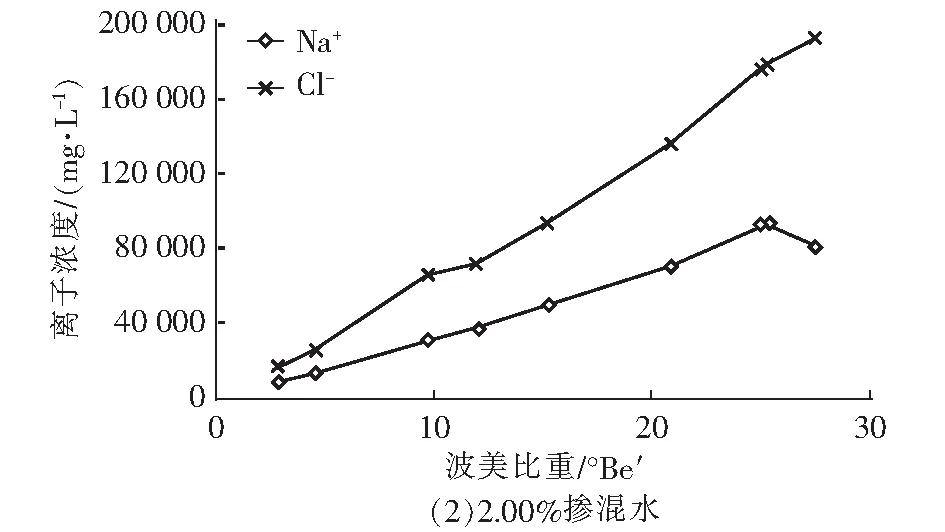
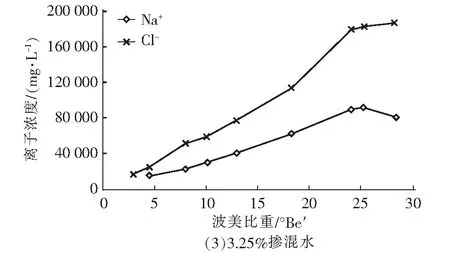
图2 卤水中Na+和Cl-浓度随波美比重的变化曲线Fig.2 Variations of Na+ and Cl- concentrations in brine with Baume gravity
(2)硫酸钙、氯化钠析出情况
将三种掺混水的蒸发浓缩试验过程中CaSO4和NaCl晶体的析出情况和纯海水蒸发浓缩过程进行对比,结果见图4和图5。
通过图4和图5数据,并结合制盐实验过程的照片,可以得到三种不同比例的掺混水和海水条件下CaSO4和NaCl晶体析出点和析出量的对比关系,具体见表2。
由表2可知,随着卤水的蒸发浓缩,卤水中的CaSO4和NaCl先后析出。其中,海水中CaSO4的析出点约为12.4 °Be′,而三种比例掺混水中CaSO4的析出点分别延迟至16.0 °Be′、15.2 °Be′和12.9 °Be′,说明引入再生脱硫废水后CaSO4的析出点会推迟,但推迟程度随再生脱硫废水的比例升高而降低。当海水浓缩至25.8°Be′时,NaCl开始析出,三种掺混水中NaCl析出点则分别为25.2°Be′、25.0°Be′和25.2°Be′,说明引入再生脱硫废水后能引起NaCl析出点的轻微前移。对比NaCl开始析出时CaSO4析出量,海水为90.32%,三种掺混水则分别为82.27%、88.84%和87.29%,而当NaCl析出结束时,三种掺混水的CaSO4析出量均为97.3%左右。整体来看,加入再生脱硫废水对海水制盐影响有限,但0.75%掺混比例的卤水在NaCl析出期间的CaSO4析出量最大,可能对NaCl晶体的纯净度造成一定影响。因此,需要对0.75%掺混比例卤水的结晶盐进行成分分析,进一步验证对结晶盐质量的影响。
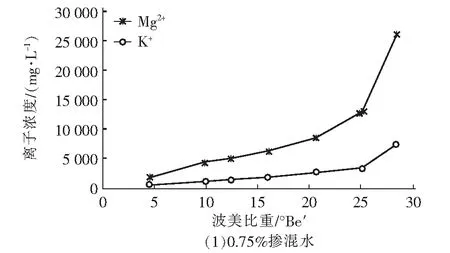
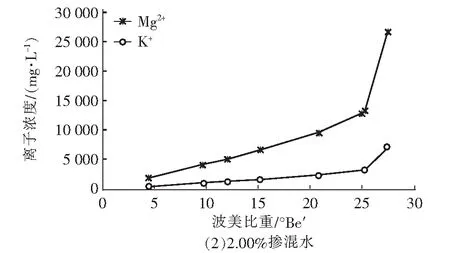

图3 卤水中Mg2+和K+浓度随波美比重的变化曲线Fig.3 Variations of Mg2+ and K+ concentrations in brine with Baume gravity
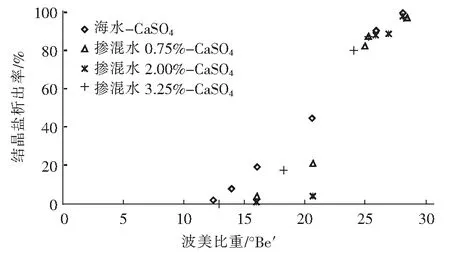
图4 卤水中CaSO4晶体析出率随波美比重的变化曲线Fig.4 Variations of CaSO4 crystal precipitation rate in brine with Baume gravity

图5 卤水中NaCl晶体析出率随波美比重的变化曲线Fig.5 Variations of NaCl crystal precipitation rate in brine with Baume gravity
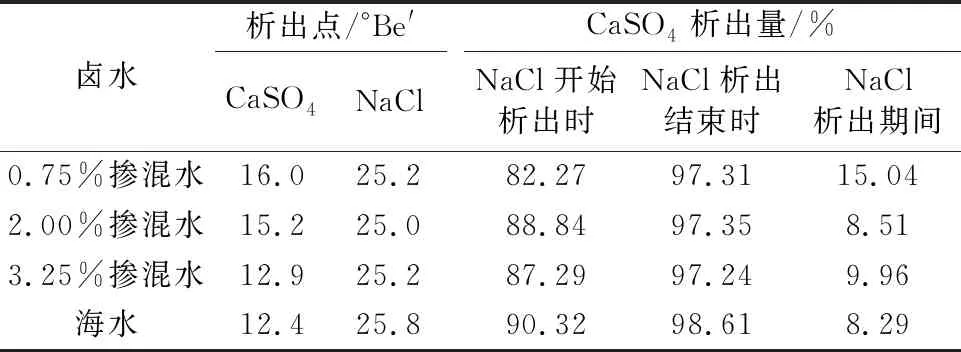
表2 卤水中CaSO4和NaCl析出量对比Tab.2 Comparison of CaSO4 and NaCl precipitation in brine
2.2 结晶盐化学组成
选择可能对结晶盐影响最大的0.75%掺混水的结晶盐进行化学成分检测,结果见表3。
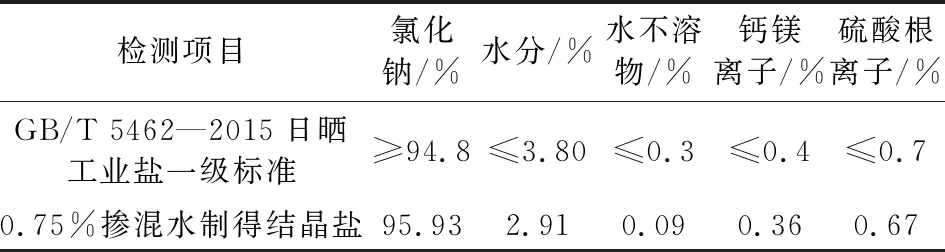
表3 0.75%掺混水蒸发浓缩制盐试验的结晶盐化学组成Tab.3 Composition of crystallization salinization in evaporation concentration test of 0.75% mixed water for salt production
由表3可知,0.75%掺混水的结晶盐的化学组成符合GB/T 5462—2015中日晒工业盐一级品的标准。可以推断,其它两种掺混比例的结晶盐化学组成可以满足工业盐一级品的标准。因此,当海水循环冷却系统引入再生脱硫废水后,当掺混比例浓度介于0.75%~3.25%之间时,制得的结晶盐符合国标工业盐一级品的标准。
3 结论
1)通过海水掺混不同比例再生脱硫废水模拟海水循环冷却系统排水进行蒸发浓缩制盐实验,可以发现:引入再生脱硫废水后,卤水中CaSO4晶体析出点会推迟,但拐点略有提前,而对NaCl晶体的析出影响可以忽略。
2)加入再生脱硫废水对海水制盐析出量的影响有限,将其制得的结晶盐进行化学组成检验,结果满足GB/T 5462—2015中日晒工业盐一级品的标准。因此将再生脱硫废水在一定比例内引入海水循环冷却系统,不影响其排水蒸发制盐过程,能够实现海水循环冷却系统的零排放和海水化学资源的有效利用。

