miR-26a-5p靶向PTEN基因影响成骨细胞分化及基质矿化
叶恒 张卫华 韩俊 张建业 蒋现永
武汉科技大学附属汉阳医院骨一科,湖北 武汉 430050
骨质疏松症是常见的骨骼疾病之一,主要特征为骨量低、骨组织微结构损坏,导致骨脆性增加、容易发生骨折[1-2]。目前,大部分研究[3]认为骨质疏松症与雌激素、遗传、营养状况及某些物理因素等引起的骨代谢失衡有关,而成骨细胞是骨代谢过程重要的功能细胞,其增殖和分化能力对于最终成骨量有决定性作用。微小RNA(micro RNAs,miRNAs)是一类长度约22个核苷酸的单链RNA,可调控靶基因表达参与多种生理疾病的发生发展。据报道[4],miR-26a-5p通过靶向Wnt5a,可在体内外促进炎症来源人牙周膜干细胞的成骨分化。但miR-26a-5p在骨代谢中是否存在其他调控途径尚不清楚。第10染色体同源丢失性磷酸酶张力蛋白基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)作为一种磷酸酶,主要通过抑制丝氨酸/苏氨酸及下游信号通路进行信号转导,从而参与骨代谢过程[5]。本研究以成骨细胞MC3T3-E1为研究对象,验证miR-26a-5p对PTEN的靶向作用,并分析miR-26a-5p对成骨细胞分化及基质矿化的影响。
1 材料与方法
1.1 材料
1.1.1细胞来源:小鼠胚胎成骨细胞前体细胞MC3T3-E1由中国科学院上海细胞库提供。
1.1.2主要试剂与仪器:胎牛血清(美国Gibco),α-MEM培养基(美国Hyclone),脂质体2000试剂盒(美国Invitrogen),miR-26a-5p模拟物(mimic)及阴性对照物无义序列、pcDNA3.1-PTEN及空载质粒由上海吉玛制药技术有限公司提供,双荧光素酶报告基因试剂盒、MTT粉末、RIPA试剂、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),β-甘油磷酸钠、地塞米松、抗坏血酸、Trizol试剂(美国Sigma),SYBR Green荧光染料试剂盒(日本TaKaRa),碱性磷酸酶活性测定试剂盒、骨钙素放射免疫分析试剂盒(南京建成生物科技有限公司),茜素红染液(北京索莱宝科技有限公司),兔抗第10染色体同源丢失性磷酸酶张力蛋白基因(PTEN)、Ⅰ型胶原(ColⅠ)、骨桥蛋白(OPN)、β-连环蛋白(β-catenin)、糖原合成酶激酶-3b(Gsk-3b)抗体、小鼠抗β-肌动蛋白(β-actin)抗体(美国Abcam)。S1000型实时荧光定量PCR扩增仪(美国BioRad),Multiskan FC型酶标仪(美国Thermo Fisher)。
1.2 方法
1.2.1细胞的培养与转染:用含有10 %胎牛血清的α-MEM培养基,置于37 ℃、5 % CO2条件下培养,待细胞融合至80 %左右时,添加胰蛋白酶消化细胞,进行传代培养。取生长状态良好的MC3T3-E1细胞,分为miR-26a-5p mimic组、miR-26a-5p mimic阴性对照(NC)组、pcDNA3.1-PTEN组、miR-26a-5p+pcDNA3.1-PTEN组,参照脂质体2000试剂盒说明书操作,将miR-26a-5p mimic及阴性对照物无义序列、pcDNA3.1-PTEN及空载质粒转染细胞,转染48 h后收集各组细胞。
1.2.2实时荧光定量PCR检测细胞中miR-26a-5p、PTEN mRNA水平:收集各组细胞,用Trizol试剂裂解细胞,提取细胞中总RNA,上微量分光光度计进行定量检测后,经反转录反应合成cDNA,再按着SYBR Green荧光染料试剂盒说明书进行荧光定量PCR扩增,扩增条件:95 ℃预变性3 min,95 ℃变性15 s,60 ℃退火30 s,38个循环。记录各组内参U6、GAPDH和目的基因基本循环数(Ct),采用2-△△Ct法计算miR-26a-5p、PTEN mRNA水平。
1.2.3双荧光素酶报告基因检测:通过Target Scan软件对miR-26a-5p与PTEN结合关系进行预测,获得二者结合位点后,构建PTEN-野生型(WT)3’UTR和PTEN-突变型(MUT)3’UTR,通过脂质体2000试剂盒,将miR-26a-5p mimic及阴性对照物、PTEN-WT 3’UTR、PTEN-MUT 3’UTR共转染MC3T3-E1细胞,转染48 h后,通过双荧光素酶报告基因试剂盒检测各组荧光强度。
1.2.4MTT检测细胞增殖:取各组细胞以5×103个/孔接种于96孔板,正常培养48 h,加入含有20 μL 5 mg/mL的MTT溶液,避光下培养4 h,加入二甲基亚砜震荡溶解6 min后,于酶标仪570 nm处检测各孔吸光度值(A),计算细胞增殖率[(A样品-A空白)/A空白×100 %)。
1.2.5碱性磷酸酶活性测定:取各组细胞以2×104个/孔接种于24孔板,待细胞贴壁后更换为含有成骨诱导剂(10 mmol/L β-甘油磷酸钠、10-8mmol/L地塞米松和0.15 mmol/L抗坏血酸)的培养基,诱导7 d后,通过碱性磷酸酶活性测定试剂盒检测细胞上清液中碱性磷酸酶活性。
1.2.6骨钙素定量检测分析:取各组细胞以2×104个/孔接种于24孔板,待细胞贴壁后更换为含有矿化诱导剂(10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸)的培养基,诱导21 d后,通过骨钙素放射免疫分析试剂盒测定细胞上清液中骨钙素含量。
1.2.7茜素红染色观察:取各组细胞以5×103个/孔接种于96孔板,待细胞贴壁后更换为含有矿化诱导剂(10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸)的培养基,诱导21 d后,于70 %乙醇溶液中室温固定1 h,加入10 %茜素红染液,37 ℃下染色30 min,再加入10 %西吡氯胺,室温放置10 min,于酶标仪570 nm处检测各孔吸光度值(A),计算矿化率。
1.2.8Western blot检测细胞中相关蛋白表达:收集各组细胞,用RIPA试剂裂解细胞,提取细胞中总蛋白,经BCA试剂盒测定蛋白浓度后,各组统一蛋白定量(70~100 μg)进行聚丙烯酰胺凝胶电泳分离蛋白,再湿转至PVDF膜,用5 %脱脂牛奶室温下封闭2 h,分别添加兔抗ColⅠ(1∶2 000)、OPN(1∶5 000)、β-catenin(1∶1 000)、Gsk-3b抗体(1∶2 000)、小鼠抗β-actin抗体(1∶1 000),4 ℃下孵育过夜,次日加入山羊抗兔或山羊抗鼠二抗工作液(1∶5 000),37 ℃下孵育1 h,最后使用化学发光法显色。
1.3 统计学分析
2 结果
2.1 miR-26a-5p与PTEN靶向关系
如图1,Target Scan软件预测(图1A)发现,miR-26a-5p与PTEN 3’UTR于2313-2320碱基处存在结合位点。双荧光素酶报告基因检测(图1B)显示,与NC组比较,共转染miR-26a-5p mimic和PTEN-WT 3’UTR质粒细胞中荧光素酶活性明显降低(P<0.05)。实时荧光定量PCR(图1C、1D)和Western blot检测(图1E)显示,与NC组比较,miR-26a-5p mimic组miR-26a-5p水平升高,PTEN mRNA及蛋白表达降低(P<0.05),pcDNA3.1-PTEN组PTEN mRNA及蛋白表达升高(P<0.05);与miR-26a-5p mimic组比较,miR-26a-5p+pcDNA3.1-PTEN组PTEN mRNA及蛋白表达升高(P<0.05)。
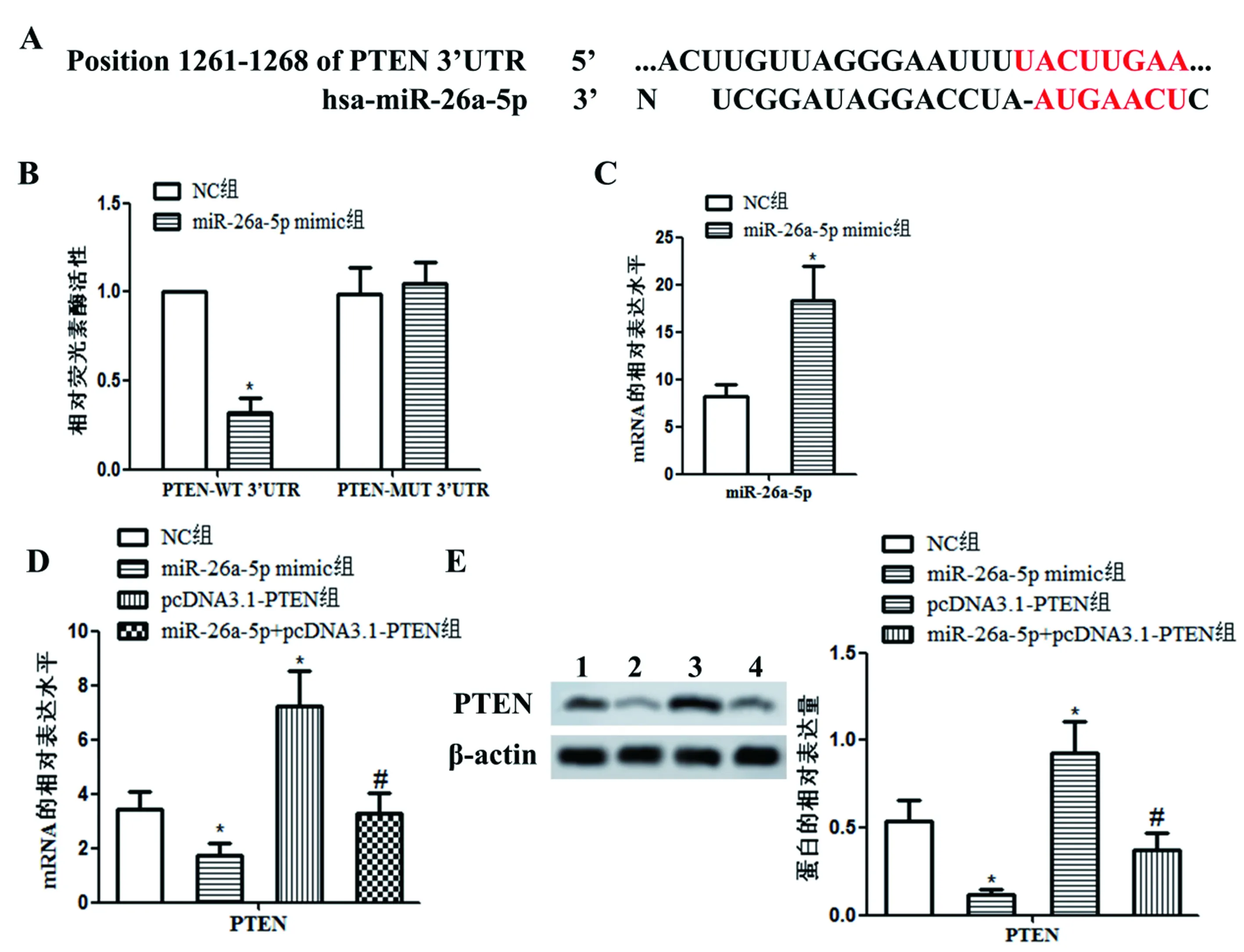
图1 miR-26a-5p与PTEN靶向关系
2.2 miR-26a-5p靶向PTEN对MC3T3-E1细胞增殖的影响
如图2,MTT检测结果显示,与NC组比较,miR-26a-5p mimic组细胞增殖率升高,pcDNA3.1-PTEN组细胞增殖率降低(P<0.05);与miR-26a-5p mimic组比较,miR-26a-5p+pcDNA3.1-PTEN组细胞增殖率降低(P<0.05)。

图2 miR-26a-5p靶向PTEN对MC3T3-E1细胞增殖的影响
2.3 miR-26a-5p靶向PTEN对MC3T3-E1细胞分化的影响
如图3,碱性磷酸酶活性(图3A)和Western blot检测(图3B)显示,与NC组比较,miR-26a-5p mimic组碱性磷酸酶活性、ColⅠ和OPN表达升高,pcDNA3.1-PTEN组碱性磷酸酶活性、ColⅠ和OPN表达降低(P<0.05);与miR-26a-5p mimic组比较,miR-26a-5p+pcDNA3.1-PTEN组碱性磷酸酶活性、ColⅠ和OPN表达降低(P<0.05)。
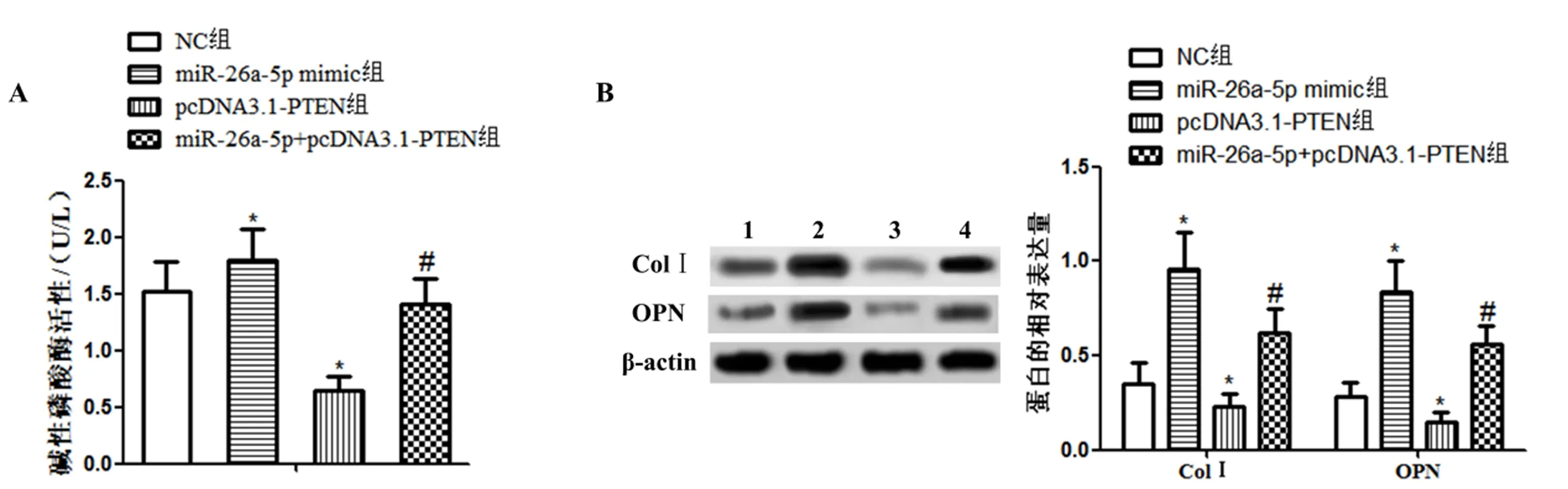
图3 miR-26a-5p靶向PTEN对MC3T3-E1细胞分化的影响
2.4 miR-26a-5p靶向PTEN对MC3T3-E1细胞基质矿化的影响
如图4,骨钙素定量(图4A)和茜素红染色检测(图4B)显示,与NC组比较,miR-26a-5p mimic组骨钙素和矿化率升高,pcDNA3.1-PTEN组骨钙素和矿化率降低(P<0.05);与miR-26a-5p mimic组比较,miR-26a-5p+pcDNA3.1-PTEN组骨钙素和矿化率降低(P<0.05)。
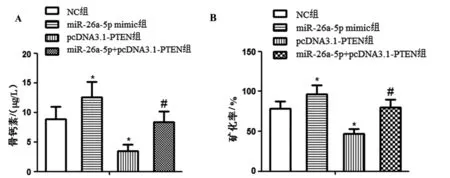
图4 miR-26a-5p靶向PTEN对MC3T3-E1细胞基质矿化的影响
2.5 miR-26a-5p靶向PTEN对MC3T3-E1细胞Wnt/β-catenin信号通路的影响
如图5,Western blot检测显示,与NC组比较,miR-26a-5p mimic组β-catenin表达升高、Gsk-3b表达降低,pcDNA3.1-PTEN组β-catenin表达降低、Gsk-3b表达升高(P<0.05);与miR-26a-5p mimic组比较,miR-26a-5p+pcDNA3.1-PTEN组β-catenin表达降低、Gsk-3b表达升高(P<0.05)。

图5 miR-26a-5p靶向PTEN对MC3T3-E1细胞Wnt/β-catenin信号通路的影响
3 讨论
成骨细胞和破骨细胞之间的动态平衡对于人体骨量起着重要的作用,而骨代谢紊乱是骨质疏松症的病理基础[6]。大量研究显示,miRNAs参与成骨细胞分化和基质矿化过程:miR-455-3p靶向HIPK2抑制高糖诱导的成骨细胞凋亡,并促进其细胞增殖,可能与抑制STAT3信号通路有关[7];miR-296可通过上调人成骨细胞hFOB1.19中Cbfal表达,促进成骨细胞分化[8]。miR-26a-5p是miR-26a的成熟链,miR-26a可广泛表达于胚胎、肌肉、生殖器官等,具有丰富的生物学功能。Li等[9]研究显示,miR-26a可抑制EZH2表达,增加成骨细胞,减少破骨细胞,保护激素诱导的股骨头坏死。
本研究经过软件预测发现,miR-26a-5p可靶向结合PTEN基因序列,Cai等[10]报道miR-26a-5p与PTEN在糖尿病大鼠心肌损伤中也存在靶向关系。MC3T3-E1细胞转染miR-26a-5p mimic后,PTEN表达下调,表明PTEN是miR-26a-5p的靶向基因。PTEN基因定位于染色体10q23.3,可通过拮抗酪氨酸激酶等磷酸化酶活性参与病理生理过程[11]。Yin等[12]研究发现,相较于健康人群,骨质疏松症患者miR-140-3p水平升高,PTEN表达降低,且miR-140-3p可靶向下调PTEN表达调控成骨/破骨细胞的分化。本研究分别将miR-26a-5p mimic、pcDNA3.1-PTEN转染MC3T3-E1细胞,miR-26a-5p mimic可促进细胞增殖、成骨分化及基质矿化,增加成骨分化早期(碱性磷酸酶、ColⅠ)和晚期标志性蛋白(骨钙素、OPN)表达,pcDNA3.1-PTEN可逆转上述作用,表明miR-26a-5p可靶向下调PTEN,促进MC3T3-E1细胞增殖、分化和矿化。
骨代谢的平衡还受到多种信号通路的调控,其中Wnt信号通路无论是在成骨细胞的分化成熟,还是骨基质矿化方面均有关键作用[13]。通过β-catenin作用激活基因转录是经典的Wnt信号通路,β-catenin在成骨细胞中广泛表达,可促进成骨细胞的分化和存活[14]。Parra-Torres等[15]研究表明,Wnt相关拮抗剂可调节Wnt/β-catenin信号通路,从而参与骨代谢过程。本研究通过Western blot检测Wnt/β-catenin信号通路表达,结果显示miR-26a-5p过表达可提高MC3T3-E1细胞中β-catenin表达,但降低Gsk-3b表达,提高细胞中PTEN表达后,β-catenin表达降低,Gsk-3b表达升高。以上结果表明,miR-26a-5p靶向PTEN促进MC3T3-E1细胞增殖、分化和矿化,可能与调节Wnt/β-catenin信号通路有关。
综上所述,miR-26a-5p通过负向调控PTEN表达,进而影响MC3T3-E1细胞增殖、分化和矿化,可能与调节Wnt/β-catenin信号通路有关。miR-26a-5p作为成骨分化的正向调节分子可能是未来治疗骨病的潜在治疗靶点,但其对成骨分化的影响及在骨质疏松症中的作用机制还需要通过动物模型进一步阐明。

