红麻HcMYB3基因克隆和表达分析
杨大为,邓勇,张超,栾明宝,黄思齐,李建军,常丽,潘根,唐慧娟,李德芳
(中国农业科学院麻类研究所/农业农村部麻类生物学与加工重点实验室,湖南 长沙 410205)
由于不合理灌溉、过度开发土地、气候干旱和地势低洼等因素,全球范围内土壤盐渍化程度逐年加重,环境与可持续农业之间的矛盾日益凸显[1-2]。针对当下形势,培育耐盐作物新品种是开发利用盐碱地最有效的措施之一。红麻(Hibiscus cannabinusL.)是重要的纤维作物之一,广泛应用于麻纺、饲料、造纸、活性炭、建材等诸多领域。红麻具有生长周期短、生物量大、抗逆性强、经济价值高等特点,赋予其极大的土壤改良潜力[3]。据报道,红麻的耐盐性强于玉米、高粱、盐地碱蓬、高丹草,能够在含盐量0.4%左右的环境中正常生长[4-5]。但目前有关红麻耐盐性的研究主要局限于耐盐性评价和生理生化方面,分子机制方面研究较少,这严重限制了红麻育种技术的发展。
MYB转录因子广泛存在于生物界当中,是一类具有特定DNA结合域(DBD)的蛋白质[6]。最早在植物中发现的MYB基因是从玉米中分离出的MYBC1,作用于色素合成调控[7]。MYB蛋白序列大多每间隔18个左右氨基酸会存在1个色氨酸(W)残基,这些残基能够使该蛋白形成HTH结构,从而具有高度保守性。基于重复结构域的数量(1R、2R、3R、4R)可将MYB蛋白分为4个亚类[8],其中含有2个R结构域的MYB蛋白(R2R3-MYB)相关研究较多[7]。R2R3-MYB转录因子的数量是4个亚类中最多的,在拟南芥中占64.3%,水稻中占56.77%,并且其N末端和C末端具有多样性和特异性,赋予了该类转录因子更多的生物学功能[9-10]。MYB家族转录因子具有多种生物学功能,不仅参与对逆境胁迫和植物激素的应答,还参与丙酮素代谢途径和植物细胞形态建成。研究发现,苹果的MdMYB2作为转基因植物育种中的正向调控因子,显著提高了植株对盐胁迫的抗性[11],并且MdMYB121在植物响应低温和高盐胁迫过程中也发挥了重要作用[12];草莓的FvMYB24可以与SOS1启动子结合提高植物耐盐性[13];在大豆中过表达GmMYB81也增强了植物对干旱和盐分的耐受性[14]。此外,许多MYB类转录因子主要通过依赖脱落酸(ABA)信号途径应答非生物胁迫。ABA处理和盐胁迫下,水稻幼苗OsMYB84基因表达上调,作用机制类似的转录因子还有DfMYB2、TaMYB33、AtMYB20等[15-18]。MYB转录因子结构多样,功能复杂,在植物的抗逆调控过程中发挥了重要作用。但目前红麻MYB相关研究少有报道,因此深入研究红麻MYB转录因子的结构和功能具有重要意义。
目前红麻基因组数据已公布,本研究根据课题组前期红麻盐胁迫有参转录组数据,筛选出盐胁迫应答关键基因HcMYB3,克隆其CDS全长,并对其进行生物信息学分析及盐胁迫诱导的表达分析,以期为红麻抗逆分子育种工作提供候选基因资源和理论依据。
1 材料与方法
1.1 植物材料与处理
本研究选用的试验材料为“中红麻21号”,是课题组前期选育的耐盐品种,由中国农业科学院麻类研究所提供。选取籽粒饱满并已消毒的种子点播于垫有湿润滤纸的发芽盒中,在恒温光照培养箱中(30℃光照16 h/25℃黑暗8 h)进行催芽。3 d后,选取长势一致的幼芽播于装有1/2 Hoagland营养液的水培盆中,在植物生长帐篷中进行预培养(光/暗交替16 h/8 h,光照强度为3000 Lx,温度为25~27℃,相对湿度为60%~70%)。预培养7 d后,第二次筛选长势一致的幼苗转入另一装有1/2 Hoagland营养液的水培盆中进行NaCl处理,每盆12株幼苗,一盆为一个生物学重复,共设置3个生物学重复。NaCl处理浓度为0、50、150、250 mmol/L,每天更换一次处理液,于第3天(72 h)取幼苗从上至下第3片真叶速冻于液氮中,在-80℃冰箱中保存备用。
1.2 HcMYB3基因克隆
从红麻盐胁迫下转录组数据中筛选出HcMYB3基因(Hca.05G0000990),根据预测的ORF区域,利用Primer 5软件设计并合成特异性引物:HcMYB3-F1(5′-3′):CTTTGAGCATCGTCCCTAACG,加酶切位点 xho1;HcMYB3-R1(5′-3′):GGGAGATGGATTTTGGGTTTC,加酶切位点 sma1。 使用OMEGA公司的总RNA快速提取试剂盒提取红麻幼苗新鲜叶片的总RNA,然后采用FastKing一步法反转录试剂盒(TIANGEN)去除gDNA,合成第一链cDNA。运用RT-PCR技术扩增HcMYB3基因的cDNA全长序列,反应程序为:预变性95℃ 5 min;变性95℃ 30 s;退火55℃ 30 s;延伸72℃ 1 min,30个循环,最后延伸72℃ 10 min,4℃冷却保存。使用1%琼脂糖凝胶将PCR产物进行电泳分离,再使用DNA胶回收试剂盒(TIANGEN)回收并纯化PCR目的片段,然后与pTOPOBlunt Vector(Aidlab)连接,转化大肠杆菌(E.coli)DH5α感受态细胞,在氨苄抗性板上筛选挑菌,经过菌液PCR后挑选阳性克隆菌液送至北京擎科生物科技有限公司进行测序。
1.3 HcMYB3生物信息学分析
利用在线工具ExPASy中的Protparam程序分析HcMYB3蛋白的氨基酸序列长度、分子量和等电点等信息;利用ProtScale软件分析HcMYB3蛋白的亲/疏水性;利用NCBI-CD-search工具预测HcMYB3蛋白的保守功能域;利用TMHMM 2.0软件预测HcMYB3蛋白的跨膜结构域,并利用Signal IP 6.0工具预测信号肽;利用NetPhos 2.0预测HcMYB3蛋白的磷酸化位点;利用SOPMA工具预测HcMYB3蛋白的二级结构,在Phyre 2网站获取该蛋白pdb格式文件,通过PyMOL软件绘制三级结构;最后在NCBI网站中采用blastp工具对HcMYB3蛋白进行氨基酸序列比对,随后与高同源性物种的MYB3蛋白序列一起导入MEGA-X软件中,运用比邻接法(Neighbor-joining法)构建系统进化树。
1.4 HcMYB3表达模式分析
选择beta-actin作为内参基因,实时荧光定量(qRT-PCR)引物为HcMYB3-F2(5’-3’):GAAACCCAAAATCCATCTCCC,HcMYB3-R2(5’-3’):GGTTCCGTTTTCGTCGTCA。 使用 OMEGA公司的总RNA快速提取试剂盒提取不同处理下红麻幼苗叶片的总RNA,合成cDNA后,利用CFX96系统(Bio-Rad)和Master qPCR Mix(SYBR GreenⅠ)(TSINGKE)根据试剂盒推荐程序进行qPCR扩增。参照Livak and Schmittgen(2001)的方法采用2-△△Ct方法计算基因表达水平[19]。
2 结果与分析
2.1 红麻HcMYB3基因克隆
以红麻幼苗叶片的cDNA为模板,用特异性引物HcMYB3-F1和HcMYB3-R1进行PCR扩增、胶回收、连接、转化一系列步骤后,得到阳性克隆菌液。菌液PCR显示,扩增条带与目的基因片段长度一致(图1)。经测序,片段序列与目的基因序列完全一致,表明克隆成功。通过NCBI网站的blastp比对,发现该序列与拟南芥AtMYB3蛋白高度同源,因此命名为HcMYB3。
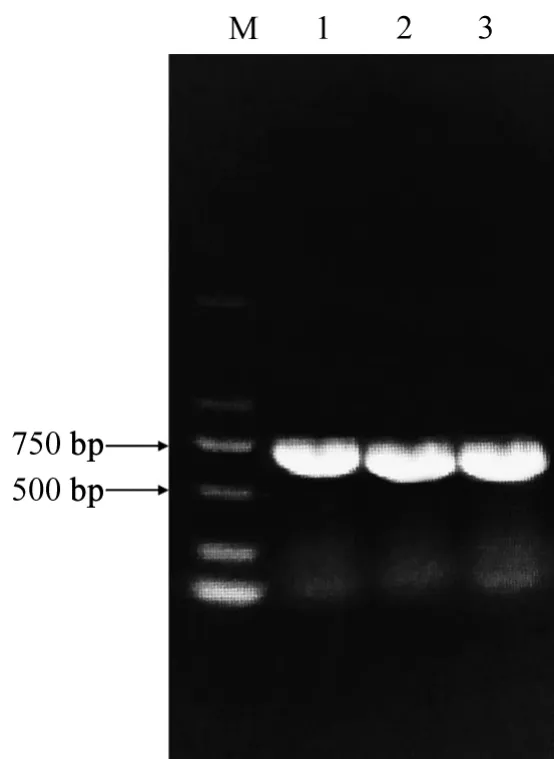
图1 红麻HcMYB3基因阳性克隆PCR扩增片段Fig.1 PCR amplified fragments of positive clones of kenaf HcMYB3 gene
2.2 红麻HcMYB3基因序列分析
利用NCBI网站ORFfinder工具预测克隆获得的CDS序列的开放阅读框(图2),该基因全长675 bp,位于红麻第4条染色体上,编码224个氨基酸,分子式为C1119H1751N327O355S3,分子量为25 561.37,不稳定系数为42.31,超过阈值40,等电点为6.11,是不稳定的酸性蛋白质。通过Pfam工具分析HcMYB3蛋白氨基酸序列结构域,发现该蛋白中存在两段MYB转录因子特有的DNA结合域,分别位于第10~55位和第170~209位,表明该蛋白为R2R3类MYB转录因子。亚细胞定位推测,HcMYB3蛋白在第70~86位氨基酸含有一段核定位信号基序(KKLPDPVLQAVRKRKKT),表明该蛋白主要定位于细胞核中。

图2 红麻HcMYB3全长ORF序列和氨基酸序列Fig.2 Full-length ORF sequence and amino acid sequence of kenaf HcMYB3
2.3 红麻HcMYB3基因编码蛋白的亲/疏水性分析
亲/疏水性变化与蛋白结构和功能密切相关。对HcMYB3基因编码的蛋白质进行亲/疏水性分析(图3),在第24位氨基酸出现最高峰,峰值为1.744,即疏水性最强;在第161位氨基酸出现最低峰,峰值为-3.122,即亲水性最强。整体来看,亲水性氨基酸多于疏水性氨基酸,并均匀分布在肽链中,推测HcMYB3基因编码的蛋白质是亲水性蛋白质。
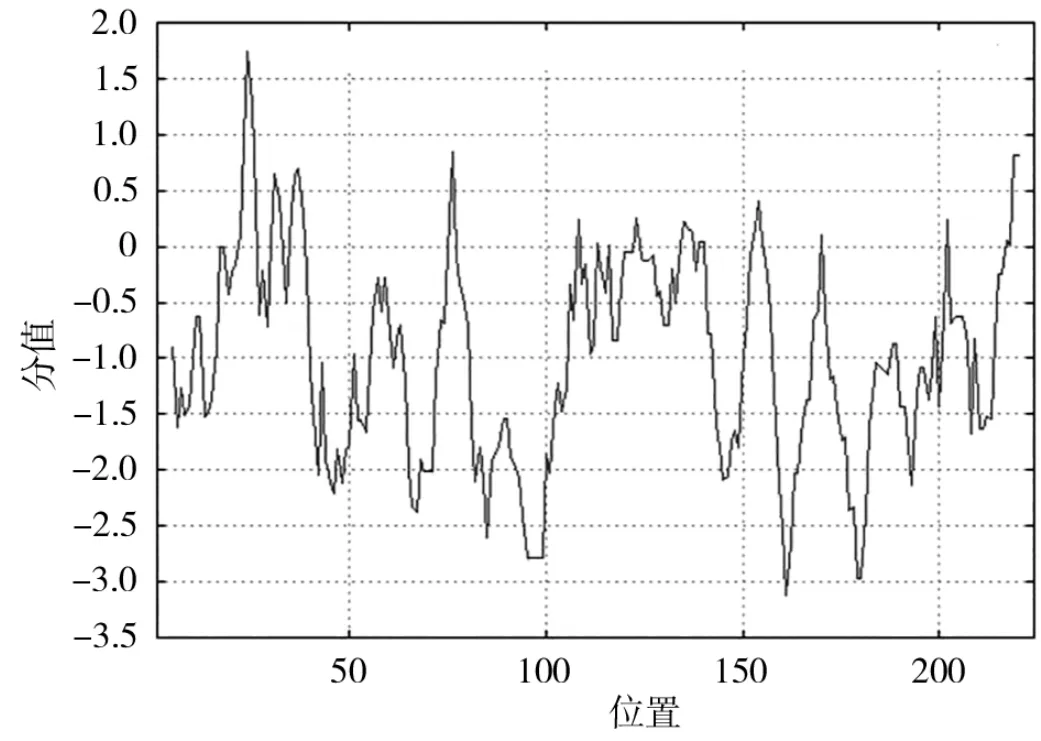
图3 红麻HcMYB3基因编码蛋白的亲/疏水性分析Fig.3 Hydrophilicity and hydrophobicity analysis of HcMYB3 encoded protein
2.4 红麻HcMYB3基因编码蛋白的跨膜结构分析
对HcMYB3基因编码蛋白进行跨膜结构预测(图4),该蛋白在膜外的概率接近1,具有跨膜结构的可能性较低。推测HcMYB3蛋白的224个氨基酸残基几乎完全位于膜外。因此可知,该蛋白不存在跨膜转运信号,同样也不是膜上受体。
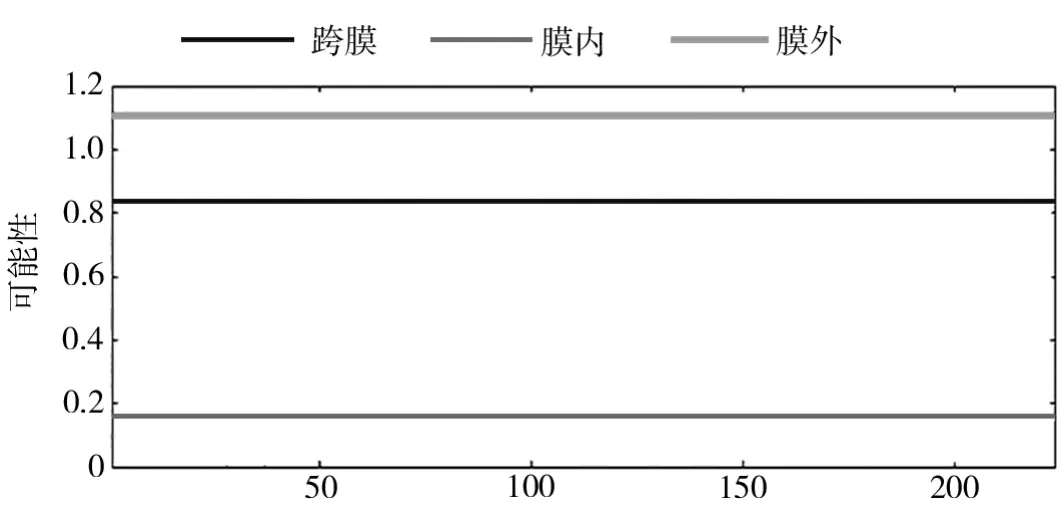
图4 红麻HcMYB3基因编码蛋白的跨膜结构预测Fig.4 Prediction of transmembrane structure of HcMYB3 encoded protein
2.5 红麻HcMYB3基因编码蛋白的信号肽分析
信号肽位于分泌蛋白N端,一般含有5~30个氨基酸残基。HcMYB3蛋白的信号肽预测结果显示(图5),代表剪切位点的C值并无较大变化,代表信号肽区域的S值波动较小,并且综合参数Y值相对平稳,因此推测该蛋白不存在信号肽结构。
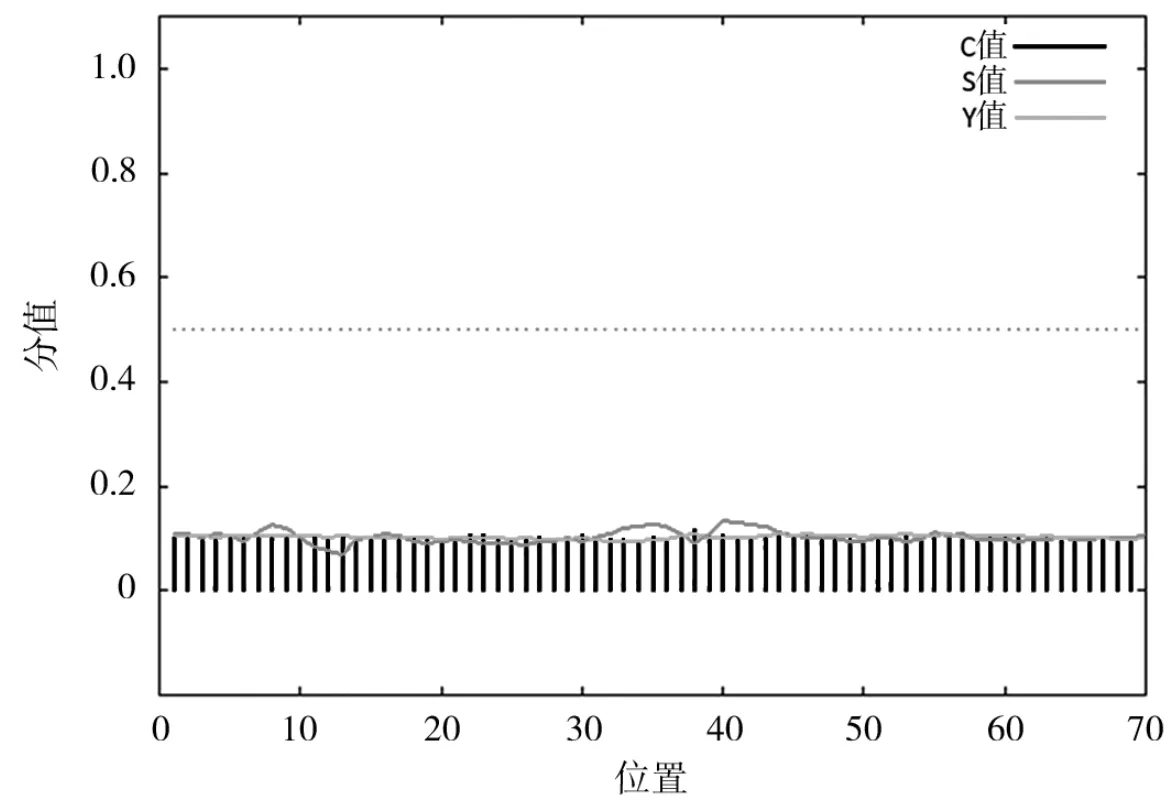
图5 红麻HcMYB3基因编码蛋白的信号肽预测Fig.5 Prediction of signal peptide region of HcMYB3 encoded protein
2.6 红麻HcMYB3基因编码蛋白翻译后修饰位点分析
大部分蛋白质要发挥其功能都需要经历翻译后修饰过程,蛋白的翻译后修饰包括磷酸化、乙酰化、糖基化等。对HcMYB3基因编码蛋白的翻译后修饰位点进行预测,由表1可知,该蛋白存在28个磷酸化位点,对应的磷酸化势见图6。预测到的磷酸化位点包括15个丝氨酸磷酸化位点、11个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点,并且在预测到的磷酸化激酶中大部分为CKII。并未在该蛋白上预测到其他翻译后修饰位点。
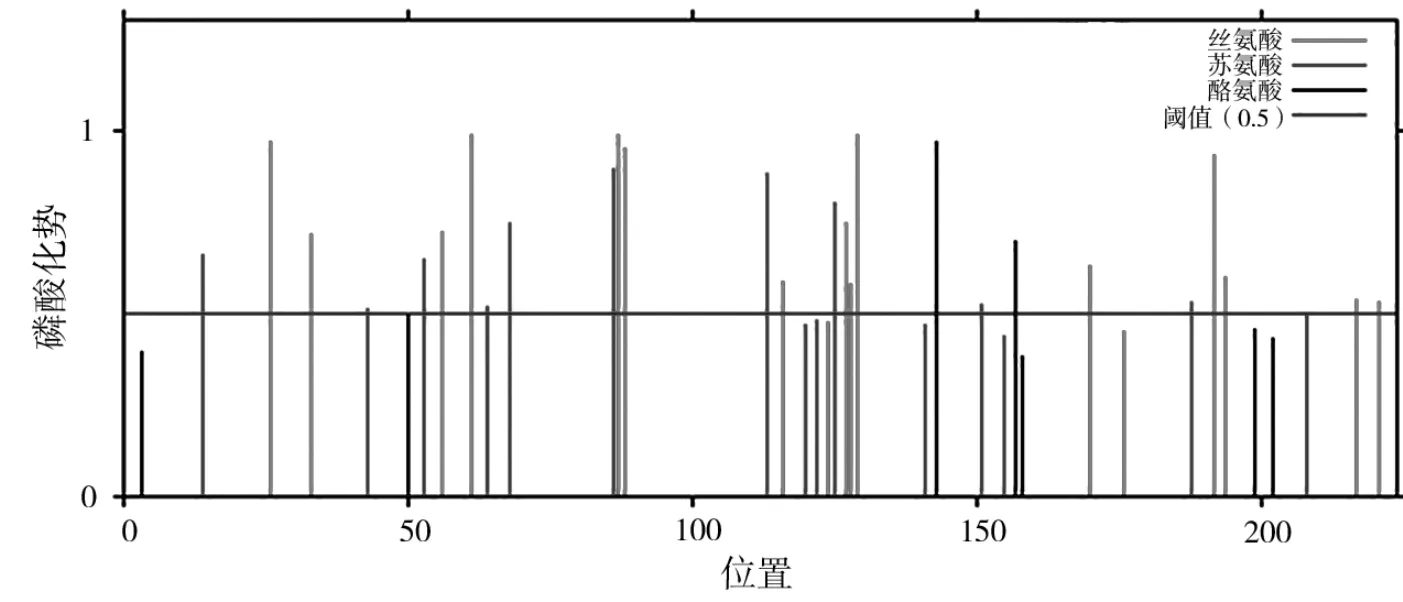
图6 HcMYB3基因编码蛋白的磷酸化位点预测Fig.6 Prediction of phosphorylation sites of HcMYB3 encoded protein
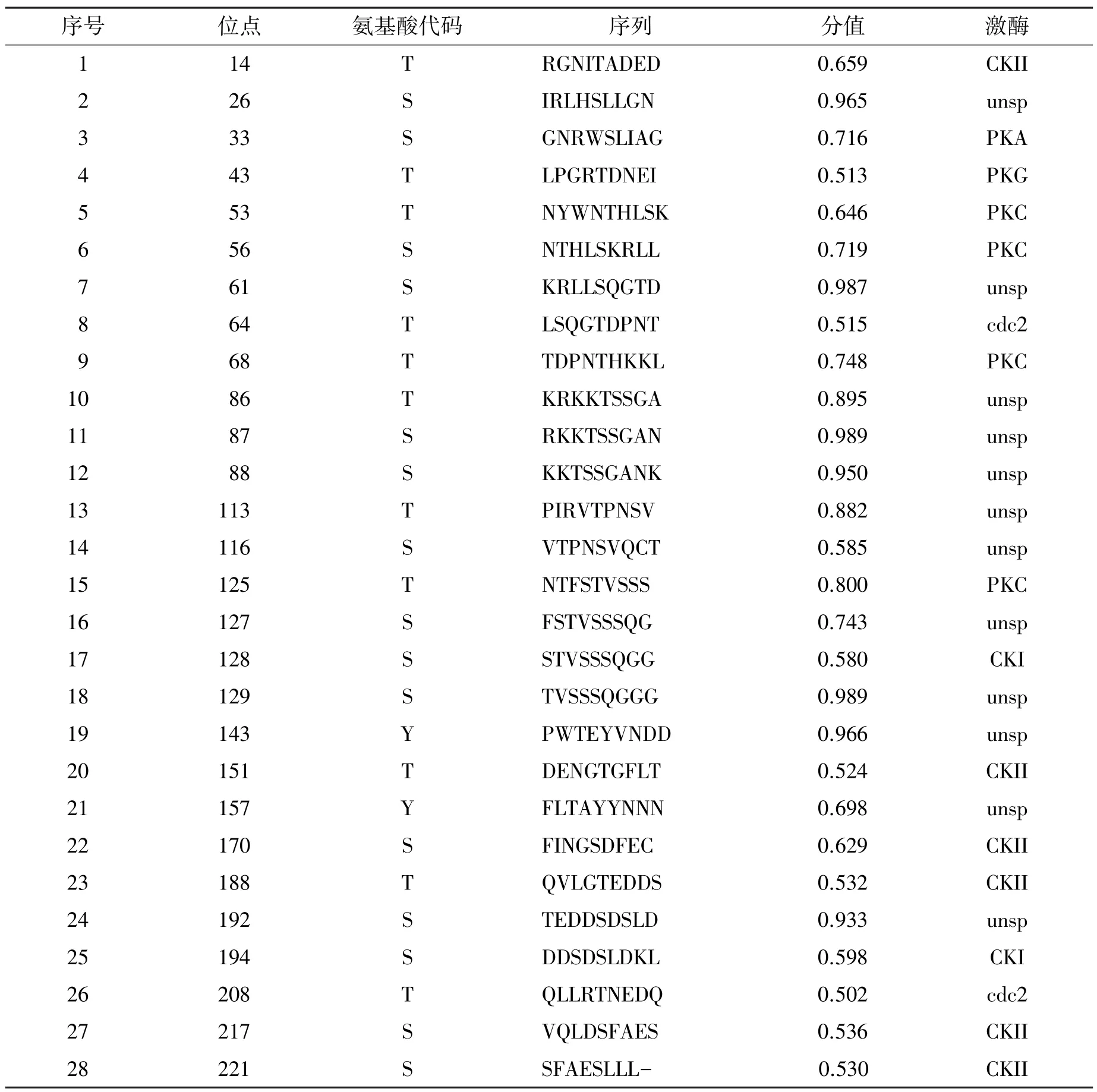
表1 HcMYB3基因编码蛋白的磷酸化位点预测Table 1 Prediction of phosphorylation sites of HcMYB3 encoded protein
2.7 红麻HcMYB3基因编码蛋白产物的二级和三级结构分析
采用SOPMA软件预测红麻HcMYB3基因编码的蛋白质产物二级结构(图7),预测结果显示HcMYB3蛋白由α螺旋结构、延伸链结构、β转角结构和无规则卷曲结构组成,分别占25.45%、11.16%、4.46%和58.93%。在Phyre 2网站中获取HcMYB3蛋白三维空间模型的pdb文件,随后利用PyMOL软件绘制该蛋白三级结构(图8),从分析数据中可得到,HcMYB3基因编码的蛋白质产物三级结构中含有57个α螺旋、25个延伸链、10个β转角和132个无规则卷曲。
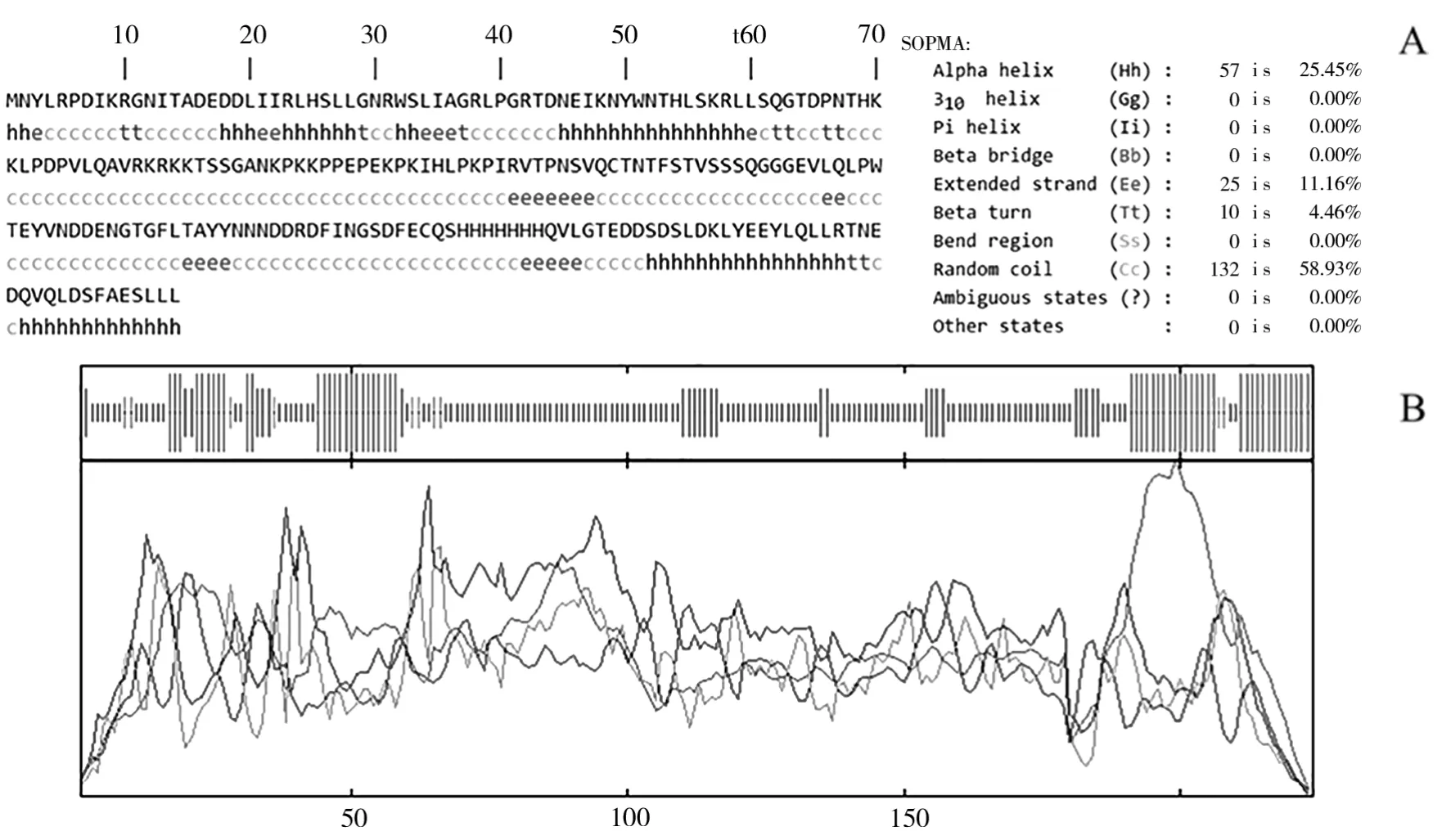
图7 HcMYB3基因编码蛋白产物的二级结构Fig.7 Secondary structure of HcMYB3 encoded protein
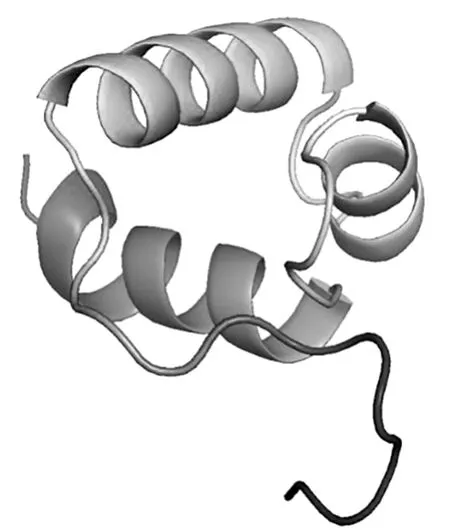
图8 HcMYB3基因编码蛋白产物的三级结构Fig.8 Tertiary structure of HcMYB3 encoded protein
2.8 红麻HcMYB3基因同源进化树分析
利用NCBI-blastp对HcMYB3蛋白序列进行同源性分析,发现与14个不同物种的氨基酸序列相似度较高,其中与木槿(KAE8703642.1)、黄褐棉(TYJ04862.1)、榴莲(XP_022757570.1)、可可树(XP_007051504.1)、哥伦比亚锦葵(XP_021280377.1)、开心果(XP_031285530.1)的氨基酸序列相似度分别为87.11%、75.86%、66.53%、64.88%、64.05%、58.92%。之后利用MEGA-X软件构建系统进化树(图9),发现该蛋白与木槿(Hibiscus syriacusLinn.)亲缘关系最近,此外与黄褐棉(Gossypium mustelinum)、榴莲(Durio zibethinusMurr.)、可可树(Theobroma cacao)和哥伦比亚锦葵(Herrania umbratica)的亲缘关系也相对较近。
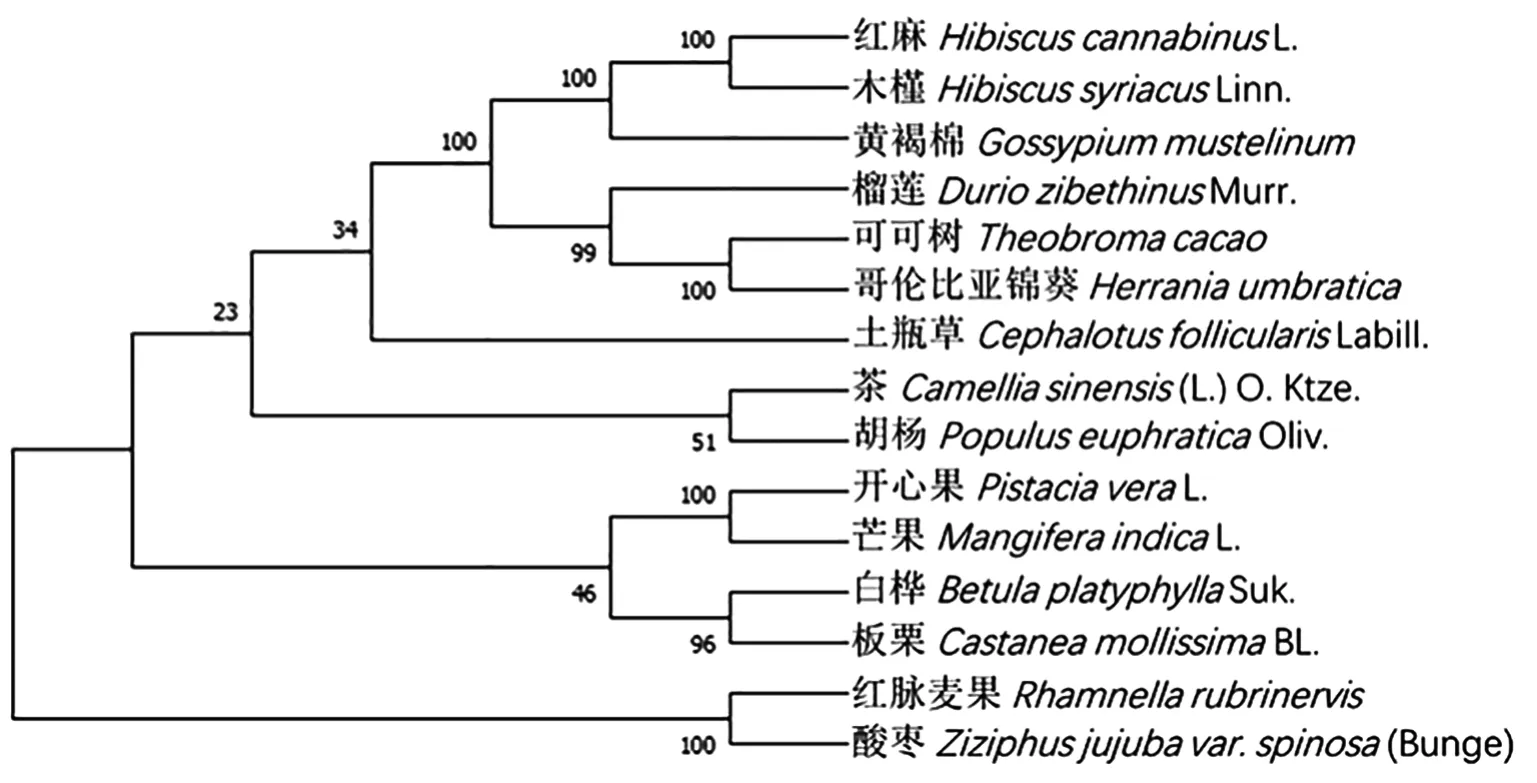
图9 红麻HcMYB3基因同源进化树比对Fig.9 Comparison of homologous evolutionary trees of HcMYB3 gene in kenaf
2.9 红麻幼苗叶片HcMYB3表达模式分析
利用qRT-PCR技术研究红麻苗期在不同浓度盐胁迫下HcMYB3基因的表达水平。结果(图10)表明,在50、150 mmol/L盐胁迫下,HcMYB3基因的表达量呈现升高趋势,并且在150 mmol/L盐胁迫下的表达量增幅最大,达到对照的4.78倍。当NaCl浓度为250 mmol/L时,HcMYB3基因的表达量与对照相比无明显变化,可能高浓度盐胁迫抑制了该基因的表达。
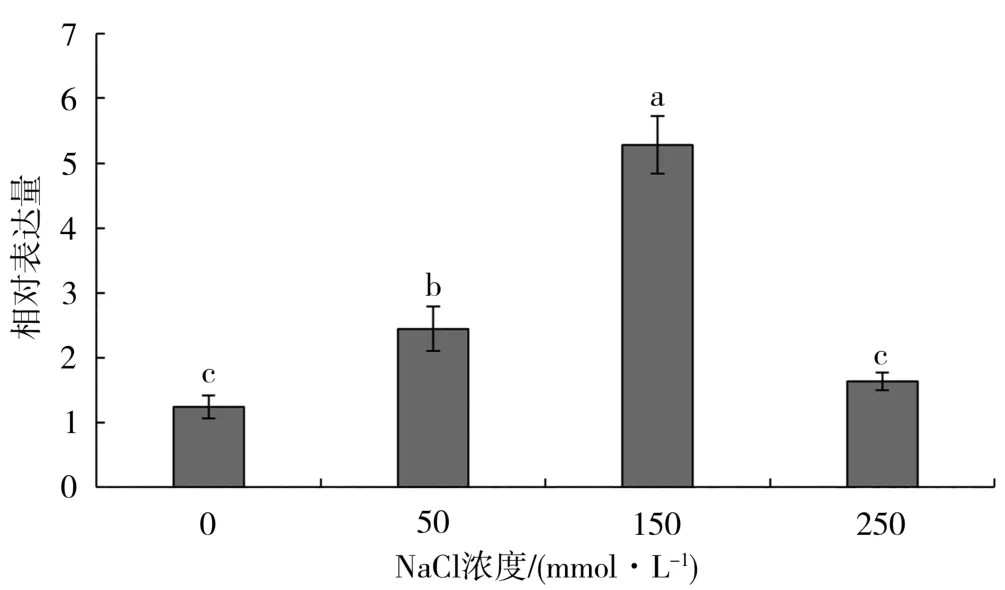
图10 盐胁迫下红麻幼苗HcMYB3基因的表达水平Fig.10 Expression levels of HcMYB3 gene in kenaf seedlings under salt stress
3 讨论
MYB转录因子参与众多生物学过程,功能广泛,主要参与植物激素转导、细胞周期调控、叶片形态建成、次生代谢和胁迫应答等过程,并作为端粒结合蛋白参与保护染色体结构和功能。然而,目前MYB转录因子的深入研究主要集中于拟南芥、水稻和大豆等植物,在红麻中鲜有报道[20-22]。本研究从红麻盐胁迫下转录组数据中筛选出HcMYB3基因,获得该基因完整的CDS序列后成功对其进行克隆,并对其进行生物信息学分析和盐胁迫响应分析,为更好地开展红麻MYB转录因子研究奠定基础。
对克隆的HcMYB3基因ORF区段进行生信分析,发现该基因具有两个MYB特有的DNA结合域,是一个R2R3类MYB转录因子,位于红麻第4条染色体上,全长为675 bp,推测其编码224个氨基酸,主要在细胞核中行使转录激活或抑制功能,并且与木槿的亲缘关系最近。目前,在非生物胁迫方面关于MYB3基因的研究取得了一定进展。苎麻BnMYB3基因在镉胁迫下明显上调,桃PpMYB3基因的表达量与环境温度变化趋势相一致,可能参与调控植物对温度的响应[23-24]。此外,利用酵母双杂交技术发现苜蓿MtMYB3显著抑制了冷适应激活因子MtCBF4的表达,并且过表达该基因显著降低了植物耐寒性,表明MtMYB3可能负调控植物耐寒性[25]。在植物激素响应方面,甘薯IbMYB3和梁山慈竹DfMYB3均受到脱落酸(ABA)和赤霉素(GA)的诱导[26-27]。综上所述,MYB3基因可能参与调控植物非生物胁迫响应。
在本研究中,中低浓度盐(50、150 mmol/L NaCl)胁迫诱导HcMYB3基因显著上调,其中150 mmol/L NaCl处理诱导该基因上调了3.78倍,而高浓度盐(250 mmol/L NaCl)胁迫并未明显诱导该基因表达,表明该基因可能参与调控红麻盐胁迫响应。本研究结果与前人关于盐胁迫下甘薯和枳中IbMYB3和PtrMYB3基因的研究结果一致[26,28],即盐胁迫能使MYB3基因上调表达。但关于MYB3基因对植株耐盐性的调控作用,这两项研究得出了相反的结论。在拟南芥中对来自甘薯的IbMYB3基因异源超表达增强了植株耐盐性,表明该基因具有增强植物耐盐性的潜力[26]。而利用病毒诱导的基因沉默(VIGS)技术使枳的PtrMYB3基因沉默后显著增强了植物的耐盐性,并且在烟草中过表达该基因会损害植物耐盐性,表明该基因负调控植物耐盐性[28]。因此,HcMYB3基因在红麻耐盐方面具体拥有何种调控作用,后续还需通过转基因技术进行验证。
4 结论
本研究从红麻幼苗中克隆出HcMYB3基因。生信分析结果表明:HcMYB3蛋白的二级结构数量由多至少依次为无规则卷曲、α螺旋、延伸链、β转角,该蛋白具有酸性、不稳定、亲水性、不跨膜、不含信号肽的特性,与木槿HsMYB3同源性最高。盐胁迫下红麻幼苗叶片中HcMYB3基因的qRTPCR结果显示,盐胁迫诱导该基因表达上调,表明HcMYB3基因参与调控红麻耐盐应答。

