红碱淖浮游动物群落结构特征及其与环境因子的关系
白海锋,宋进喜,龙永清,刘 刚,张星朗,袁永锋,李引娣
〔1.陕西省地质环境监测总站(陕西省地质灾害中心),陕西 西安 710054;2.自然资源部陕西西安地裂缝与地面沉降野外科学观测研究站,陕西 西安 710054;3.西北大学城市与环境学院/ 陕西省地表系统与环境承载力重点实验室,陕西 西安 710127;4.中国水产科学研究院黄河水产研究所(陕西省水产研究所),陕西 西安 710086;5.大连海洋大学水产与生命学院/ 辽宁省水生生物学重点实验室,辽宁 大连 116023〕
水域生态系统中,浮游动物作为初级消费者在食物网中占据重要角色,在生物地球化学循环、能量流动以及信息传递等生态过程中起着至关重要的作用[1]。浮游动物通过捕食者对浮游植物的群落结构产生下行效应,同时作为食物对鱼类和其他水生生物产生下行效应,影响着水生态系统的生物资源消耗补充量和容纳量[2-3]。浮游动物在其周围环境因子影响下有着极其敏感的变化,其群落结构与生态环境变化密切相关,其中水文、水化学、水生生物以及人类活动等对浮游动物群落结构和多样性有重要的影响[4-6]。此外,由于不同类群的浮游动物对外界环境变化的敏感性和适应能力存在差异,利用其种群结构、现存量以及优势种和污染指示种等的变化可间接反映水质状况和健康程度,以弥补水体理化指标在水质评价上的不足[7]。近年来相关研究显示,浮游动物的群落结构和多样性可准确反映水质特征及其变化趋势[8-9]。因此,了解和掌握浮游动物群落结构的变化及其与水环境因子的关系有利于制定或调整水生态系统修复和保护计划[10-11]。
湖泊是陆地水圈的重要组成部分,对全球气候变化及人类影响非常敏感,尤其对于降水量较少的内陆沙漠湖泊,由于其特殊的地理位置和较为极端的环境条件(如辐射强、蒸发量大、缓冲能力弱、营养水平低等),水生态系统相对简单,对环境的响应表现更迅速、更敏感,环境的细微变化能显著影响沙漠湖泊的理化性质,从而引起水生生物群落结构的变化,对湖泊生态安全造成影响[12-13]。因此,对沙漠湖泊水环境质量进行评价,探讨湖泊水生生物群落的特征、演变规律并提出保护措施是维护湖泊的生态服务功能、制定湖泊生态环境保护和修复政策的基础[14],对揭示湖泊生态系统功能的变化、预测生态系统对当前以及未来环境变化的响应具有重要意义。
红碱淖地处中国西北沙漠与黄土边界带,在水文地质上属于黄河中游鄂尔多斯高原内流区,历史上是我国最大的沙漠淡水湖。红碱淖是陕西与内蒙古的边界湖泊,也是陕西省重要的中型淡水湖泊,具有蓄水、泄洪、运输、养殖、旅游、科研等多种功能与价值,为此有许多学者就其资源增值和湿地保护进行了大量研究和探讨[15-16]。该湖现为世界濒危动物——遗鸥的重要栖息地,当地政府也日渐重视鸟类保护工作,相继建立了鸟类保护站并划设了鸟类保护区,对维系区域生态平衡具有重要意义。但是,近年来由于全球气候变暖的影响,红碱淖入湖径流减少,湖泊水位急剧下降,湖水pH值呈升高趋势,淡水湖成为了微咸水湖,水生生物多样性遭受巨大影响,水环境的强烈变化严重威胁着湖泊生态平衡,许多生态功能相继丧失[17]。针对红碱淖湖区的生态保护问题,陕西与内蒙古经过协商,制定了3 a补水300万m3的生态修复计划,并于2016年10月中旬开始补水100万m3,湖区水位上升,pH值呈下降趋势,水生生物多样性逐渐提高。历史资料显示,红碱淖水生生物的调查研究仅见20世纪八九十年代至21世纪初[18-19],对于经历了几十年的生产养殖和自然生态修复,尤其是近些年通过内蒙古扎萨克水库补水后,该湖的水质以及水生生物群落变化鲜见详细的调查研究。基于此,笔者于2016—2017年对红碱淖的浮游动物群落结构进行了全面调查和分析,以期为全面了解红碱淖浮游动物的群落结构特征及季节变化趋势提供数据参考,同时也为该湖区水质调控和流域生态保护提供理论依据。
1 研究区与研究方法
1.1 研究区与调查点位
红碱淖(39°04′~39°08′ N,109°50′~109°56′ E)海拔980~1 200 m,湖区东西最宽处10 km,南北最长处12 km,湖水最深为12 m。20世纪70年代,湖泊面积基本稳定在60 km2,水量约为4.9×108m3,20世纪90年代后,湖区面积呈逐年萎缩趋势,由1999年的50.27 km2减少到2015年的31.05 km2,减少了37.79%[20]。根据红碱淖的地理形态、水文条件以及浮游动物的采样要求,在湖区明水区自西向东设置10个采样点(H1~H10,图1)。其中,H1和H2位于蠎盖兔河和孙道沟河入湖区,H4位于尔林兔河和七卜素河入湖区,H5位于扎萨克河和壕赖河入湖区,H3和H10位于人类活动区(水上乐园、游艇码头),H8位于遗鸥保护区,H6、H7、H9位于湖中心区。于2016年5月(春)、8月(夏)、11月(秋)和2017年1月(冬)采集调查中上层水样,并进行水质检测与生物鉴定分析。
1.2 样品采集与处理
小型浮游动物:轮虫和原生动物定性样品用25#浮游生物网在水面下以“∞”字形拖拽采集,并用φ为4%~5%甲醛溶液固定。定量样品用5 L有机玻璃采水器取中上层混合水样1 L,现场加入φ为1.0%~1.5%鲁哥氏液固定;大型浮游动物:枝角类和桡足类定性样品用13#浮游生物网在水面下以“∞”字形拖拽采集,并用φ为4%~5%甲醛溶液固定。定量样品用有机玻璃采水器取50 L中上层混合水样,用25#浮游生物网过滤收集于50 mL样品瓶中,现场加入φ为4%~5%甲醛溶液固定[21]。采集固定好的样本在实验室静置24 h后虹吸浓缩至约30 mL,参照文献[22-23],在100~400倍Olympus-CX21生物显微镜下进行浮游动物种类的鉴定和定量。

图1 红碱淖位置及采样点位示意
1.3 水质监测
现场采用YSI-85型便携式水质分析仪测定水温(WT)、pH值、溶解氧(DO)浓度、盐度(SAL)、电导率(EC),使用塞氏盘测定透明度(SD)、水深(WD);在各采样点取中上层混合水样2 L,低温保存于48 h内送往实验室测定总氮(TN)浓度、总磷(TP)浓度、氨氮(NH4+-N)浓度、亚硝酸盐(NO2--N)浓度、硝酸盐(NO3--N)浓度、磷酸盐(PO43--P)浓度、化学需氧量(CODMn)、硬度(HARD)。水质分析参照文献[24]。叶绿素(Chl-a)浓度分析方法参照 HJ 897—2017《水质叶绿素a的测定 分光光度法》。
1.4 数据分析
1.4.1多样性指数
浮游动物Shannon-Weiner多样性指数(H′)、Pielou均匀度指数(J)计算公式分别为
H′=-∑Pilog2Pi,
(1)
Pi=ni/N,
(2)
(3)
(4)
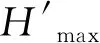
1.4.2优势种
优势种的确定采用优势度(Y)计算公式为
Y=fi×Pi。
(5)
式(5)中,fi为第i个物种的出现频率。Y≥0.02确定为优势种。
1.4.3综合营养状态评价
选取Chl-a浓度作为基准指数,TN浓度、TP浓度、SD和CODMn作为附加指数参数,运用综合营养状态指数法对红碱淖水体营养状况(TLI,ITL)进行初步评价。
ITL= ∑Wj×ITL,j。
(6)
式(6)中,ITL为综合营养状态指数;Wj为第j种参数的营养状态指数的相关权重;ITL,j为第j种参数的营养状态指数。
采用0~100的连续数字水体营养状态分级,同一营养状态下,指数值越高,其营养程度越严重:ITL<30为贫营养,30≤ITL≤50为中营养,50
所有数据统计分析采用统计软件SPSS 17.0进行处理,利用CANOCO 4.5软件包分别对环境因子进行主成分分析(PCA),对浮游动物进行去趋势对应分析(DCA),如果4个轴中梯度最大值超过4,属于单峰型模型,使用典范对应分析(CCA),如果小于3,属于线性模型,使用冗余分析(RDA),通过前向选择和膨胀因子分析对主要环境因子进行筛选,去除自相关变量,判断显著影响浮游动物群落结构时空格局的驱动因子,每一步都采用蒙特卡洛置换检验。
2 结果与分析
2.1 水体理化特征和季节变化规律
调查期间,红碱淖年平均水深变化幅度不大,季节性不明显,采样点最深处为5.6 m,最浅处为0.8 m,年均水深为3.0 m。水温随气温的变化而变化,存在显著性季节性差异(P<0.05),全年水温最高为22.4 ℃(夏季),最低为0.8 ℃(冬季),年均水温为11.0 ℃。湖水透明度总体变化较大,最大值出现在春季,为160 cm,年均透明度为79.6 cm,春冬两季变化明显。湖水碱性较大,pH值平均为9.67,年际变化范围在9.26~9.91。ρ(DO)夏冬两季差异较大,冬季最低,平均为0.83 mg·L-1,夏季较高,均值达7.74 mg·L-1。电导率和盐度季节性差异均不显著(P>0.05),最高值均出现在夏季(表1)。
红碱淖ρ(TN)为1.14~2.31 mg·L-1,年均值为1.59 mg·L-1,秋冬两季差异不大。ρ(TP)为0.10~0.26 mg·L-1,年均值为0.16 mg·L-1,最高值出现在夏季。N/P比为5.5~18.5,最高值出现在春季。氨氮、亚硝酸盐和硝酸盐含量平均值分别为0.16、0.01和1.18 mg·L-1,最大值均出现在春季。ρ(PO43--P)年平均值为0.30 mg·L-1,最低值出现在秋季H1采样点(0.15 mg·L-1)。CODMn平均值为13.83 mg·L-1,4个季节差异显著(P<0.05)。硬度平均值为292.86 mg·L-1,春夏季与秋冬季存在显著差异。ρ(Chl-a)为0.76~1.72 μg·L-1,年均值为1.11 μg·L-1,最高值出现在秋季(表1)。
红碱淖富营养指数TLI值变化范围在52.30~54.14之间,TLI值的季节变化趋势为春季>冬季>夏季>秋季,全年处于轻度富营养水平。

表1 红碱淖水体理化指标季节变化
2.2 浮游动物特征
2.2.1浮游动物种类组成及优势种
此次季节性调查共发现浮游动物4大类30属35种,其中轮虫12属15种,占总种类数的42.86%;原生动物10属11种,占总种类数的31.43%;枝角类4属5种,占总种类数的14.29%;桡足类4属4种,占总种类数的11.42%。浮游动物种类组成空间变化如图2所示,H1和H10年均种类数较多,H6年均种类数较少,其中H1秋季种类数最多,有14种,H6夏季种类数最少,有1种。从季节分布来看,秋季浮游动物种类最多,有24种,原生动物占33.33%,轮虫占33.33%;春季浮游动物种类数最少,有10种,原生动物占30.00%,轮虫占50.00%(图2)。浮游动物种类组成时空差异不大,种类数时空变化明显(表2、图2)。

表2 红碱淖浮游动物种类组成及分布

图2 浮游动物种类空间分布和的季节变化
红碱淖浮游动物优势种以轮虫和原生动物为主,轮虫优势种有8种,分别为唇形叶轮虫(Notholcalabis)、钩状狭甲轮虫(Colurellauncinata)、角突臂尾轮虫(Brachionusangularis)、长足疣毛轮虫(Synchaetalongipes)、厚实椎轮虫(Notommatapachyura)、螺形龟甲轮虫(Keratellacochlearis)、刺簇多肢轮虫(Polyarthratrigla)、西藏叶轮虫(Notholcatibetica),原生动物优势种有7种,分别为阔口游仆虫(Euploteseurystomus)、螺旋形扁壳虫(Lesquereusiaspiralis)、绿急游虫(Strobilidiumviride)、中华似铃壳虫(Tintinnopsissinensis)、纵长膜袋虫(Cyclidinumelongatum)、小口钟虫(Vorticellamicrostoma)和针棘刺胞虫(Acanthocystisaculeata)(表3)。全年优势种有9种,优势度在0.023~1.038之间,其中冬季优势种最多,达9种,优势度在0.022~0.221之间;春季优势种次之,为6种,优势度介于0.024~0.094之间;夏季优势种最少,有4种,分别为角突臂尾轮虫、刺簇多肢轮虫、虱形大眼溞(Polyphemuspediculus)和汤匙华哲水蚤(Sinocalanusdorrii)。浮游动物优势度最高的种类出现在秋季,为小口钟虫,优势度高达0.221。
2.2.2浮游动物密度和生物量
红碱淖各调查点浮游动物密度变化范围为4.2~326.3 L-1,年均值为61.9 L-1,其中桡足类密度占比最高,占浮游动物总密度的41.48%,轮虫占比较小,为18.44%。夏季浮游动物密度均值最大,为126.8 L-1,其中桡足类占48.82%,春季最小,为15.1 L-1,其中桡足类占42.22%。浮游动物密度变化趋势呈现夏季>秋季>冬季>春季,浮游动物密度季节差异显著(P<0.05)(图3)。空间分布上,H7浮游动物年均密度最大,为119.6 L-1,H8最小,为26.0 L-1,各调查点浮游动物密度存在明显差异。
浮游动物生物量变化范围为0.001~1.138 mg·L-1,年均值为0.193 mg·L-1。桡足类、枝角类、轮虫及原生动物生物量占总生物量的79.27%、13.47%、7.25%和0.518%。夏季浮游动物生物量均值最高,为0.528 mg·L-1,其中桡足类占80.68%;春季最低,为0.036 mg·L-1,其中桡足类占75.00%。生物量季节变化趋势与密度相同(图3),季节差异显著(P<0.05)。空间分布上,H7浮游动物年均生物量最大,为0.352 mg·L-1;H8最小,为0.029 mg·L-1,各调查点浮游动物生物量存在差异(图4)。
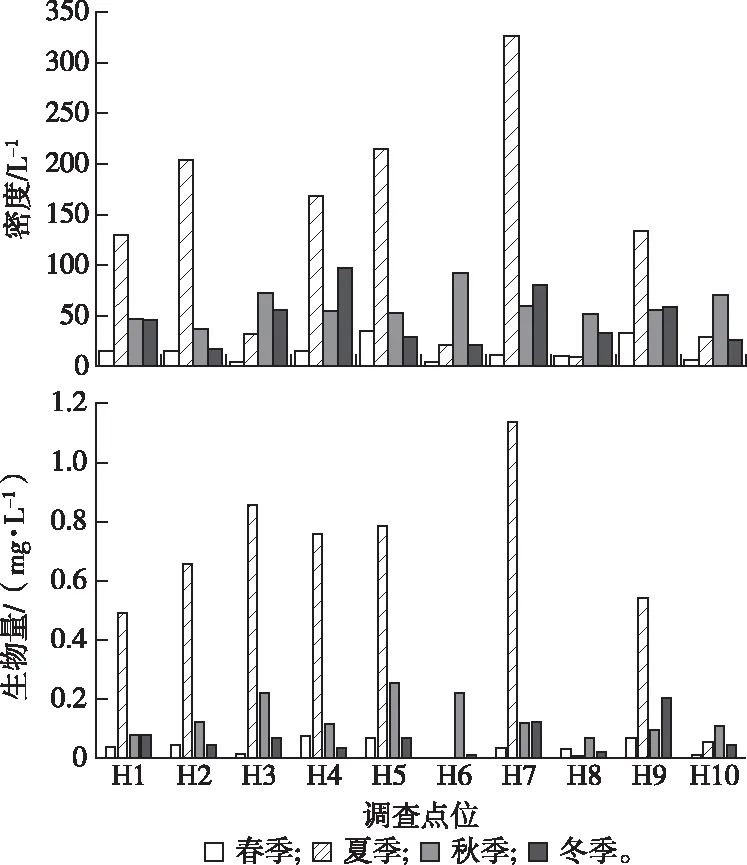
图4 红碱淖浮游动物密度和生物量的空间变化
2.2.3浮游动物多样性
浮游动物Shannon-Weiner多样性指数(H′)、均匀度指数(J)的季节变化见图5。H′年均值为2.040,变化范围为0.043~3.465,季节变化呈现秋季>冬季>夏季>春季,秋季与春夏两季差异显著(P<0.05)。J变化范围为0.043~0.910,年均值为0.712,季节变化呈现冬季>秋季>春季>夏季,四季无显著性差异。在空间分布上,H′最大值出现在秋季的H1,最小值出现在夏季的H6。J最大值出现在夏季的H1,H6均匀度指数最小。

箱图上下横线分别表示最大值和最小值,方框表示50%变异区间,方框中横线表示对应指标的中位数。
2.3 浮游动物与环境因子的关系
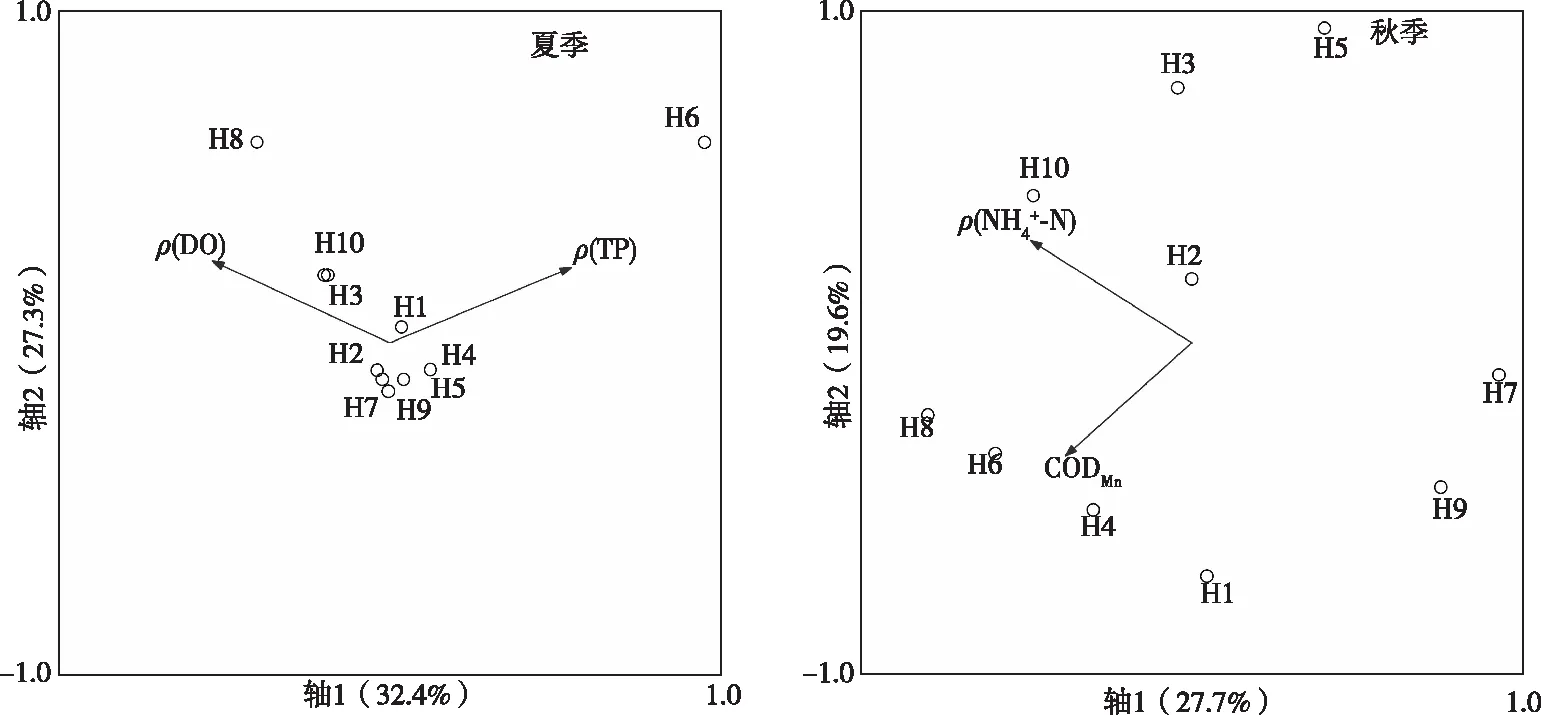
DCA分析表明,春季和冬季的4个排序轴中梯度最大值分别为2.70和2.97;RDA分析表明,夏季、秋季和全年的4个排序轴中梯度最大值分别为4.07、3.70和10.19;采用CCA进行生物群落与环境之间的相关性分析。环境因子通过PCA分析后获取主要的9个因子进行RDA和CCA分析。分析结果显示,第1排序轴和第2排序轴浮游动物物种与环境因子之间的相关系数均为1,相关性都很高(表4),2个物种排序轴间的相关系数和2个环境排序轴间的相关系数均为0,相关性都很小,表明排序结果可靠,能够很好地反映出物种与环境因子之间的相互关系。RDA和CCA经膨胀因子分析和蒙特卡洛置换检验显示,SD和EC对春季浮游动物群落空间分布影响显著(P<0.05),分别解释了12.1%和9.6%的信息量;pH值和SD对冬季浮游动物群落空间分布影响显著(P<0.05),分别解释了9.2%和8.5%的信息量;TP和DO浓度对夏季浮游动物群落空间分布影响显著(P<0.05),分别解释了21.4%和19.7%的信息量;NH4+-N浓度和CODMn对秋季浮游动物群落空间分布影响显著(P<0.05),分别解释了22.0%和19.8%的信息量;WT、EC和DO浓度对全年浮游动物群落时空分布影响显著(P<0.05),分别解释了41.8%、18.2%和17.6%的信息量。
春季SD与第1排序轴物种之间的相关性较强,第2排序轴物种与EC之间的相关系数较大,冬季pH值和SD与第2排序轴物种之间具有较强的相关性(图6)。夏季第1排序轴物种与DO和TP浓度之间相关性最强,秋季第1排序轴与NH4+-N浓度之间存在较强的负相关性,EC与第2排序轴物种之间存在较强的正相关性(图7)。全年排序显示,WT、EC与第1排序轴物种之间存在较强的相关性,第2排序轴与DO浓度正相关性最大(图8)。裂痕龟纹轮虫、刺簇多肢轮虫、角突臂尾轮虫和虱形大眼溞与DO浓度和WT呈正相关,说明WT和DO浓度对其生长影响较大;针棘刺胞虫、纵长膜袋虫、盘状匣壳虫和唇形叶轮虫与EC呈负相关,表明离子含量升高对其有较高的抑制作用;蒙古裸腹溞与WT呈负相关,说明其是喜低温种;小口钟虫、厚实椎轮虫、曲腿龟甲轮虫、螺形龟甲轮虫、钩状狭甲轮虫和咸水北镖水蚤与DO浓度呈负相关,说明其喜欢在低氧环境下生活。

表4 前两个排序轴特征值及浮游动物种类与环境因子排序轴间的相关性
3 讨论
3.1 浮游动物群落结构特征
浮游动物群落结构不仅受水环境、水动力及水文动态的影响,而且还受到季节与地理空间变动的影响[26]。本次调查发现小型浮游动物在总种类数中占比较高,这与姜忠峰等[27]对内蒙古呼伦湖和刘钢等[28]对青海可鲁克湖的浮游动物群落结构研究结果一致,表明红碱淖浮游动物种群组成具有北方咸水湖泊的普遍性特征。红碱淖浮游动物群落结构存在明显的季节差异,这与湖泊水温的季节性变化有关。水温越高,生物生存环境和食物资源越有利于浮游动物的大量繁殖和快速生长,所以夏季浮游动物的密度较其他季节大、生物量较其他季节高,这与陈昕等[29]在黑龙江的连环湖调查的结果基本一致。此外,秋季红碱淖的补水将上游水库与河流中的浮游生物带入了湖泊,导致补水后秋冬季浮游动物种类的增多,同时由于湖泊水位升高,水量增加,对浮游动物的数量进行了稀释,降低了秋冬季浮游动物的密度和生物量。在空间分布上,红碱淖浮游动物群落呈现出陕西段湖区优于内蒙古段湖区,其中,H7和H10分别位于遗鸥保护区和码头区,大量的遗鸥粪便和码头人类频繁活动增加了水体中营养盐和有机质含量,进而对浮游生物的群落结构造成影响[5]。调查发现浮游动物优势种以轮虫类最多,其中刺簇多肢轮虫为典型的咸水种,广泛分布于内陆盐碱水体中[30],枝角类和桡足类的优势种以蒙古裸腹溞、咸水北镖水溞和毛饰拟剑水蚤为主,这些种类对高氯度碱性水体具有耐受性[31],这表明红碱淖水体的盐碱性与浮游动物群落结构特征存在一定的相关性[32]。桡足类无节幼体是红碱淖浮游动物中出现频率最多的一类,无节幼体主要以水体中悬浮的细菌为食,细菌资源量的多寡直接影响无节幼体的生物量[33]。研究显示,无节幼体生物量在冬春季低于夏秋季,主要是因为夏秋季适宜的温度促进了细菌的生长,大量繁殖的细菌为无节幼体提供了丰富食物。红碱淖水生生物资源历年调查研究显示,浮游动物的种类数呈现下降趋势,1994年种类数为31种,2008年减少到11种,2013年降低至8种[34-36]。

H1~H10为采样点位。
H1~H10为采样点位。

图8 全年浮游动物群落与环境因子的CCA排序图
笔者研究期间浮游动物种类数上升至36种,但密度和生物量低于20世纪90年代。说明红碱淖湿地的生态环境破坏和渔业增殖放流对浮游动物群落的演替和结构的变动具有一定的影响[37]。
3.2 浮游动物群落结构与环境因子的关系
湖泊生态系统中,浮游动物的群落结构是多种环境因子在时间和空间序列上综合作用的结果,对生态环境的变化能够通过改变生存策略做出积极响应,在众多环境因子中,存在起主导作用的因子[38-39]。在环境因子中,WT是影响浮游动物群落结构变化的决定性因子[40],在湖泊生态系统中,WT一般通过2种方式影响浮游动物的种群演替,一种是直接通过影响浮游动物的生命周期来作用于浮游动物的繁殖与生长[41],另一种是通过影响浮游植物丰度来间接影响浮游动物的密度和生物量[42]。红碱淖水温的四季变化对浮游动物的群落演替影响较大,这可能与红碱淖地处北方沙漠,属寒冷性湖泊,存在明显的季节及昼夜温差有关。DO是水环境因子中重要的指标,对生物群落结构的变化影响显著,是浮游动物生长繁殖的另一个决定性因素。DO是影响轮虫密度的主要非生物因素之一,在DO不足的情况下,轮虫的生长繁殖受到限制[43]。枝角类绝大多数属于好氧型,氧气的饱和程度对其新陈代谢和繁殖发育都有直接影响。红碱淖夏秋季的高浓度DO对小型枝角类(虱形大眼溞等)的生长影响显著,导致其丰度升高、优势度增加,这与董旭峰等[44]研究结果一致,说明DO充足的水体浮游动物群落结构复杂,生物量和多样性相对较高。有研究报道,EC是衡量水环境总溶解离子含量的重要参数,与流域土地利用类型有极高的相关性,能够较好地反映出通过径流进入水体的离子总量,在人类活动频繁地区特别显著[45]。在红碱淖流域,历史上由于湖区周边土地利用类型单一,地表径流带入湖水中的离子含量相对较小,但是随着近年来湖区旅游活动的加强、湖区周边放牧量的增多,以及支流水库开闸补水量的增加,对湖水中溶解离子总量影响显著,从而对浮游动物的群落结构造成影响,呈现出原生动物群落演替(针棘刺胞虫、纵长膜袋虫和盘状匣壳虫的丰度)受湖水离子含量季节性变化影响。
3.3 浮游动物多样性指数与水质总体评价
湖泊富营养化导致湖泊生态系统受到破坏,湖泊生态保育功能降低,从而产生一系列环境问题[46]。因此对湖泊富营养化程度进行评价,探讨湖泊富营养化的特征、成因,并提出控制措施是维护湖泊的生态服务功能,制定湖泊生态环境保护政策的基础[47]。红碱淖调查发现,富营养化程度比2011年[48]有所减轻,与2013年[14]基本一致,可能是由于湖区有机物含量的减少和藻类数量的下降,年际生态补水也是很重要原因。基于浮游动物生物量-营养类型评价标准[49],红碱淖属贫营养水平,这与营养状态指数评价结果不一致,存在差异的原因可能为湖区鱼类放养结构不合理及过度捕捞,导致浮游动物丰度变化,支流上游水库的生态补水也对评价结果有一定的影响。依据浮游生物多样性指数水质评价标准[21],红碱淖水体状态存在季节差异,这与白禄军等[50]对内蒙古草原响水水库的调查结果基本一致,但与杨鸿雁等[51]对云贵高原杞麓湖的研究结果不一致,这可能由于不同区域湖库所处的地理环境和气候条件存在差异。此外,在红碱淖浮游动物优势种群中,出现了多种富营养水体的耐污种,如臂尾轮虫、龟甲轮虫和多肢轮虫等,这说明红碱淖水体受到了一定污染,存在富营养化问题。综合水体理化指标和浮游动物多样性指数的评价结果显示,红碱淖水体营养型从2011年的富营养水平转变为轻度富营养水平,污染程度从重污染降为中污染,水质状况较历史水平有所改善。
3.4 水生态环境保护
红碱淖是世界濒危动物——遗鸥的重要栖息地和保护区,对维系区域生态平衡具有重要意义。近年来由于全球气候变暖、降水量减少,导致年蒸发量增加、入湖径流量减少,湖泊水位急剧下降,湖水的pH值居高不下,独特的生态环境维系着仅有的少量耐盐碱的水生生物种群,水环境质量降低,水生态系统脆弱。目前红碱淖的水体轻度富营养化主要由于外源污染物的汇入和湖水换水能力减弱导致的盐碱化造成。自20世纪90年代以来,红碱淖受到周边农业灌溉、生态用水以及地下水开采等人为因素影响,水位急剧下降,尤其是地表水源补给河流的拦截直接导致湖水浓缩,加剧了水质盐碱化[52]。同时随着流域内人口、农牧业、工业增加以及旅游业的快速发展,大量的营养盐和有机物通过地表径流进入湖水,加剧了红碱淖的污染[48]。因此,应积极加强流域水资源保护,采取阶段性生态补水来降低水体pH值,同时严厉控制外源营养盐进入湖泊,逐渐恢复湖泊水生态系统平衡。红碱淖自2016年开始生态补水以来,水环境质量显著提高,水生生物生物量增加,多样性提高,研究证明继续进行生态补水是保护和恢复红碱淖生态环境的主要措施。控制外源性营养盐进入湖泊,主要在于对流域内农牧业生产排水及旅游活动进行有效处理和监管。同时根据湖内浅水区大型藻类及水草资源,科学合理引进和放养耐盐碱的草食性鱼类和舔食性贝类,逐渐恢复湖泊生态系统生物链,建立起良性多样的空间生态位,为保持和恢复高原沙漠湖泊生态环境创造条件。
4 结论
(1)对红碱淖浮游动物进行调查研究,共鉴定出4大类30属35种浮游动物,种类组成以轮虫占优势,其中唇形叶轮虫、西藏叶轮虫、钩状狭甲轮虫、角突臂尾轮虫、长足疣毛轮虫、厚实椎轮虫、螺形龟甲轮虫、刺簇多肢轮虫为该湖泊现阶段轮虫优势种。浮游动物密度和生物量的季节变化呈现夏季>秋季>冬季>春季。
(2)依据浮游动物对水环境因子的响应关系,RDA和CCA排序分析表明,WT、EC和DO浓度是驱动红碱淖浮游动物群落结构时空变化的主要环境因子。
(3)选用浮游动物生态学指标对该湖泊水质进行总体评价,评价结果显示该湖泊水质处于中污染状态,水体属轻度富营养类型。建议在区域气候变化和流域持续开发的背景下,控制流域营养盐的输入、积极应对水量减少及盐度升高等生态问题对维持红碱淖浮游动物群落结构和生态系统安全意义重大。

