玉米CHX 基因家族全基因组鉴定与表达分析
贾博为,金军,庄齐,董伟峰,才晓溪,孙明哲,孙晓丽
(黑龙江八一农垦大学农学院/作物逆境分子生物学实验室,大庆 163319)
植物不可移动,且生活在不断变化的环境中,往往这个环境不利于植物的生长和发育。这些不利的环境条件包括生物胁迫,如病原感染和食草动物攻击,以及非生物胁迫,如干旱、热、冷、营养缺乏和土壤中过量的金属离子。干旱、盐和温度胁迫是影响植物自然地理分布、限制农业生产和威胁粮食安全的主要环境因素。在非生物胁迫应答中,转运蛋白在重建和维持离子平衡中起到重要作用,是反应植物胁迫耐性能力高低的指标之一。
阳离子质子逆向转运蛋白(CPA,cation proton antiporter)主要参与单价阳离子的交换和转运,除了Na+与H+的转运发生逆转,还参与单价阳离子,如K+和Li+[1]等的转运。在进化关系上,阳离子质子逆向转运蛋白可分为CPA1 和CPA2 两个超家族。其中,CPA1 超家族可分为两类,包括与植物耐盐性相关、特征明确的重要调控基因,盐过度敏感1 家族(SOS1,salt overly sensitive 1)和钠氢交换蛋白家族(NHX,Na+/H+exchanger)。现有研究表明豇豆、苹果、马齿苋、花生和菊芋NHX 基因可参与调节耐盐性[2-6]。且盐胁迫下,小麦根组织中NHX 的表达上调。而CPA2 由KEA(K+efflux antiporter)和CHX(cation/H+exchanger)两个亚家族组成[7-8]。其中,CHX 亚家族成员最多,主要存在于高等植物中,参与维持pH 稳态和离子平衡[9-10]。研究表明,AtCHX17 基因主要在花粉、根和叶片中表达,且受脱落酸、高盐胁迫、酸性pH 和缺K+的诱导。AtCHX16/17/18/19 主要在拟南芥根、花及花粉中表达,对生殖生长和种子发育起十分重要的作用[11-13]。野生大豆CHX19.3 基因可促进过表达拟南芥对钾离子的吸收,并正向调节过表达拟南芥对高盐和碳酸盐胁迫的耐性,GsCHX19.3 过表达可增加正常条件下钾离子的吸收,减少钠离子的吸收或增加钠离子的外排,从而缓解盐碱胁迫引起的离子中毒[14-15]。盐芥CHX18 在玉米中的过量表达可显著提高玉米的耐盐性[16]。迄今为止发现有报道的CHX都可调控钾离子转运,并且可以在不同pH 发挥功能,这表明它们在调控碱性阳离子和pH 平衡中扮演着不同于其他CPA 超家族成员的作用[13]。
目前,CHX 基因家族已在多个植物中有报道,如拟南芥、葡萄、大豆、水稻和藻类等[10,17-19]。但是,关于玉米CHX 基因家族的研究尚未见报道。因此,研究从玉米CHX 基因入手,通过构建隐马尔科夫模型,对玉米CHX 基因家族进行了全基因组鉴定,筛选获得了16 个ZmCHXs 基因,并全面分析了其基因家族的理化性质、基因结构、基因序列、染色体定位、进化关系、保守结构域、组织表达特性和非生物胁迫表达模式,为后续更深一步解析ZmCHXs 基因耐逆功能提供理论依据和参考。
1 材料与方法
1.1 玉米CHX 基因家族成员的筛选与分析
基于已发表的拟南芥CPA 家族基因蛋白序列[17]通过HMMER 分析,构建隐马尔科夫模型,从Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)[20]数据库获得玉米全基因组和蛋白组序列信息。进一步利用SMART(http://smart.embl-heidelberg.de/)[21]和Pfam(http://pfam.xfam.org)[22]软件筛选候选蛋白,最终获得含有完整Na+/H+exchanger 结构域(PFAM 号:PF00999)的ZmCHX 家族基因。采用ExPASy(https://web.expasy.org)预测玉米CHX 蛋白的基本理化性质。利用CBS(http://www.cbs.dtu.dk)预测蛋白亚细胞定位。SMART 软件预测跨膜结构域。MEME(http://meme-suite.org/tools/meme)[23]分析玉米CHX 家族基因保守Motif。
1.2 玉米CHX 基因家族系统进化分析
采用MEGA-X 软件中的邻接法(NJ,Neighbor-Joining)构建ZmCHX、OsCHX[19]和AtCHX[17]家族系统进化树。其中,自展值(Bootstrap)设置为1000,数据处理选择Partial deletion,并设置为95%[24]。
1.3 玉米CHX 基因家族染色体定位及同源性分析
应用玉米基因组数据库Phytozome 获取基因所在染色体位置信息。基于Ortho Venn2(https://orthovenn2.bioinfotoolkits.net/home)[25]分析玉米、水稻以及拟南芥CHX 基因同源性。最终利用TBtools[26]软件绘制基因染色体分布和同源关系图。
1.4 玉米CHX 基因家族组织表达模式分析
从ePlant(http://bar.utoronto.ca/eplant/)[27]数 据 库中下载玉米CHX 家族基因组织表达数据,玉米在盐胁迫(150 mM NaCl)和冷胁迫(5 ℃)处理下的转录组数据来自黑龙江省现代农业栽培技术与作物种质改良重点实验室(NCBI 登录号:SRP307694)[28]。进一步利用TBtools 软件绘制玉米CHX 基因家族的表达热图。
2 结果与分析
2.1 玉米CHX 基因全基因组鉴定
利用已发表的拟南芥CPA 超家族蛋白序列信息[1]构建隐马尔科夫模型,以此来搜索玉米数据库,整合SMART、Pfam 和基于NCBI 的CDD 进行结构域分析,最终获得了31 个含有完整Na+/H+exchanger 结构域(Pfam 号:PF00999)的玉米CPA 基因。通过与拟南芥CPA 超家族构建系统发生树发现,其中16 个基因与CHX 家族聚合在一起,8 个基因分配到了KEA家族,剩下的7 个基因属于NHX 家族(图1)。

图1 玉米和拟南芥CPA 家族进化关系分析Fig.1 Evolutionary relationship analysis of CPA family from maize and Arabidopsis thaliana
进一步对玉米ZmCHXs 基因家族进行理化性质分析,结果如表1 所示,16 个玉米CHX 基因编码氨基酸序列从743~1141 不等,蛋白序列N 端都包含有一个Na+/H+exchanger 结构域,并且含有8~12 个跨膜结构域(表1)。等电点范围从5.95~9.03,其中6 个ZmCHXs 蛋白的等电点均大于7,偏碱性。然而,余下的10 个ZmCHXs 蛋白的等电点均小于7,偏酸性。此外,它们的亲疏水性均值在0.117~0.5 之间,表明ZmCHXs 基因都编码疏水蛋白。进一步预测蛋白亚细胞定位,结果表明16 个ZmCHXs 均定位在质膜或内质网膜上,这是转运蛋白发挥功能的结构基础。

表1 玉米CHX 家族基因的基本信息Table 1 Basic information of CHX genes from maize
2.2 玉米CHX 基因染色体定位及同源基因分析
ZmCHXs 基因染色体定位分析结果表明16 个ZmCHXs 基因分布在8 条不同的染色体上。其中8 号染色体上的基因数目高达4 个,4 号染色体上有3个,而其它染色体上只含有1~2 个(图2)。进一步基于OrthoVenn2 对玉米、水稻及拟南芥CHX 基因家族同源性分析(图2),结果表明玉米和水稻CHX 家族有16 对直系同源基因,而玉米和拟南芥CHX 家族仅有5 对直系同源基因,水稻和拟南芥直系同源基因只有4 对。这是由于玉米和水稻都是单子叶禾本科植物,具有较近的亲缘关系,基因功能也可能相似,而与双子叶植物拟南芥亲缘关系远,导致同源基因少。此外,图2 结果显示,玉米和水稻均具有2 对旁系同源基因,双子叶植物拟南芥中发现了54 对旁系同源基因,这些基因的扩张可能来自于基因复制。

续表1 玉米和拟南芥CPA 家族进化关系分析Continued table 1 Basic information of CHX genes from maize

图2 玉米、水稻和拟南芥CHXs 基因同源关系分析Fig.2 Homology analysis of CHXs in maize,Oryza sativa and A.thaliana
2.3 玉米CHX 基因家族系统发育分析
为进一步了解ZmCHXs 进化关系,利用玉米(16个)、拟南芥(28 个)、水稻(17 个)共61 个CHX 蛋白序列构建系统进化树。结果如图3 所示,与拟南芥CHX 家族分类一样[17],61 个CHX 成员可分为5 组(GroupⅠ~Ⅴ),而研究发现玉米与水稻CHX 只分成了3 组(GroupⅠ、Ⅲ和Ⅳ),缺少GroupⅡ和GroupⅤ成员[19]。其中GroupⅢ包含的成员最少,只有3 个基因,而GroupⅣ包含的成员最多,有8 个基因。这与Sze 等和才晓溪等[17-18]研究结果一致,GroupⅡ和GroupⅤ可能是拟南芥和大豆等双子叶植物特有的基因,拟南芥的GroupⅡ和GroupⅤ中缺乏玉米和水稻同源基因(图3),造成了单子叶植物玉米和水稻缺少这两个亚家族的基因。

图3 玉米、水稻和拟南芥CHXs 进化关系分析Fig.3 Evolutionary relationship analysis of CHXs from maize(Zm),O.sativa(Os)and A.thaliana(At)
2.4 玉米CHX 基因家族的序列和结构域分析
为深入解析玉米CHX 功能,对玉米其基因结构进行分析,结果发现除了ZmCHX13.2 和ZmCHX28不含有内含子之外,其他14 个ZmCHX 基因都含有1~6 个内含子不等(图4)。其中,GroupⅢ的成员最少,并且与其他两组相比UTR(Untranslated Region)结构较短。GroupⅠ和GroupⅢ基因成员中含有非编码区均在N 端,而GroupⅣ的非编码区在N 端或C端。总的来说,非编码区占比较少,且都分布在两端。
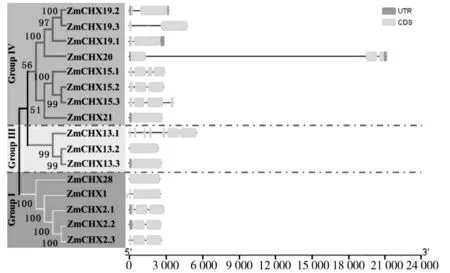
图4 玉米CHXs 家族基因结构分析Fig.4 Gene structure analysis of maize CHXs
利用NCBI 对保守结构域分析,结果表明N 端都含有保守的Na+/H+exchanger 结构域,调控Na+转运,从而维持细胞质Na+浓度保持在较低水平[29]。进一步利用MEME 软件分析16 个ZmCHX 保守基序(motif),结果如图5 显示N 端的motif 4、5、6、8、9、11 和12 共同构成了Na+/H+exchanger 结构域。并且,在此结构域的C 端紧邻一个AANH-like 结构域(由motif 2、3 和7 构成)。除此之外,在C 端还有2 保守结构域(motif 1 和10),但这些结构域的功能仍是未知的。综上能够看出这些ZmCHX 基因成员有共同的结构域,并且保守性很高。由此说明玉米CHX 家族在进化上是保守的,特别是基因结构和保守结构域的分布上。
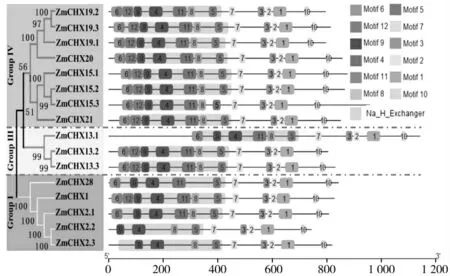
图5 玉米CHXs 保守结构域和基序分析Fig.5 Conserved domain and motif analysis of maize CHXs
2.5 玉米CHX 基因表达模式分析
基于ePlant 数据库,对ZmCHX 家族进行组织特异性分析。结果如图6 所示,玉米的CHX 基因的表达模式和已发表的大豆CHX 表达模式相似[18],都是在生殖器官中高表达,表明CHX 家族成员在生殖生长过程扮演重要角色。而在Croup IV 中,ZMCHX19.1、ZMCHX19.2、ZMCHX19.3 和ZMCHX20 在花中表达量不高,却在种子、茎、叶和根上有不同程度的表达。大部分ZmCHXs 在花药中表达量高,ZMCHX15.2 和 ZMCHX15.3、ZMCHX15.1 和 ZMCHX15.2、ZMCHX15.1 和ZMCHX15.3 这三对同源基因在各组织中表达模式相似,都是在花粉中表达量最高(图6)。据已有报道,ZmCHX15.2 的同源基因AtCHX15 在花药中高表达,而ZmCHX15.2 表现出了相似的组织表达模式,在花药中高表达。同样地,ZmCHX20 与同源基因AtCHX20 具有相似的组织表达模式,在花药中高表达[10]。

图6 玉米CHXs 基因组织表达模式分析Fig.6 Tissue expression patterns of maize CHXs
为揭示ZmCHX 在胁迫应答中的作用,基于玉米根部转录组数据分析ZmCHX 胁迫表达模式。结果如图7 所示,在冷胁迫中,ZmCHX13.3 表达量最高,GroupⅣ中ZmCHX20 表达量上调,表明这些基因能够响应玉米冷胁迫。盐胁迫下,ZmCHX19.2 和GroupⅣ中ZmCHX15.1 的表达量明显上升,表明这2 个基因可能参与盐胁迫应答。ZmCHX2.1、ZmCHX13.3、ZmCHX13.1、ZmCHX15.2、ZmCHX15.1、ZmCHX19.2在盐胁迫第三天表达量最高。在逆境胁迫下,GroupⅣ中表达量升高的成员最多,可能在胁迫应答中发挥重要的作用。

图7 玉米CHXs 基因冷和盐胁迫表达模式Fig.7 Expression profiles of maize CHXs under cold and salt stresses
3 讨论
由于植物是固着不可移动的,易受外界环境不利因素的影响。据统计,目前盐和冷胁迫对农业生产造成的损失逐年增加。盐胁迫导致细胞质钠离子浓度增加,破坏离子体内平衡。因此,过量的钠离子会抑制酶的活性[30]。因此,植物一旦受到盐胁迫,需要启动一系列信号途径来维持体内低钠离子和高钾离子含量。冷胁迫导致构成膜的脂质由液相转变为固相,即膜脂变相,引起与膜相结合的酶失活。随着基因工程和基因组测序工作的不断更新和完成,许多玉米基因组密码陆续被破解,利用生物信息学手段分析基因功能和基因家族是现代基因功能研究的一个热点。与玉米相关的基因家族研究已经有很多报道,例如玉米SPP 基因家族[31]、玉米GATA 基因家族[32]、玉米XYLPs 基因家族[33]等,这些研究为了后续深入研究功能机制奠定基础。
目前,CHX 基因家族已经在拟南芥[17]、大豆[18]、水稻[19]、以及藻类等多种植物中被报道[10]。但是关于玉米CHX 基因的研究尚未见报道。因此,研究利用生物信息学手段对玉米CHX 基因进行了系统全面的分析,共鉴定筛选出16 个玉米ZmCHX 基因家族成员。值得注意的是,玉米和水稻CHX 基因数目相近,但二者基因数目约是拟南芥的一半。家族进化和同源关系结果表明,玉米和水稻同是单子叶植物,同源基因较多。而玉米和拟南芥不同科不同属,所以同源基因较少。拟南芥多余的CHX 基因存在功能冗余[17]。利用玉米CHX 基因家族与水稻和拟南芥在一起构建物种进化树,从系统进化树和基因结构可以看出,亲缘关系相近的基因之间在保守基序和基因结构上有高度的保守性和相似性。玉米CHX 基因家族成员不均匀的分布在8 条染色体上,亚细胞定位分析表明,与拟南芥、大豆以及葡萄定位结果相似,大多数是定位在细胞膜上[34]。基因家族的扩大主要是由基因复制引起的,在植物进化过程中,复制的基因可以获得新的功能或分割现有的功能,以提高植物的适应性。不同物种在进化中都存在基因复制关系[35],根据同源性分析结果表明,玉米CHX 有2 对旁系同源基因,这说明基因复制对玉米基因家族的扩增有一定意义。
通过对玉米CHX 基因家族成员的保守基序分析发现,蛋白N 端紧邻Na+/H+exchanger 结构域和蛋白C 末端紧邻AANH-like 结构域。目前,所有已被研究的植物CHX 成员中都有植物CHX 转运体的C 末端AANH-like 保守结构域存在[17,34]。据前人报道,CHX 基因家族可以增强植物在生长发育过程中抵抗外界不利环境的能力。水稻的OsCHX14 基因主要在花中表达[7]。拟南芥的AtCHX16/17/18/19 基因在其根、花粉以及花中有较高的表达量,当拟南芥同时缺少这四个基因时,种子数量显著减少[13]。研究中玉米CHX 基因家族成员同样在花中表达量较高,表明CHX 家族基因成员可能参与开花结实等相关生物学过程。冷胁迫表达分析中,ZmCHX13.3、ZmCHX20 在冷胁迫过程中表达量上调,表明这些基因的过表达参与了低温胁迫响应。盐碱胁迫下ZmCHX15.1、ZmCHX19.2 上调表达,表明这些基因可能参与调控盐碱胁迫应答。
通过对玉米ZmCHX 基因的研究分析,为了解和分析ZmCHX 基因家族成员的功能以及在玉米成花器官生长发育的调控机制及维持细胞内离子平衡等方面奠定了一定的理论基础。后续将进一步对玉米CHX 家族基因进行功能验证。
4 结论
通过全基因组鉴定共获得16 个ZmCHXs 基因家族成员,分布在8 条不同的染色体上;系统进化将其分为3 组,且各组内蛋白序列和基因结构保守;进一步组织表达特性和非生物胁迫表达特性分析表明ZmCHXs 主要表达在花药中,且仅有Group Ⅳ基因的表达受冷及盐胁迫诱导。

