血清多配体蛋白聚糖-4、胰岛素样生长因子结合蛋白7 与脓毒症合并左心室心肌舒张功能障碍患者预后的关系
刘国凤,唐 晋,左小平
[1.广安市人民医院(四川大学华西医院广安医院)输血科,四川广安 638000;2.广安市人民医院(四川大学华西医院广安医院)重症医学科,四川广安 638000;3.广安市人民医院(四川大学华西医院广安医院)胸外科,四川广安638000]
脓毒症可导致不同程度心功能障碍,严重脓毒症或脓毒性休克患者64%存在心功能不全,其中37%为左心室舒张功能不全,27%为左心室收缩功能不全,31%为右心室舒张功能不全,与收缩功能障碍患者比较,舒张功能障碍患者对液体治疗反应性差,病死率更高[1]。左心室舒张功能障碍是脓毒症患者最常见的心肌功能障碍类型,可导致充血性心力衰竭,增加因心血管疾病死亡的风险[2]。早期识别脓毒症左心室心肌舒张功能障碍,有助于临床早期采取救治措施,降低脓毒症患者的病死率。多配体蛋白聚糖-4(syndecan-4,SDC-4)属于硫酸乙酰肝素类跨膜蛋白聚糖家族成员,在血管内皮细胞和心肌细胞中广泛表达,介导细胞间黏附、炎症反应,参与心血管损伤[3]。胰岛素样生长因子结合蛋白7(insulin-like growth factor-binding protein 7,IGFBP7)是一种细胞周期阻滞生物标志物,IGFBP7 与胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)结合抑制其活性,减弱IGF-1 促脂质代谢、抗炎、抗氧化等作用,导致心肌结构和功能改变[4]。SDC-4、IGFBP7是否参与脓毒症患者左心室心肌舒张功能障碍发病机制尚不清楚,本研究拟探讨SDC-4、IGFBP7与脓毒症左心室功能障碍患者预后的关系,报道如下。
1 资料和方法
1.1 一般资料
选择2019 年1 月至2020 年6 月广安市人民医院收治的104例脓毒症患者,纳入标准:(1)脓毒症诊断参考2018 年中国脓毒症或脓毒性休克急诊治疗指南[5];(2)年龄18 周岁以上,80 周岁以下;(3)患者及家属知情同意本研究。排除标准:(1)既往有心脏器质性疾病、心血管疾病、风湿性心脏病等的患者;(2)既往接受心脏手术治疗的患者;(3)有血液系统、免疫系统疾病的患者。
1.2 血清SDC-4、IGFBP7 浓度检测
采集外周静脉血5 mL,注入真空采血管,经3 000 r/min 离心10 min(离心半径10 cm),分离血清-80℃保存于超低温冰箱。快速解冻血清样品,ALISEI 全自动酶标仪应用酶联免疫吸附试验检测血清SDC-4、IGFBP7 浓度,试剂盒购自北京科美东雅生物技术有限公司。
1.3 超声心动图检查
采用美国Philips Sonos 7500 型心脏彩色多普勒超声诊断仪进行超声心动图检查,探头频率2.0~5.0 MHz。患者左侧卧位,平静呼吸,连接同步心电图,胸骨旁左心室长轴切面、心尖四腔、心尖两腔、心尖左心室长轴切面进行二维超声和组织多普勒技术扫描。双平面Simpson法测量左心室射血分数(left ventricular ejection fraction,LVEF),心尖方向测量舒张末期室间隔厚度(interventricular septal thickness,IVST)、左心室后壁厚度(left ven⁃tricular posterior wall thickness,LVPWT)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)。取样容积置于二尖瓣口1 cm 处启动组织多普勒模式,测量左心室舒张早期充盈峰最大充盈速度(E 值)和舒张晚期充盈峰最大峰值速度(A 值)、二尖瓣环侧壁舒张早期运动峰速度Em。计算E/A 比值,Nagueh 公式计算左心室充盈压(left ventricular filling pressure,LVFP),LVFP=1.24×E/Em+1.9(mmHg)(1 mmHg=0.133 kPa),根据LVFP将患者分为左心室心肌舒张功能障碍组(LVFP>15 mmHg,n=43)和无左心室心肌舒张功能障碍组(LVFP≤15 mmHg,n=61)[6]。所有结果均取3 个心动周期测量值的平均值。
1.4 预后分析
追踪左心室心肌舒张功能障碍组患者住院30 d 内的临床结局,根据存活情况分为死亡亚组(15例)和存活亚组(28例)。
1.5 统计学分析
SPSS 25.00 进行数据分析,采用Kolmogorov-Smirnov 法对计量资料进行拟合优度检验,符合正态分布以()表示,采用单因素方差分析(两两对比采用LSD-t检验)或独立样本t检验;偏态计量资料以[M(Q1~Q3)]表示,采用Wilcoxon秩和检验。计数资料以[n(%)]表示,采用卡方(χ2)检验。Pearson 相关系数描述SDC-4、IGFBP7 浓度与超声心动图参数之间相关性,受试者工作特征曲线(receiver operating characteristics curve,ROC)预测脓毒症左心室心肌舒张功能障碍患者预后的价值。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
左心室心肌舒张功能障碍组脓毒症休克患者比例、急性生理学及慢性健康状况Ⅱ评分(acute physiology and chronic health status Ⅱscore,APACHE Ⅱ),序贯器官衰竭估计评分(sequential organ failure assessment,SOFA)高于无左心室心肌舒张功能障碍组,差异有统计学意义(均P<0.05);两组患者年龄、性别、体质量、感染部位比较,差异无统计学意义(均P>0.05),见表1。
表1 两组患者基线资料比较 [n(%),M(Q1~Q3),]

表1 两组患者基线资料比较 [n(%),M(Q1~Q3),]
2.2 两组患者血清SDC-4、IGFBP7 浓度和超声心动图指标比较
左心室心肌舒张功能障碍组患者IVST、LVP⁃WT、LVFP 及血清SDC-4、IGFBP7 浓度高于无左心室心肌舒张功能障碍组,差异有统计学意义(均P<0.05);LVEDV、E/A 比值低于无左心室心肌舒张功能障碍组,差异有统计学意义(均P<0.05);两组患者LVEDD、LVEF 比较,差异无统计学意义(均P>0.05),见表2。
表2 两组患者血清SDC-4、IGFBP7 浓度和超声心动图参数比较 []

表2 两组患者血清SDC-4、IGFBP7 浓度和超声心动图参数比较 []
2.3 血清SDC-4、IGFBP7 浓度与超声心动图参数的相关性
血清SDC-4、IGFBP7 浓度与IVST、LVPWT、LVFP 均呈正相关(均P<0.05),与LVEDV、E/A 比值呈负相关(均P<0.05),与LVEDD、LVEF 无关(均P>0.05),见表3。
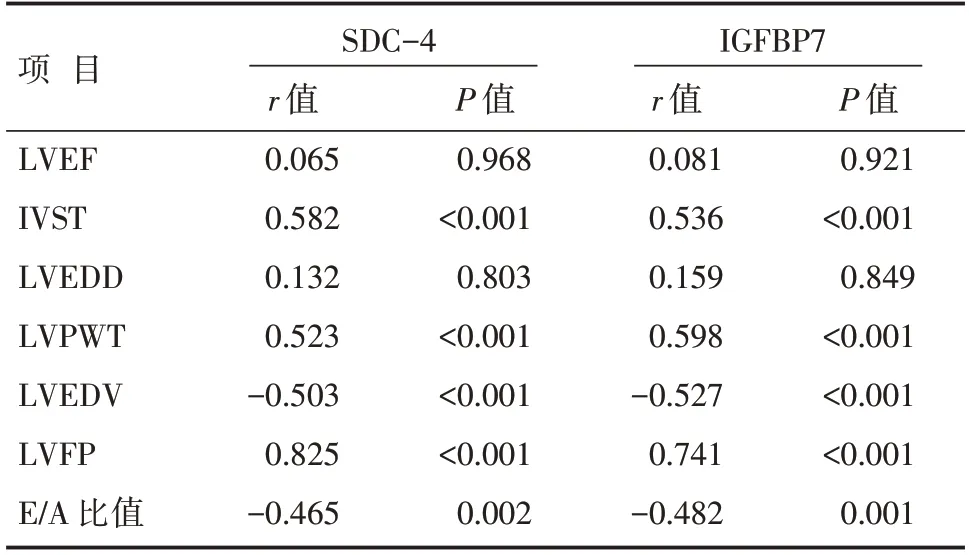
表3 血清SDC-4、IGFBP7浓度与超声心动图参数的关系
2.4 死亡亚组和存活亚组患者血清SDC-4、IGFBP7浓度比较
死亡亚组患者血清SDC-4、IGFBP7 浓度高于存活亚组,差异有统计学意义(P<0.05),见表4。
表4 死亡亚组和存活亚组患者血清SDC-4、IGFBP7浓度比较 []

表4 死亡亚组和存活亚组患者血清SDC-4、IGFBP7浓度比较 []
2.5 SDC-4、IGFBP7 预测脓毒症合并左心室心肌舒张功能障碍患者预后的价值
分别计算SDC-4、IGFBP7预测脓毒症合并左心室心肌舒张功能障碍患者预后不良的约登指数(灵敏度+特异度-100),寻找最大约登指数对应的数值即最佳截断值,分别为406.34 pg/mL、18.69 ng/mL,该界值下SDC-4、IGFBP7 预测脓毒症合并左心室心肌舒张功能障碍患者预后不良的曲线下面积(area under the curve,AUC)分别为0.788、0.852,联合SDC-4、IGFBP7 预测的AUC 为0.902,高于SDC-4、IGFBP7(z=2.615、2.123,P=0.003、0.015),见图1 和表5。

表5 SDC-4、IGFBP7、联合SDC-4 和IGFBP7 预测脓毒症合并左心室心肌舒张功能障碍患者预后不良的效能
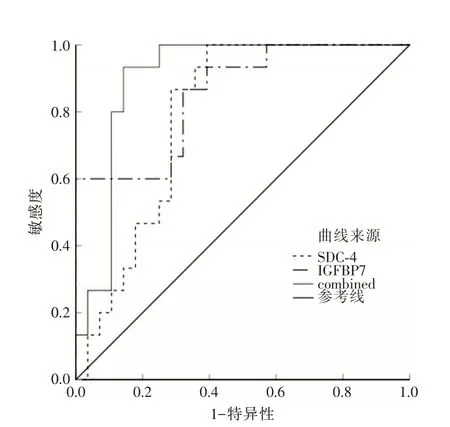
图1 SDC-4、IGFBP7、联合SDC-4 和IGFBP7 预测脓毒症合并左心室心肌舒张功能障碍患者预后不良的ROC 图
3 讨论
脓毒症全身炎症反应刺激细胞因子释放,线粒体功能障碍和组织缺氧,导致心肌细胞损伤,20%~60%脓毒症患者可发生左心室心肌舒张功能障碍[7]。炎症反应相关细胞因子可能与与脓毒症患者左心室心肌舒张功能障碍相关。
本研究发现脓毒症合并左心室心肌舒张功能障碍患者血清SDC-4 浓度明显升高,高于未合并左心室心肌舒张功能障碍患者,提示SDC-4 可能参与脓毒症诱导的左心室心肌舒张功能障碍的病理机制。SDC-4 是一种与炎症和纤维化相关的跨膜糖蛋白,介导由生长因子和细胞表面受体激活的信号转导通路,调节组织再生、血管生成、局部黏附、伤口愈合、炎症等病理生理过程[9]。氧化应激和炎症反应下Synd4 可自细胞膜脱落进入外周循环,脱落片段促进炎性细胞浸润,进一步加重组织炎性损伤[10]。SDC-4 还介导心脏肌肉LIM 蛋白的核移位[11],参与细胞外基质信号转导[12],在心脏重构中发挥重要作用,被认为是心力衰竭诊断和预后预测的标志物[13]。本研究进一步分析发 现SDC-4 浓度与IVST、LVPWT、LVFP 呈正相关,与LVEDV、E/A 比值呈负相关,说明SDC-4 浓度升高与左心室心肌肥厚和舒张功能下降有关。Takahashi 等[13]发现血清SDC-4 浓度与左心室质量指数、LVEDV 显著相关,Finsen 等[14]研究结果表明SDC-4 通过调节钙调神经磷酸酶/活化T 细胞核因子信号通路诱导心肌肥厚和功能障碍。
本研究发现IGFBP7 也参与脓毒症合并左心室心肌功能障碍过程,IGFBP7 浓度与左心室结构和舒张功能改变存在显著相关性。IGFBP7 是胰岛素样生长因子结合蛋白超家族成员,除了与IGFs 结合发挥作用外还参与细胞凋亡,增殖和迁移调控过程[15]。IGFBP7 被认为是一种衰老和纤维化标志物,在心血管系统中也有表达,在心肌缺氧、压力和容量负荷下表达升高,通过诱导心肌胶原蛋白沉积、纤维化,参与心脏结构重构和舒张功能障碍的发生[16]。Barroso 等[4]报道结果显示IGFBP-7/IGF-1 轴参与左心室舒张功能障碍过程,高浓度IGFBP-7,低浓度IGF-1 与射血分数保留的心力衰竭患者左心室舒张功能障碍有关。影像学研究显示IGFBP7 浓度升高与左心房容积指数增高[17]、E/A 比值降低[17-18]有关,IGFBP7 是急性心力衰竭的独立预测因子。分析IGFBP7 参与脓毒症左心室心肌功能障碍的机制:IGF-1 具有抗炎、抗氧化、抑制脂肪合成,心外膜脂肪堆积作用[19],IGFBP7 通过抑制IGF-1 活性,导致炎症反应扩大,血管内皮细胞产生大量活性氧,加速心肌细胞衰老,心脏脂肪堆积肥厚和纤维化进程,最终引起心室重构和舒张功能下降。同时,LVFP 升高是IGFBP7 表达和释放的重要触发因素[17],左心室功能障碍可进一步提高IGFBP7 浓度,加重脓毒症患者心肌损害程度和病情进展。
本研究结果表明,脓毒症合并左心室心肌舒张功能障碍患者死亡组血清SDC-4、IGFBP7 浓度高于存活组,SDC-4、IGFBP7 预测其预后不良的AUC 为0.788、0.852,提示SDC-4、IGFBP7 可用于预测脓毒症左心室功能障碍患者预后,在预测脓毒症合并左心室心肌舒张功能障碍预后方面具有一定价值。
综上,脓毒症合并左心室心肌舒张功能障碍患者血清SDC-4、IGFBP7 浓度明显升高,高浓度SDC-4、IGFBP7 与脓毒症患者左心室心肌舒张功能降低和预后不良有关,SDC-4、IGFBP7 可预测脓毒症合并左心室心肌舒张功能患者预后不良的发生,联合两项指标可提高预测效能。

