转基因康乃馨Moonlite品系检测用质粒标准样品研制
杨茹梦,尹 璐,钱昌元,左翠花,于海燕,*,李 想,*
(1.上海应用技术大学 香料香精技术与工程学院,上海 201418; 2.上海海关动植物与食品检验检疫技术中心,上海 200135)
康乃馨(),又名香石竹,是重要的切花品种之一,也是我国目前产量最大的花卉。康乃馨素净高雅,散发着淡淡芳香,是多种场合的首选花卉,在许多国家都具有象征意义,受人们的喜爱程度仅在玫瑰之下,并且是母亲节的官方花卉。康乃馨的鲜切花在国内外的需求量都很高,不仅用于盆栽观赏,同时还可以从花朵中提取香精作为化妆品原料。根据海关数据显示,我国花卉进出口量一直呈现上升趋势,2016和2017年我国每年康乃馨种苗和鲜切花进出口贸易总额均达100多万美元,2019年我国康乃馨出口到日本、韩国等地共计721.4万株,总价值已达112.1万美元。
在过去十几年中,全球利用现代生物技术培育康乃馨新品种的研究开展得较为广泛,并在改良花色、延长花期、耐除草剂等方面取得了成功。根据国际农业生物技术应用服务组织(International Service for the Acquisition of Agri-biotech Applications,ISAAA)的数据显示,截至2020年底,国际上已有19个转基因康乃馨品系进入商业化种植。转基因康乃馨Moonlite品系由澳大利亚Florigene有限公司和日本的Suntory有限公司开发,该品系转入了类黄酮3′,5′-羟化酶基因(3′5′)和二氢黄酮醇4-还原酶基因(),可使花朵产生紫色、淡紫色或蓝色。同时该品系也转入了磺酰脲抗性基因B(),赋予了康乃馨对磺酰脲类除草剂和一系列其他乙酰乳酸合酶(ALS)抑制性除草剂的耐受性。转基因康乃馨Moonlite品系于2004年起相继在日本、欧盟和澳大利亚批准种植。
转基因技术在培育康乃馨新品种方面已显示出独特的技术优势和广阔的应用前景,然而转基因康乃馨同其他转基因产品一样,在研发、种植和贸易中需要进行检测监管,使其符合我国《农业转基因生物安全管理条例》《农业转基因生物标识管理办法》等相关法律法规的规定。为了实现进出口转基因康乃馨的有效监管,建立检测方法、研制检测标准品十分必要。目前,课题组已完成了转基因康乃馨检测行业标准的制定,即将发布实施,但缺乏与该标准配套的转基因康乃馨检测标准品。标准样品是具有一种或多种规定特性足够均匀且稳定的材料,已被确定其符合测量过程的预期用途。转基因检测用标准品是转基因产品检测中不可或缺的物质,是获得可靠、准确检测结果的保证。根据转基因产品检测标准品的形态特征,可将其分为3类,基体标准品、基因组DNA标准品和质粒DNA标准品。其中,质粒DNA标准品是一种含有内参基因和目的基因特异性片段的重组质粒,有成本低、纯度高、均匀性好、稳定性强等优点。与来源于植物组织的标准品相比,质粒DNA标准品制备更加容易、简便,并可通过工程菌扩繁而获得大量纯度较高的样品,不受来源限制,极大地降低了研发和使用成本。同时,由于一个质粒DNA标准品中可同时包含多个检测目标序列,因此方便了来源复杂产品的转基因成分检测。为此,本研究以种植量较大、上市时间最长的转基因康乃馨Moonlite品系为研究对象,研制了质粒DNA标准样品。对其均匀性、稳定性等进行测试,同时进行特性值的测定,以期作为标准样品用于转基因康乃馨Moonlite品系的检测。
1 材料与方法
1.1 转基因康乃馨Moonlite品系质粒DNA标准样品构建
根据康乃馨内源基因序列(GenBank号AX023246.1)和转基因康乃馨Moonlite品系特异性序列信息,人工合成康乃馨内源基因1 279 bp片段和转基因康乃馨Moonlite品系特异性序列406 bp片段。将基因片段插入pcDNA3.0质粒Ⅰ酶切位点,Moonlite品系特异性片段插入质粒多克隆位点的dⅢ与HⅠ酶切位点之间,以上2个片段插入位点间距1 kb以上,构建后质粒全长7 113 bp。质粒DNA标准样品由宝生物工程(大连)有限公司合成,并且由宝生物工程(大连)有限公司和上海华大基因科技有限公司进行全序列测定。
1.2 质粒DNA提取和质量控制
采用质粒DNA小量提取试剂盒(美国,Axygen scientific公司)提取和纯化构建的转基因康乃馨Moonlite品系质粒DNA。采用微量分光光度计(美国,Thermo Scientific公司)测定DNA溶液的纯度,/应在1.8~2.0,/应大于2.0。采用DNA分子荧光定量法在酶标仪(瑞士,TECAN公司)上测定DNA浓度。采用1%琼脂糖凝胶电泳检测DNA的完整性,取1 μL DNA溶液进行电泳检测,使用凝胶成像仪(美国,Bio-Rad公司)进行影像分析,评估DNA的完整性。
采用0.01×TE(1.0 mmol·LTris-HCl,0.01 mmol·LNa-EDTA·2HO,pH值8.0)将大肠埃希菌tRNA(美国,Sigma-Aldrich公司)稀释至2 ng·μL,以2 ng·μL大肠埃希菌tRNA作为保护剂将质粒稀释至约6.75×10μL。稀释后的质粒溶液在摇床上以150 r·min10 ℃条件下混匀8 h。将混匀后的DNA溶液分装入500个旋盖离心管中,每管100 μL。
1.3 实时荧光定量PCR(qRT-PCR)反应
采用qRT-PCR测试质粒DNA标准样品的稳定性和均匀性。反应体系包括2×qPCR Master Mix 12.5 μL,上、下游引物(10 μmol·L)各1 μL,探针(10 μmol·L)0.5 μL,模板2 μL,用双蒸水将反应体系补至25 μL。PCR扩增程序为50 ℃ 2 min;预变性95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。采用的qRT-PCR仪为德国罗氏诊断有限公司LightCycler 480 II型,qPCR Master Mix购自上海辉瑞生物技术有限公司,引物和探针由上海华大基因科技有限公司合成,序列信息见表1所示。
1.4 标准曲线制备
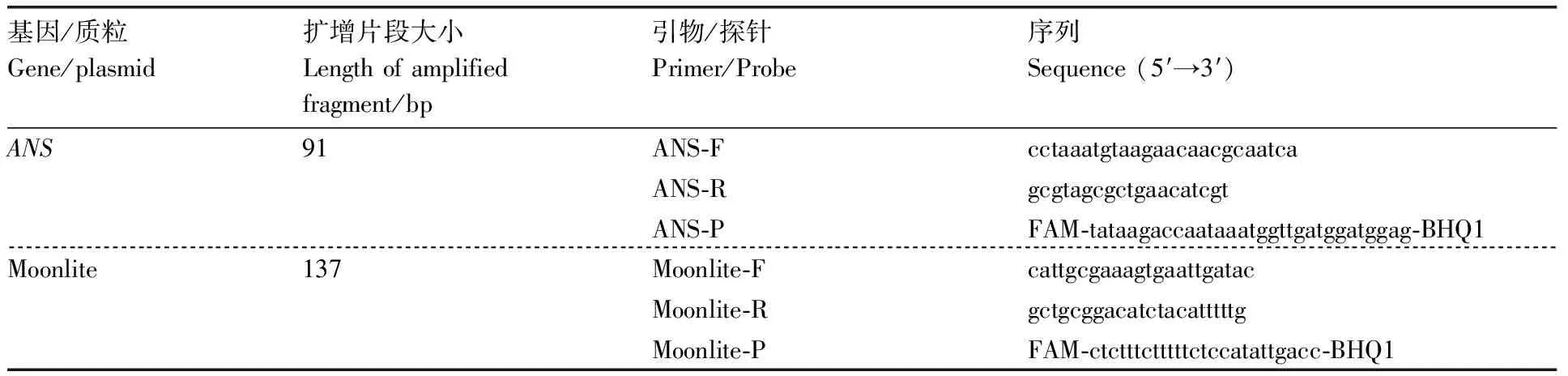
表1 引物和探针序列信息
在质粒DNA标准样品的稳定性和均匀性测试中,为了测定质粒DNA标准样品的浓度,首先分别制备康乃馨内源基因和Moonlite品系特异性序列的标准曲线。
随机抽取3管质粒DNA溶液,分别采用0.01×TE稀释至6.75×10、6.75×10、6.75×10、6.75×10、67.5 μL共5个浓度梯度。采用6个浓度的质粒DNA溶液(6.75×10、6.75×10、6.75×10、6.75×10、6.75×10、67.5 μL),构建康乃馨内源基因与Moonlite品系特异性序列的标准曲线,每个浓度重复3次。标准曲线以lg(质粒拷贝数浓度)为横坐标,以CT值为纵坐标,同时计算标准曲线线性方程,再根据线性方程计算拷贝数。
1.5 均匀性检验和最小取样量测试
采用实时qRT-PCR对质粒DNA标准样品的均匀性进行测试。随机选取15管质粒DNA,分别测定康乃馨内源基因和Moonlite品系特异性序列,每管样品每个目标序列测定3次,检测样品拷贝浓度,并采用标准JJF 1343—2012的方法进行方差分析,评估质粒DNA管内和管间的均匀性。
为了测定质粒DNA标准样品的最小取样量,设置3个加样量0.5 μL、1.0 μL和2.0 μL。随机抽取3管质粒DNA,在qRT-PCR扩增时,每管DNA每个取样量测定9次,共27次重复,对测定值进行方差分析,计算得出质粒DNA标准样品的最小取样量。
1.6 稳定性检验
为了保证质粒DNA标准样品在运输过程中仍保持活性,随机抽取12管DNA进行短期稳定性测试。在-20 ℃、4 ℃和26 ℃分别放3管DNA,放置1、2、3、4个星期。另外3管DNA在45 ℃高温条件下放置1、3、7、10、14 d。采用qRT-PCR分别测定每个时间点/温度点康乃馨内源基因和Moonlite品系特异性序列,每管样品每个目标序列测定3次。
为了测定质粒DNA标准样品的长期稳定性,将质粒DNA分别在-20 ℃和4 ℃放置1、2、3、4、6个月,每个温度条件放置3管质粒DNA,采用qRT-PCR在每个时间点/温度点分别测定2个目标序列,每管样品每个序列测定3次。
考虑到质粒DNA标准样品在使用过程中会从保存温度(-20 ℃)融化,使用后再次冷冻,而反复冻融可能造成质粒DNA的降解。为此,从500管质粒DNA中随机抽取15管进行反复冻融实验。15管DNA在-20 ℃冷冻24 h后同时取出,在冰上融化后,随机抽取3管扩增康乃馨内源基因和Moonlite品系特异性序列,每管样品每个目标测定3次,共9次重复。然后全部放回-20 ℃冷冻24 h,重复上面的实验。质粒DNA从-20 ℃拿出1次融化算冻融1次,实验共冻融25次。
1.7 定值
采用数字PCR方法测定质粒DNA标准样品的特性值。随机抽取5管质粒DNA,使用RⅠ限制性内切酶(北京宝日医生物技术有限公司)进行酶切线性化,采用数字PCR方法分别对酶切后质粒DNA中的基因和Moonlite品系特异性序列的拷贝数进行测定,每管样品每个目标序列重复测定4次。
酶切反应体系:10×Quickcut Buffer 5 μL,质粒DNA 1 μL,QuickcutRⅠ 1 μL,用无菌水补至50 μL。37 ℃放置15 min后,4 ℃放置10 min中止反应。
采用美国伯乐公司QX200型数字PCR系统进行质粒DNA标准样品定值。数字PCR反应体系包括ddPCR supermix for probes(美国Bio-Rad公司)12.5 μL,上、下游引物(10 μmol·L)各1 μL,探针(10 μmol·L)0.5 μL,模板1 μL,用双蒸水将反应体系补至20 μL。PCR扩增程序为95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环;98 ℃ 10 min;12 ℃保存。
1.8 不确定度评估
质粒DNA标准样品特征值的不确定度分别由标准样品的均匀性、稳定性和特征量值测定过程引入。通过对上述3类数据进行统计分析,根据JJF 1343—2012《标准物质定值的通用原则及统计学原理》的方法对质粒DNA标准样品的特征值进行不确定度评估。
2 结果与分析
2.1 质粒DNA标准样品构建
人工合成1 279 bp康乃馨内源基因片段和406 bp转基因康乃馨Moonlite品系5′端邻接区序列片段,分别插入pcDNA3.0载体的2个酶切位点,2个位点在质粒上距离1 kb以上,可实现多重PCR扩增中片段间互不干扰。构建后的质粒DNA标准样品pLite示意图如图1-A所示,人工合成的康乃馨内源基因片段和转基因康乃馨Moonlite品系5′端邻接区序列信息见图1-B和图1-C所示。将质粒DNA标准样品pLite DNA进行全序列测定,与公开发布的序列进行比对,结果完全一致,并且质粒DNA标准样品pLite分别含有1拷贝的基因序列和Moonlite品系特异性序列。通过电泳检测,质粒DNA条带明亮清晰,说明提取的质粒DNA质量好,条带大小与预期相符合(图2)。pLite质粒DNA的/为1.85±0.03,其浓度为(604.42±0.45)ng·μL,浓度和纯度均符合要求。
2.2 标准曲线制备
为了进一步对质粒DNA标准样品的特性和特征值进行定量测定,首先构建了康乃馨内源ANS基因和Moonlite品系特异性序列2个目标片段的标准曲线(图3),并计算标准曲线方程、和反应效率E。当以基因为扩增目标时,标准曲线方程为:=-347+4083,=0.999,E为94.17%;当以Moonlite品系特异性序列为扩增目标时,标准曲线方程为:=-358+4301,=0.999,E为90.25%。2条标准曲线均满足定量PCR方法的E在90%到110%之间和应大于0.99的要求。因此,构建的标准曲线具有较高的PCR扩增效率和良好的线性相关性,可进一步进行定量测定。
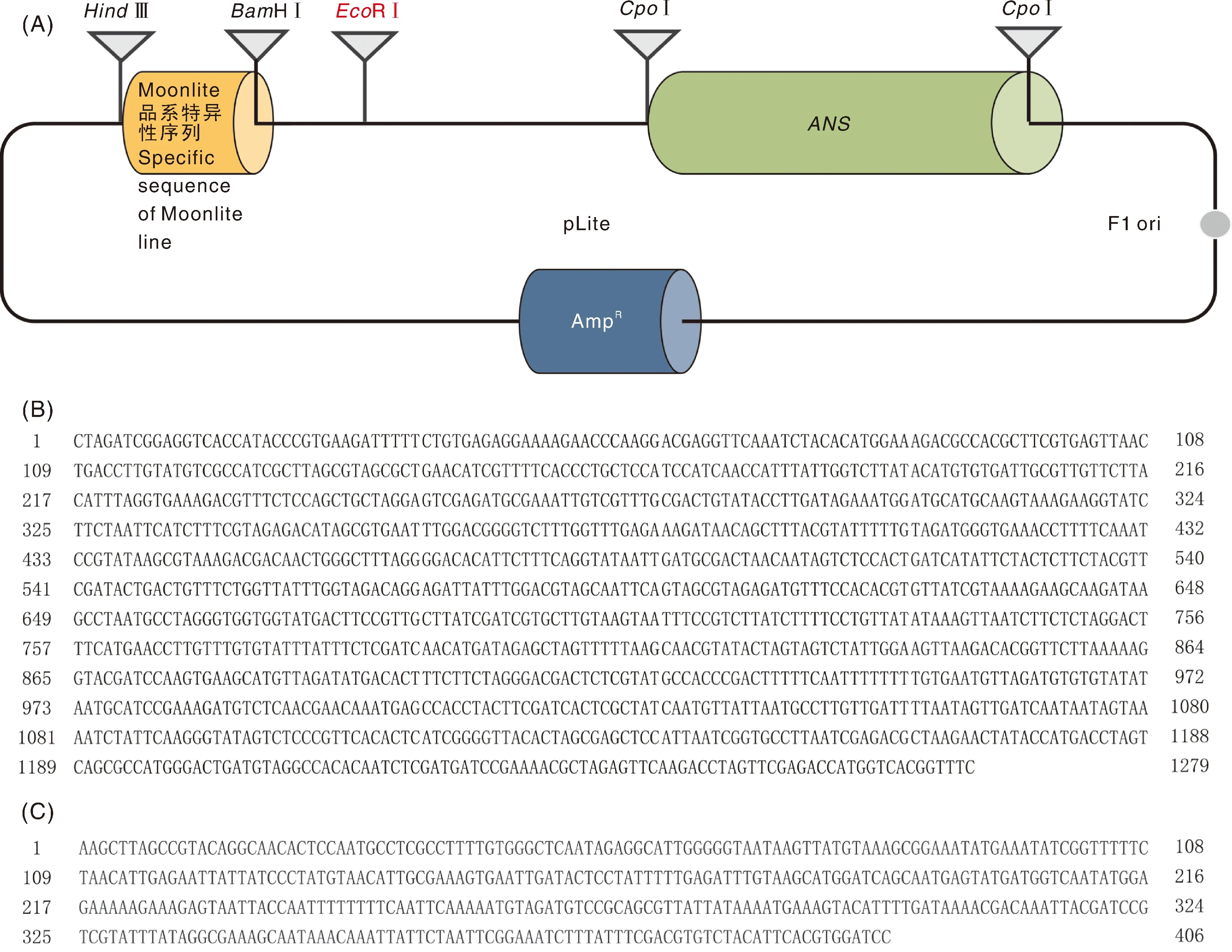
A,转基因康乃馨Moonlite品系质粒DNA标准样品pLite示意图;B,插入的康乃馨内源ANS基因序列信息;C,插入的转基因康乃馨Moonlite品系特异性序列信息。核酸片段方向均为5′→3′。A, Schematic diagram of pLite, a plasmid DNA standard sample for GM carnation Moonlite; B, Sequence of the inserted carnation endogenous gene ANS fragment; C, Sequence of the inserted GM carnation Moonlite event-specific sequence. The direction of nucleic acid was 5′to 3′.图1 构建的转基因康乃馨Moonlite品系质粒DNA标准样品示意图和序列信息Fig.1 Schematic diagram and sequences of the constructed plasmid DNA standard sample pLite for GM carnation line Moonlite
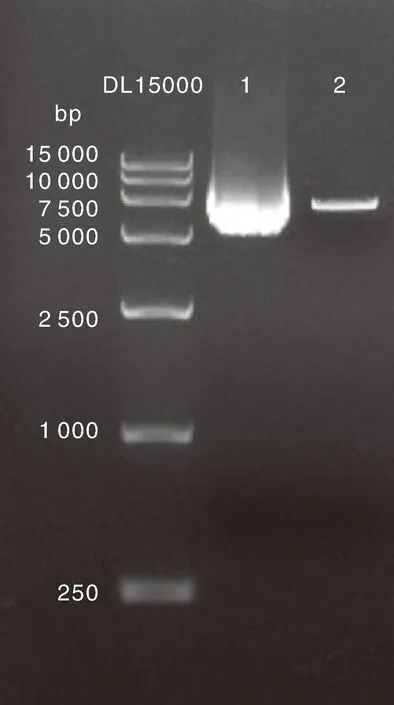
1,未线性化质粒DNA标准样品pLite;2,线性化质粒DNA标准样品pLite。1, Unlinearized plasmid DNA standard sample pLite; 2, Linearized plasmid DNA standard sample pLite.图2 质粒DNA标准样品pLite电泳图Fig.2 Electrophoretogram of plasmid DNA standard sample pLite
2.3 均匀性检验
2.3.1 均匀性检验结果
从500管分装后的质粒DNA标准样品pLite中随机抽取15管,对每个包装单元进行3次重复测定。结果表明,内源ANS基因平均拷贝数为6.30×10μL,Moonlite品系特异性序列平均拷贝数为6.29×10μL。管内与管间的均匀性分析结果如表2所示。ANS与Moonlite两个目标序列的值分别为1.61和1.14,均小于值2.04,表明变异度较小。即在95%置信水平下,标准样品均匀性良好。
2.3.2 最小取样量测定
分别取样0.5、1.0、2.0 μL进行测试,结果如表3所示。当取样量为0.5 μL和1.0 μL时,基因与Moonlite品系特异性序列2个目标片段的27次重复结果变异度较大,经检验分析结果为不均匀。当取样量为2.0 μL时,2个目标序列的值均小于临界值,表明在此取样量下质粒DNA标准样品pLite呈现均匀状态,此时基因与Moonlite品系特异性序列平均拷贝数均为6.30×10μL。因此,质粒DNA标准样品pLite的最小取样量为2.0 μL。
2.4 稳定性检验
2.4.1 短期稳定性检验
质粒DNA标准样品pLite短期稳定性检测结果如图4-A所示。在-20、4、26 ℃,4个星期内,标准样品pLite浓度均在6.27×10~6.47×10μL之间变动,标准样品的拷贝数变化范围很小,趋势比较平稳。检验结果显示,-20 ℃条件下,基因和Moonlite品系特异性序列的回归系数绝对值|β|分别为0.001 9和0.011 0,小于对应的s (β)临界值0.033 0和0.042 0。4 ℃条件下2个目标片段的|β|分别为0.018 0和0.003 5,小于对应的临界值0.043 0和0.064 0。26 ℃条件下2个目标片段的|β|分别为0.019 0和0.005 3,小于对应的临界值0.043 0和0.056 0。上述结果说明3个温度条件下,4个星期以内,质粒DNA标准样品的拷贝数变化不显著。因此,质粒DNA标准样品pLite在26 ℃及以下环境可稳定放置4个星期,适于进行冷链运输。
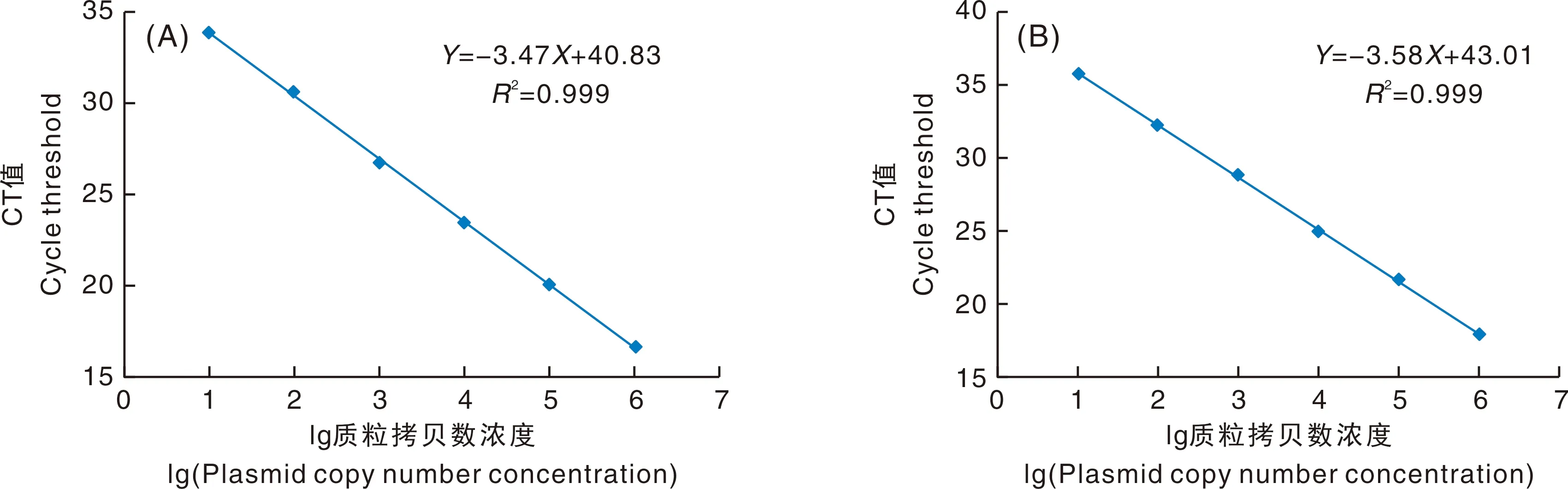
A,ANS基因;B,Moonlite品系特异性序列。A, ANS gene; B, Moonlite specific sequence.图3 质粒DNA标准样品pLite的标准曲线Fig.3 Standard curves of plasmid DNA standard sample pLite
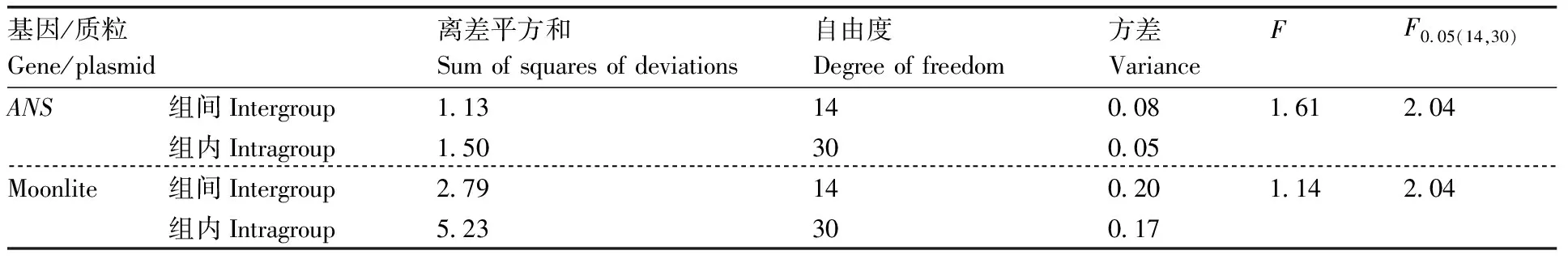
表2 质粒DNA标准样品pLite均匀性方差分析
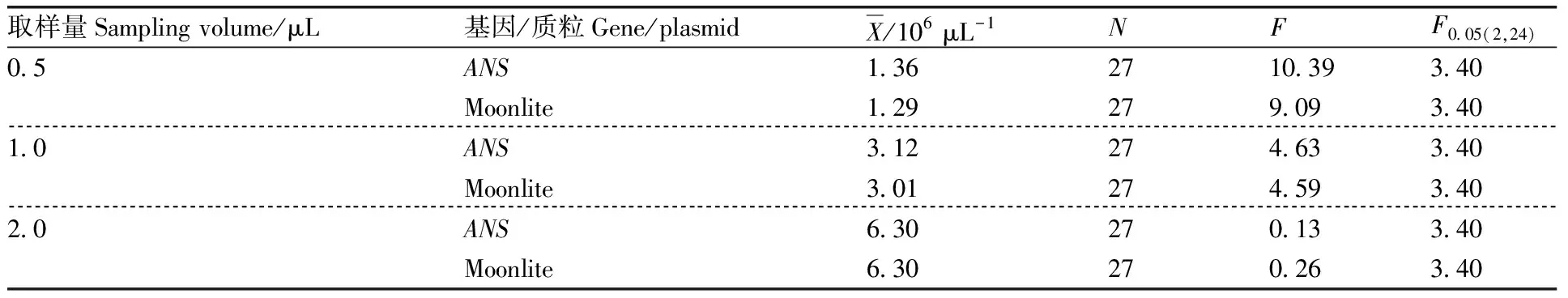
表3 质粒DNA标准样品pLite最小取样量测定
2.4.2 极端温度下稳定性检验
质粒DNA标准样品pLite在45 ℃高温条件下的稳定性结果如图4-B所示。pLite DNA放置14 d后,基因的平均拷贝数为6.38×10μL,Moonlite品系特异性序列平均拷贝数为6.36×10μL。检验结果显示,基因和Moonlite品系特异性序列的|β|分别为0.005和0.004,小于对应的临界值0.012和0.015,变化不显著。表明在45 ℃高温条件下,14 d内质粒DNA标准样品pLite拷贝数无明显变化趋势,因此,该标准样品在45 ℃环境可稳定储存14 d,可以适应运输过程中的短期极端高温环境。
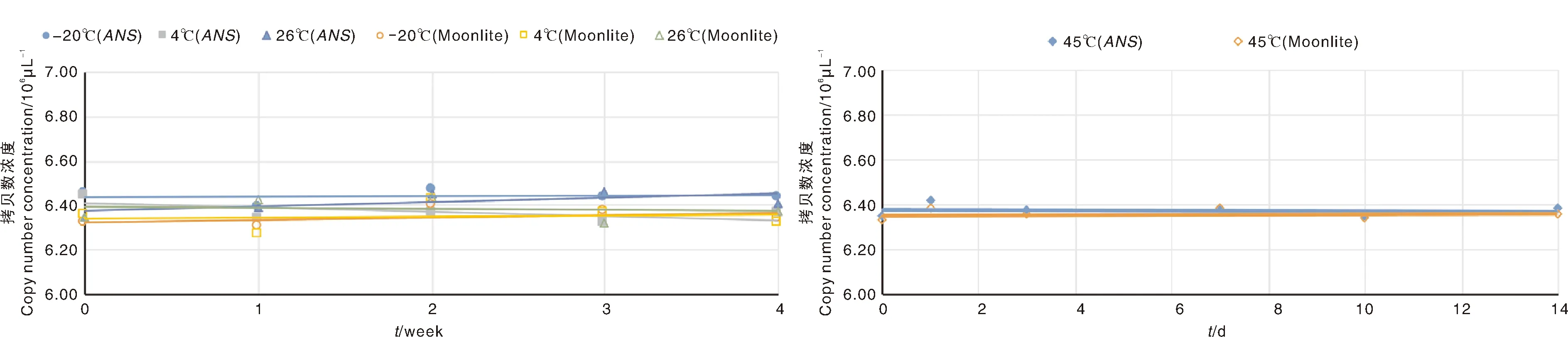
A,pLite在-20、4、26 ℃放置4个星期的稳定性变化曲线;B,pLite在45 ℃放置14 d的稳定性变化曲线。A, Stability curves of pLite under -20, 4, 26 ℃ within 4 weeks; B, Stability curves of pLite under 45 ℃ within 14 days.图4 质粒DNA标准样品pLite在不同温度条件下的稳定性变化曲线Fig.4 Stability curves of plasmid DNA standard sample pLite under different temperatures
2.4.3 长期稳定性检验
设置4 ℃和-20 ℃两个温度测定质粒DNA标准样品pLite长期稳定性。在4 ℃条件下,pLite中的基因和Moonlite品系特异性序列的拷贝数浓度分别为6.23×10~6.52×10、6.30×10~6.39×10μL;在-20 ℃条件下,2个目标序列的拷贝数分别为6.24×10~6.45×10、6.33×10~6.46×10μL(表4)。拷贝数变化幅度很小,没有随着时间的变化而呈现显著变化趋势,稳定性回归系数绝对值|β|为0.001~0.026,小于对应的阈值,表明质粒DNA标准样品pLite在4 ℃及以下温度可稳定储存6个月。
2.4.4 反复冻融实验
质粒DNA标准样品pLite反复冻融25次后,基因和Moonlite品系特异性序列的拷贝数浓度分别为6.36×10和6.30×10μL,与未冻融前起始浓度6.40×10和6.35×10μL差异不显著。检验结果表明,在95%置信区间内,基因和Moonlite品系特异性序列的|β|分别为0.001和0.003,小于对应的t阈值0.004和0.005,表明标准样品拷贝数浓度并没有随冻融次数增加而发生显著性变化。因此,质粒DNA标准样品pLite可以反复冻融至少25次,可满足实验室日常使用需要。
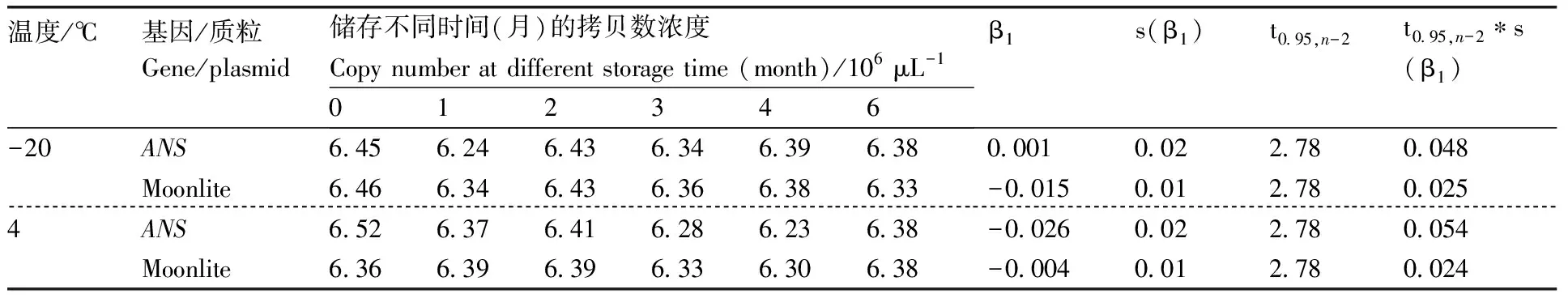
表4 质粒DNA标准样品pLite长期稳定性
2.5 定值
基于数字PCR方法,对质粒DNA标准样品pLite的拷贝数进行定值,内源基因与Moonlite品系特异性序列的数字PCR一维散点图如图5所示,拷贝数浓度结果见表5。20次测定后,基因的平均拷贝数浓度为6.13×10μL,Moonlite品系特异性序列的平均拷贝数浓度为6.10×10μL,总标准偏差分别为0.13和0.21,总相对标准偏差分别为2.11%和3.45%,均小于25%,在可接受范围内。
2.6 不确定度评估
均匀性带来的不确定度计算结果显示,分别以基因和Moonlite品系特异性序列的测定数据计算,均为0.10。稳定性带来的不确定度采用-20 ℃长期稳定性数据进行计算,结果为=0.019 0,=0.009 4。定值带来的不确定度计算结果为=0.048,=0.073。由各分量合成的合成不确定度=0.11,=0.12。计算后,扩展不确定度为0.22×10μL,为0.24×10μL,扩展因子为2。

A,康乃馨内源ANS基因;B,Moonlite品系特异性序列。A, Carnation endogenous gene ANS; B, Moonlite specific sequence.图5 质粒DNA标准样品pLite数字PCR一维散点图Fig.5 1-D scatter plot of plasmid DNA standard sample pLite by digital PCR

表5 质粒DNA标准样品pLite浓度的数字PCR结果
因此,质粒DNA标准样品pLite中康乃馨内源基因的拷贝数参考值为(6.13±0.22)×10μL,Moonlite品系特异性序列的拷贝数参考值为(6.10±0.24)×10μL。
3 结论与讨论
在医疗分子诊断、转基因产品检测、食品安全监管和生态环境安全监测等方面,准确度高、可靠性好的检测技术和相匹配的标准品是科学、规范地进行安全性评价工作的前提,借助标准品作为质控进行检测,是监管工作具有科学性和权威性的保障。在对转基因作物及其产品进行检测时,标准样品在检测过程中作为阳性对照必不可少;在对转基因成分进行定量分析时,标准样品是构建标准曲线和数据测定的基础。在转基因产品检测标准品研发方面,欧盟联合研究中心下属的标准物质与测量研究所(IRMM)起步最早,目前已研制了转基因大豆、玉米、水稻等基体标准样品近110种,质粒DNA标准样品4种。另外,美国油脂化学家学会(AOCS)也研制了转基因大豆、玉米、甜菜等基体和基因组DNA标准样品50多种。基体标准样品和基因组DNA的制备都需找到并筛选出高纯度的转基因纯合原材料,并且基体标准样品制备过程技术要求高,成本高昂,来源有限,有些转基因作物品系很难获得,因此,限制了转基因产品检测技术的发展。每年我国要进口大批量的农产品用作食品和饲料原料,其中很多是转基因产品;因此,相关实验室对转基因产品检测必需的标准品需求量很大。目前,我国转基因产品检测标准品主要还是依靠进口,不仅价格高昂,到货周期长,而且覆盖的转基因作物品系有限,不能满足转基因产品日常检测工作需求。
近年来发展起来的质粒DNA标准样品已成为一种新型标准品,其研发和使用更加灵活,且成本更低,获得了相关领域专家的认可。质粒DNA标准样品可以通过微生物进行大量培养获得,提取过程简便,纯度较高不易降解,且成本低效益高。因此,国际上越来越多的研究人员对质粒DNA标准样品展开了研究。质粒作为标准样品,在玉米、大豆、油菜、水稻等转基因作物的定性、定量检测中得到了应用。同时研究者们也研制出了可检测多个目的基因的多靶标质粒DNA标准样品。如可同时检测8个转基因油菜RF1、RF2、MS1、MS8、Topas19/2、Oxy235、RT73和T45品系的复合型标准样品,可同时检测3种转基因水稻KMD1、TT51-1和KF6品系的标准样品等。考虑到转基因康乃馨原材料很难获得,不适于研制基体标准品和基因组DNA标准品。因此,本研究采用更加灵活的质粒DNA标准样品制备转基因康乃馨检测标准样品。
本研究研制了适于转基因康乃馨Moonlite品系检测的质粒DNA标准样品pLite,其为质粒核酸悬浮液,无色透明。经测定,标准样品具有良好的均匀性和稳定性,适合长途运输,在低温条件下可至少保存6个月。对标准样品浓度进行测定,结果显示,pLite中康乃馨内源基因的拷贝数参考值为(6.13±0.22)×10μL,Moonlite品系特异性序列的拷贝数参考值为(6.10±0.24)×10μL。目前,国际上还没有转基因康乃馨检测标准品的相关报道,本研究研制的质粒DNA标准样品pLite,填补了该领域的空白,为我国转基因康乃馨的有效检测与监管提供了技术支撑。
——一道江苏高考题的奥秘解读和拓展

