不同花期蜂王浆主要成分和抗氧化活性分析
尹 欣,乔 栋,黎洪霞,刘肇龙,吴美佳,庞 杰 ,陈兰珍,
(1.福建农林大学食品科学学院,福建福州 350002;2.中国农业科学院蜜蜂研究所,北京 100093)
蜂王浆(Royal jelly)是以采集的花蜜和花粉作为初始原料,经由哺育蜂的上颚腺和咽下腺及其他腺体共同分泌而成。蜂王浆一般呈淡黄色,是具有特殊气味,口感辛辣并略有酸涩的浆状物质。蜂王浆作为天然的保健食品,含有蛋白质、有机酸、维生素、酶、多酚等多种营养物质,具有提高免疫力、抗衰老、抗肿瘤、抑菌抗炎、抗疲劳、降血压等多种生物活性功能,深受广大消费者青睐。蜂王浆具有的生物活性功能如抗衰老、美容养颜、抗肿瘤等都与蜂王浆的抗氧化能力息息相关。Kungi 等综述了蜂王浆及其组分的抗氧化能力和对蜜蜂、果蝇、鼠等生物健康的影响,发现抗氧化能力的增强是延长寿命的主要因素之一。蜂王浆抗氧化能力的强弱取决于王浆中的抗氧化成分,而采收时间及采收时期的不同可能导致王浆中抗氧化组分的差异。Liu 等研究了不同采收时间蜂王浆的抗氧化活性,48 及72 h 采收的蜂王浆中蛋白质、多酚含量和抗氧化能力均低于24 h 采收的蜂王浆,其结果表明多酚类物质可能是抗氧化活性的主要物质之一。谌迪等对比了不同月份所产蜂王浆的成分差异,结果表明不同月份蜂王浆的王浆主蛋白含量和抗氧化能力均存在显著差异。10-HDA 是王浆中特有的活性成分,其具有多种生物活性作用。Chen 等发现10-HDA 可减轻小鼠肺组织的病理变化,对一些炎症基因也具有抑制效果。Yang 等发现10-HDA 对动物和人体特有的病原菌,如金色葡萄球菌、木糖葡萄球菌和霍乱沙门氏菌等均有着强效的杀灭作用。蜂王浆本身具有许多较好的生物活性作用,而其品质优劣影响着其能否有效发挥活性作用。蜂王浆组成复杂,且在生产过程中随着生产时间的延长,受到花期(以主要蜜粉源植物命名花期,如油菜花期和多种蜜粉源植物组成的山花花期等)、蜂种、蜂群更替和地域气候等多方面因素的影响,使得蜂王浆品质无法得到准确的衡量以及判断。研究表明,蜂王浆生产过程中花蜜和花粉来源(蜜粉源植物)的差异,会影响蜂王浆的质量及其生物功能活性。但少有研究表明蜜源植物花期对蜂王浆品质的具体影响,因此有必要对不同花期所产蜂王浆主要成分及其抗氧化活性进行研究。本研究以湖北省钟祥市不同花期(油菜盛花期、油菜末花期、山花花期、葡萄花期、荆条盛花期和荆条末花期)所生产的蜂王浆为研究对象,通过合理的长期跟踪取样,排除蜂种、环境气候和地域差异等多种因素的影响,分析比较不同花期所产蜂王浆的10-HDA、总蛋白、水分和总酚酸含量的变化,并进行体外抗氧化实验,对不同花期所产蜂王浆的品质进行探索,以期为指导蜂王浆实际生产及消费者选购优质蜂王浆提供理论依据。
1 材料与方法
1.1 材料与仪器
蜂王浆 采集于湖北省钟祥市的两家蜂场,蜂种为浆蜂,蜂王均是同源繁殖而来,蜂群群势良好无病虫害,为确保实验期间采样的延续和准确性,对蜂箱进行编号标记,保证实验样品均来源于编号的蜂箱中,采样时间为2021 年3 月至6 月份,以油菜盛花期(3 月中旬~3 月底)采集的油菜王浆(YCWJ1)、油菜花末期(3 月底~4 月初)采集的油菜王浆(YCWJ2)、山花盛花期(4 月中旬~5 月初)采集的山花王浆(SHWJ)、葡萄盛花期(5 月底~6 月初)采集的葡萄王浆(PTWJ)、荆条盛花期(6 月中旬)采集的荆条王浆(JTWJ1)、荆条花末期(6 月底)采集的荆条王浆(JTWJ2)共24 个实验样本。样品采集时每批次王浆等分于50 mL 离心管中,并立即存放于-18 ℃条件下保存。在尽可能排除蜂种、地域和气候等因素影响下探究不同花期蜂王浆差异。10-HDA、对羟基苯甲酸甲酯 标准品,上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) TCI 化成工业发展有限公司;2,4,6-(2-吡啶基)-1,3,5-三嗪(2,4,6- Tri-2-Pyridyl-1,3,5-triazine,TPTZ)、没食子酸、福林酚 北京索莱宝科技有限公司;无水三氯化铁 阿拉丁试剂(上海)有限公司;盐酸、氢氧化钠、浓硫酸、硼酸、甲基红、溴甲酚绿 国药集团化学试剂有限公司;凯氏定氮催化剂片(硫酸铜混合型) 北京金元兴科科技有限公司;其余试剂均为分析纯 西陇科学股份有限公司。
1200 型高效液相色谱仪 美国安捷伦科技有限公司;2300 凯氏定氮仪、消化炉 丹麦福斯公司;XS-105DU 电子天平 瑞士梅特勒-托利多公司;VD23真空干燥箱 德国BINDER 公司;HWS-28 电热恒温水浴锅 上海一恒科学仪器有限公司;BIOOFUGE离心机 美国Thermo Scientific 公司;SpectraMax i3 酶标仪 美国美谷分子仪器;Milli-Q 型纯水器美国Millipore;KQ-500DE 数控超声波清洗器 昆山市超声仪器有限公司;QL-866 旋涡仪 海门市其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 10-HDA 含量测定 参照国标GB 9697-2008蜂王浆进行测定。
1.2.2 总蛋白测定 参照国标GB 9697-2008 蜂王浆。采用凯氏定氮仪进行实验。称取0.05 g 样品,加入1 片凯氏定氮催化剂片和3.5 mL 浓硫酸,在消化温度420 ℃条件下消化2 h,上机测定。滴定溶液:0.1 mol/L 盐酸标准溶液滴定;氢氧化钠溶液(400 g/L);1%硼酸吸收溶液(含0.1%溴甲酚绿和0.1%甲基红指示剂)。
1.2.3 水分含量测定 参照国家标准GB 9697-2008蜂王浆。使用真空干燥箱,在-0.095~-0.10 MPa,75 ℃条件下恒温干燥蜂王浆样品4 h 后,冷却至室温,称量,重复干燥至前后两次质量差少于2 mg。
1.2.4 总酚酸测定 参照高慧等的方法。配制0、0.1、0.2、0.4、0.6、0.8 和1.0 mL 的没食子酸标准溶液(100 μg/mL),标准溶液分别加入1 mL 福林酚显色试剂充分混匀,3 min 后加入1 mol/L NaCO溶液并用蒸馏水定容至10 mL 充分混匀,黑暗环境下静置反应1 h 后于760 nm 处测定吸光值,以没食子酸浓度为横坐标(x),吸光度为纵坐标(y)绘制标准曲线,0~100 μg/mL 的没食子酸标准曲线的线性方程为:y=0.58x+0.0068,相关系数=0.9988。
样品测定:精确称取5.0 g 蜂王浆样品于50 mL容量瓶中,用去离子水涡旋溶解,定容至50 mL 后,超声10 min,15000 r/min 离心10 min,取上清液的100 mg/mL 蜂王浆水溶液稀释至20 mg/mL。取浓度为20 mg/mL 蜂王浆水溶液1 mL 加入1 mL 福林酚显色试剂,混匀3 min 后加入1 mol/L NaCO溶液加蒸馏水定容至10 mL 充分混匀,黑暗环境下静置反应1 h 后760 nm 处测定吸光值,根据吸光值计算总酚酸含量。
1.2.5 DPPH 自由基清除能力的测定 参照付中民等的方法,并稍作修改。精确称取2.5 g 蜂王浆样品于50 mL 离心管中,用去离子水涡旋溶解,定容至50 mL,超声10 min,15000 r/min 离心10 min,取上清液得50 mg/mL 蜂王浆水溶液。取上述蜂王浆水溶液1 mL 与浓度为0.1 mmol/L 的DPPH 无水乙醇溶液1 mL 充分混匀后,避光静置反应30 min,在517 nm 处测定吸光值A,空白组A用1 mL无水乙醇代替DPPH 无水乙醇溶液,对照组A用蒸馏水代替蜂王浆水溶液。清除率计算公式为:
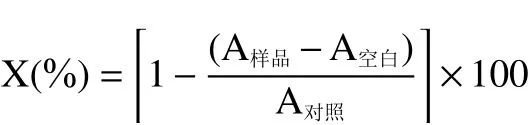
式中:X 表示DPPH 自由基清除率,%。
1.2.6 总抗氧化活性的测定 采用铁离子还原法(Ferric reducing ability of plasma, FRAP)对蜂王浆总抗氧化活性进行测定,在原有方法上进行适当修改。标准曲线:配制1 mmol/L FeSO溶液,并逐级稀释为0~0.5 mmol/L FeSO溶液,取不同稀释的FeSO溶液200 μL,加入TPTZ 工作液(300 mmol/L,pH3.6醋酸盐缓冲溶液;10 mmol/L TPTZ 溶液;20 mmol/L FeCl;三种溶液按10:1:1 比例进行混合调配即得,试剂需现配现用)1.8 mL,混匀后37 ℃下反应10 min 后在593 nm 处测定吸光值,以FeSO浓度,mmol/L 为横坐标(x),吸光度纵为纵坐标(y)进行线性回归得到标准曲线,y=1.1492x-0.0043,相关系数=0.9997。
样品测定:精确称取4.0 g 蜂王浆样品于50 mL容量瓶中,用去离子水涡旋溶解,定容至50 mL 后,超声10 min,15000 r/min 离心 10 min,取上清液得80 mg/mL 蜂王浆水溶液。取上述蜂王浆水溶液200 μL,加入TPTZ 工作液1.8 mL 混匀后在37 ℃反应10 min 后于593 nm 处测定吸光度,带入标准曲线得到蜂王浆的总抗氧化活性(mmol/L)。
1.3 数据处理
通过SPSS 24.0 软件进行多组样本间差异显著性分析和相关性分析,数据以平均值±标准差表示。使用Graphpad Prism 8 软件进行单因素方差分析(One-way ANOVA)并绘图。<0.05 和<0.01 分别为显著差异和极显著差异。
2 结果与分析
2.1 蜂王浆中10-HDA 含量

Fig.1 The chromatogram of 10-HDA注:A:10-HDA 标准品色谱图,B:样品的10-HDA 色谱图;1:内标物峰,2:10-HDA 峰。
作为自然界中仅天然存在于蜂王浆中的10-HDA,具有抗菌抗炎、抗肿瘤、抗辐射、神经调节和降血糖等诸多生理功效,其含量也是评定蜂王浆品质高低的主要参考指标。蜂王浆样本的10-HDA色谱图见图1。不同花期蜂王浆中10-HDA 含量见图2,其中,10-HDA 含量最高的是PTWJ,含量为2.20%,远超国家标准要求的优等品(10-HDA 含量高于1.8%)界线。油菜花期YCWJ1 的10-HDA 含量为1.93%,YCWJ2 的10-HDA 含量为1.75%,仅次于PTWJ 的10-HDA 含量。含量最低的是SHWJ,10-HDA 的含量仅为1.41%,恰好达到国标要求的合格品(10-HDA 含量需高于1.40%)标准。
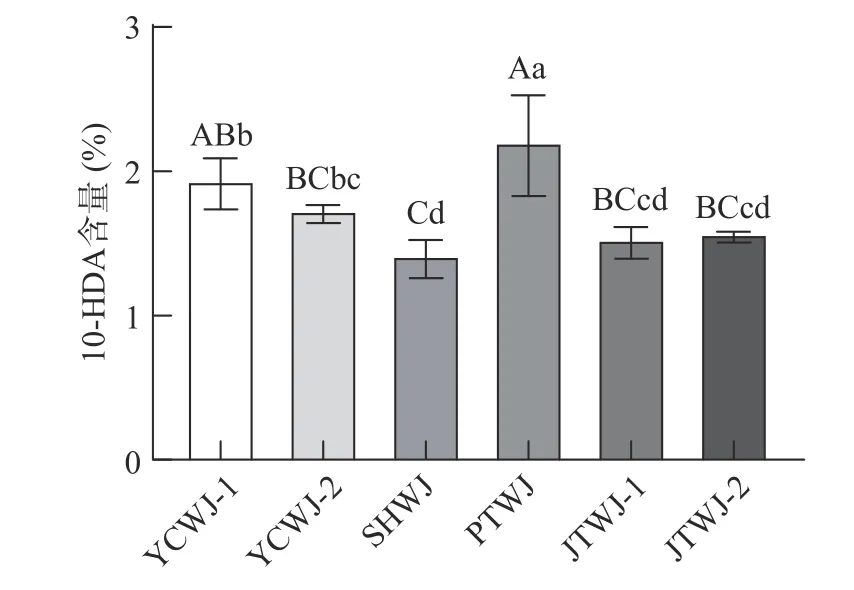
图2 不同花期蜂王浆的10-HDA 含量Fig.2 10-HDA content of royal jelly in different flowering periods
通过显著性分析发现,PTWJ 中10-HDA 的含量与YCWJ1 存在显著差异(<0.05),与其他花期所产蜂王浆的10-HDA 含量存在极显著差异(<0.01)。不同花期蜂王浆10-HDA 的含量存在显著差异,与王艳辉等的同蜂种不同花期蜂王浆10-HDA 含量无显著差异的结果不符。PTWJ 生产时期为6 月初期,平均气温为24~32 ℃,与6 月中旬生产的JTWJ1和6 月下旬的JTWJ2 的气候条件类似。其中JTWJ1 在采样时受到降雨影响,气温出现过大幅降低的情况。JTWJ2 采样时气候条件稳定,气温为25~32 ℃。同一花期内虽受到气候变化影响,JTWJ1和JTWJ2 的10-HDA 含量无显著性差异(0.05),而PTWJ 与JTWJ1 和JTWJ2 气候类似,但10-HDA含量均存在极显著差异(<0.01),说明气候因素并不是显著影响蜂王浆10-HDA 含量的主要因素。在排除气候温度差异对10-HDA 分泌影响的情况下,可知蜂蜜和蜂粮的营养质量和储备量是影响10-HDA含量的关键因素。文献表明当花粉营养质量较低或外界蜜粉源缺乏时都会影响蜂王浆中的10-HDA 含量。而在PTWJ 生产中发现巢脾中蜂蜜储备少,蜂粮充裕,但10-HDA 含量高,结果表明即使在蜂蜜储备不足的条件下,依靠葡萄花粉的营养物质依旧能够保证10-HDA 高质量的分泌。路璐等的研究也表明糖类物质对10-HDA 的分泌影响较小,推测蜂粮中某些营养物质的多寡是影响10-HDA 分泌量的关键因素。
在油菜花期间,取样于油菜盛花期YCWJ1 的10-HDA 为1.93%略高于胡元强于湖北省油菜蜜10-HDA 平均值为1.84%的研究结果,取样在油菜花期末尾阶段的YCWJ2 的10-HDA 含量为1.75%,略低于该结果。在YCWJ2 取样前有降雨,降雨进一步加速了油菜花的凋零,致使可采集的油菜花粉量急剧减少。YCWJ2 相较于YCWJ1 的10-HAD 含量有所降低,说明油菜花粉的充足是生产高含量10-HDA蜂王浆的重要保障。
SHWJ 中10-HDA 含量是各花期中最低的,SHWJ的10-HDA 含量与PTWJ 和YCWJ1 的10-HDA 含量均存在极显著差异(<0.01)。SHWJ 与YCWJ2 的10-HDA 含量相比较存在着显著性差异(<0.05)。导致SHWJ 中10-HDA 含量低于其他花期的原因之一可能是受到蜂群采集习性的影响,本研究的蜂种对象为浆蜂,作为意大利蜜蜂的变种,偏好采集大面积蜜粉源,当蜜粉源呈现零星小面积分布时,蜂群采集和繁殖积极性不高,进而影响到蜂王浆10-HDA的分泌。另一原因可能是SHWJ 生产时采集到的花粉质量良莠不齐,合成10-HDA 所需营养成分偏低,导致10-HDA 分泌量的减少。
2.2 总蛋白含量与水分含量
如表1 所示,蜂王浆总蛋白含量在13.58%~15.26%之间,符合国标要求总蛋白质在11%~16%之间的要求。其中,JTWJ2 总蛋白质含量最高达到了15.26%。YCWJ2 总蛋白含量最低仅有13.58%,且与SHWJ 和JTWJ2 的总蛋白质含量存在显著差异(<0.05)。结合YCWJ2 的10-HDA 含量分析,结果表明油菜花粉含量的降低会大幅度影响油菜蜂王浆的品质,在季节气候蜂群状态等因素基本一致能排除多数影响因素的情况下,表明蜂粮营养成分不仅影响着蜂王浆中10-HDA 的含量,同时也影响着总蛋白质含量。

表1 不同花期蜂王浆的总蛋白含量和水分含量Table 1 The total protein content and moisture content of royal jelly in different flowering periods
本次实验中所有样品的水分含量均符合国标规定的合格品(≤69.0%)的要求,并且超过了水分含量低于≤67.5%为优等品的要求。含水量较高的YCWJ1、YCWJ2、SHWJ 取样于3 月底至4 月底,气温在15~19 ℃之间,空气湿润,是较为潮湿的月份,这些环境因素间接影响着蜂王浆的含水量。而JTWJ1 样品取样时间虽是6 月中旬,但在取样前伴有降雨,气温受降雨影响由25~33 ℃降至21~22 ℃,空气湿度也明显增加,进而导致蜂王浆水分含量的升高。不同花期蜂王浆水分含量与环境之间存在联系,所处自然环境中空气湿度较高时,蜂王浆中含水量均有所上升。
2.3 蜂王浆中的总酚酸含量
蜂王浆中酚酸类物质来源于植物以及植物的次级代谢产物。工蜂采集的植物花粉花蜜中含有酚酸类物质,这些酚酸类物质在蜂巢中经过加工酿制后,转存于蜂粮和蜂蜜中,经哺育蜂进一步摄入代谢后转移至蜂王浆中。
如图3 所示,由于蜜粉源植物的不同,蜂王浆中总酚酸含量存在差异。JTWJ1 和JTWJ2 总酚酸含量最高,均与YCWJ2 和PTWJ 存在极显著性差异(<0.01)。而油菜花期的YCWJ1 和YCWJ2 相比,虽然YCWJ2 在生产时存在油菜花粉采集量减少的情况,但二者的总酚酸含量无显著性差异(>0.05)。对比荆条花期的JTWJ1 和JTWJ2,JTWJ2 在生产期间受到降雨气候影响,但JTWJ1 和JTWJ2 总酚酸含量无显著性差异(>0.05),表明降雨不会显著影响蜂王浆中总酚酸含量。综上,同一花期所产蜂王浆的总酚酸含量是保持稳定的,主要粉源供应的减少和非极端自然天气的改变不会显著影响蜂王浆中总酚酸含量的变化。而油菜和荆条花期的共同特点是蜂蜜充沛,在蜂粮和气候均有变化的情况下,同花期所产蜂王浆总酚酸仍能保持稳定。
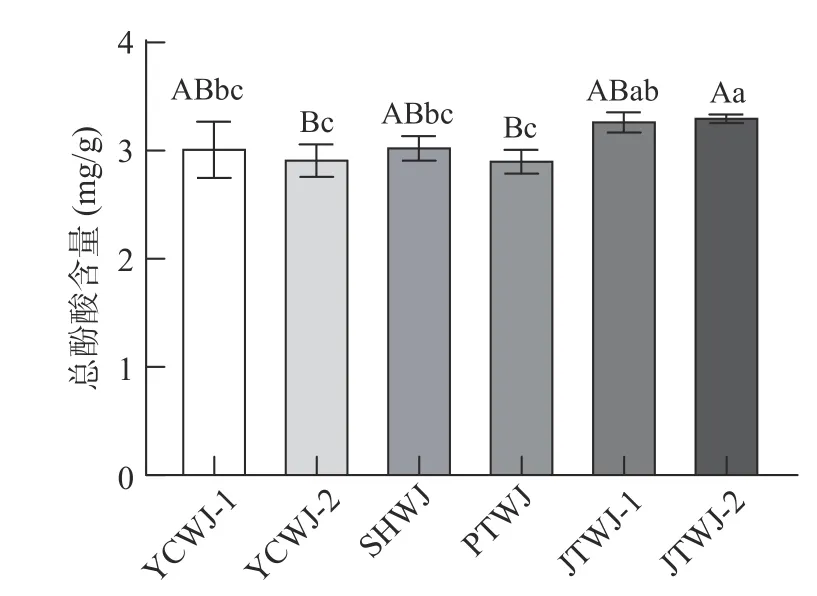
图3 不同花期的蜂王浆总酚酸含量Fig.3 The total phenolic acid content of royal jelly in different flowering periods
2.4 DPPH 自由基清除能力
如图4 所示,不同花期间所产蜂王浆的DPPH自由基清除能力较强,且差异明显。JTWJ1、JTWJ2及SHWJ 的DPPH 自由基清除率均高于56%,而YCWJ1、YCWJ2、PTWJ 的DPPH 自由基清除率低于50%。本实验结果与谌迪研究的不同采收月份蜂王浆抗氧化活性对比的结果相似,其研究结果表明不同月份间蜂王浆的DPPH 自由基清除能力存在显著差异,本研究表明不同花期间所产蜂王浆DPPH自由基清除能力同样存在显著差异(<0.05)。同花期内的YCWJ1和YCWJ2,JTWJ1和JTWJ2 自由基清除能力均无显著性差异(>0.05),不同花期间所产的蜂王浆DPPH 自由基清除能力均有所差异,其中油菜花期的YCWJ1 和YCWJ2,与荆条花期的JTWJ1和JTWJ2 的DPPH 自由基清除能力间存在极显著差异(<0.01)。SHWJ 由于采集的花粉和花蜜成分差异大,导致花期内的单独样本间自由基清除率差异较大,因此无法保证该花期所产蜂王浆整体自由基清除率的稳定。综上所述,在保证蜜粉源稳定的情况下生产的蜂王浆DPPH 自由基清除能力是较为稳定的,而随着蜜粉源变动所产蜂王浆的DPPH 自由基清除能力也会有所差异。

图4 不同花期蜂王浆的DPPH 自由基清除能力Fig.4 The DPPH free radical scavenging ability of royal jelly in different flowering periods
2.5 蜂王浆的总抗氧化活性分析
如图5 所示,油菜花期的YCWJ1 和YCWJ2 的总抗氧化能力极显著(<0.01)低于其他花期所产蜂王浆的总抗氧化能力,而油菜花期所产蜂王浆的总抗氧化相对较低的原因,可能是受到蜂群大量繁殖的影响。JTWJ1 和JTWJ2 的总抗氧化活性与DPPH 自由基清除能力结果类似,拥有着高DPPH 自由基清除率的同时也有着较高的总抗氧化能力。

图5 不同花期的蜂王浆总抗氧化能力Fig.5 The total antioxidant capacity of royal jelly in different flowering periods
2.6 相关性分析
如表2 所示,DPPH 自由基清除率与总酚酸是显著正相关(=0.602,<0.05),说明总酚酸含量越高时蜂王浆的DPPH 自由基清除能力越强,而相关系数不高的原因可能是蜂王浆中其他物质与总酚酸相互协同参与了DPPH 自由基清除反应。DPPH 自由基清除率与总抗氧化能力呈极显著正相关(=0.745,<0.01),表明蜂王浆中DPPH 自由基清除能力越高其总抗氧化能力也会越强。而总抗氧化能力与总酚酸的相关性分析虽存在显著正相关(<0.05),但相关系数不高,可能是由于蜂王浆中其他抗氧化物质也参与反应并占据主导地位导致的。

表2 抗氧化活性斯皮尔曼相关系数Table 2 Spearman correlation coefficient of antioxidant activity
3 结论
本研究结果表明,在同地域同蜂种的条件下,不同花期所产蜂王浆中10-HDA 含量存在显著性差异(<0.05)。PTWJ 的10-HDA 含量最高,YCWJ1 和YCWJ2 的10-HDA 含量其次,油菜花期充足的花粉和花蜜是10-HDA 稳定分泌的保证。通过对比不同花期所产蜂王浆中10-HDA 含量,表明蜂粮的营养质量可能是影响10-HDA 分泌的主要因素。蜂王浆总蛋白含量受花粉质量影响较大。不同花期蜂王浆的DPPH 自由基清除能力和总抗氧化能力有所差异,其中荆条花期所产蜂王浆的自由基清除能力和总抗氧化能力均为最强。不同花期所产蜂王浆的DPPH自由基清除能力,与其总酚酸含量和总抗氧化能力呈极显著正相关(<0.01)。

