棉酚降解菌的筛选、鉴定及棉粕固态发酵效果研究
汪 丰,张维树,崔 颖,叶林燕,李梦托,曾维斯,周 焕,刘 楠,闫达中,
(1.武汉轻工大学生命科学与技术学院,湖北武汉 430023;2.武汉中粮食品科技有限公司,湖北武汉 430023)
棉籽粕为棉籽经过脱壳、压榨等工序得到的副产品,我国年产量600 万吨。棉籽粕作为一种农业废弃物,价格低廉,粗蛋白含量可达40%左右,是极具开发潜力的植物蛋白质饲料资源。然而其含有棉酚、单宁、植酸等多种抗营养因子,它的应用价值受到限制。按棉酚的存在形式,可将其分为游离棉酚和结合棉酚,而前者会在动物体内蓄积,通过氧化应激反应,造成动物肝损伤,生殖功能障碍,引发呼吸窘迫、心律失常和溶血性贫血,有研究报道饲粮游离棉酚含量为162.5 mg/kg 时,导致育肥猪中毒死亡,更严重的是不同畜禽体内残留的游离棉酚通过食物链累积威胁着人类的健康。尽管我国棉籽粕产量很高,但受限于游离棉酚的毒性,其在饲料生产中的利用率还不到35%。因此,研究如何去除棉粕中的棉酚具有重要意义。
通过物理方法或者化学方法去除棉酚还存在诸多问题,或是能耗太高,或是会造成溶剂残留、破坏原有营养成分等。近年来,微生物处理法逐渐成为研究热点,它不仅可以降解包括棉酚在内的抗营养因子,无二次污染,还可以提高棉籽粕的蛋白质含量,发酵产物中存留的许多酶类、维生素、氨基酸以及促生长因子,大大改善棉籽粕的营养价值和饲用价值。目前文献报道的棉酚降解菌有曲霉、酵母菌、红球菌、芽孢杆菌、乳杆菌等,侯敏等通过对比饲喂正常饲料和棉粕饲料下棉铃虫()肠道微生物的异同,分离棉酚耐受性肠道内生菌32 株,对棉酚最高降解率达90.83%。在棉酚降解产物鉴定方面,周生飞运用LC-MS/MS 对发酵液进行检测,获得18 种棉酚降解产物,推导出相应分子结构,提出了近平滑假丝酵母菌降解棉酚的代谢途径。棉酚与萘的结构相似,可以将其看成萘的衍生物,有学者认为微生物降解棉酚的过程可能与萘的降解相似;同时棉酚是一种多环芳烃,目前已报道的参与多环芳烃降解的酶有加氧酶、脱氢酶和木质素降解酶。关于微生物降解棉酚蛋白组学方面的研究报道寥寥无几,目前仅有Yang 等以黑曲霉()AN-1 为研究对象,以棉酚为唯一碳源培养后对其进行蛋白质组学分析,并利用MALDI-TOFMS测定其中可能参与棉酚降解的20种蛋白质。
目前微生物降解棉酚的研究大多集中在降解菌的筛选和发酵条件的优化,对于菌体利用棉酚为唯一碳源的生长和降解过程关注较少,而该部分研究对于阐明棉酚的微生物降解途径及生物学机制具有重要意义。本研究从山东棉花种植地及棉籽榨油厂附近采集土壤样品,筛选出一株可高效降解棉酚的菌株,研究该菌在无机盐培养基中的生长降解特性,根据底物谱分析初步推断棉酚的开环途径,旨在为棉粕的微生物脱毒产业化提供更多的微生物降解菌种资源,也为深入研究棉酚降解机理提供支持。
1 材料与方法
1.1 材料与仪器
棉籽粕 来自新疆棉粕加工厂;土样 山东滨州蓟县棉花种植地及棉籽榨油厂(土样取自土表层3 cm 以下);醋酸棉酚 上海阿拉丁生化科技股份有限公司;LB 培养基:蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g,蒸馏水1000 mL,pH7.2~7.4;筛选培养基:醋酸棉酚5.0 g,(NH)SO2.0 g,MgSO·7HO 0.2 g,KHPO0.5 g,CaCl·2HO 0.1 g,KHPO0.5 g,琼脂15 g,蒸馏水1000 mL,pH7.2~7.4;无机盐培养基(Mineral salts medium,MM)(1000 mL):(NH)SO2.0 g,NaHPO·12HO 14.3 g,KHPO3 g,FeSO·7HO 0.3 mg,储存缓冲液(500×)2 mL;储 存 缓 冲 液:MnSO·HO 0.07 g,MgSO·7HO 0.015 g,CuSO0.0125 g,ZnSO0.0125 g,HBO0.0125 g,溶于蒸馏水,定容至500 mL,过滤除菌。
T-GRADIENT PCR 仪 德国Biometra 公司;SPX-3008SH-II 生化培养箱 上海知楚仪器有限公司;ZQLY300F 振荡培养箱 上海新苗医疗器械制造有限公司;DYY-6C 电泳仪、DYY-6C 琼脂糖凝胶电泳系统 北京六一仪器厂;SW-CJ-IBM 超净工作台 苏州安泰空气有限公司;5417R 台式高速冷冻离心机 德国Eppendorf 公司;EC20 pH 计 梅特勒-托利多仪器有限公司;UV1780 紫外分光光度计日本岛津;Agilent 1260Ⅱ高效液相色谱 美国安捷伦;LDZM-80L-Ⅲ高压自动灭菌锅 上海申安;ZF-288 琼脂糖电泳凝胶成像系统 上海金鹏分析仪器厂;YS100 显微镜 日本尼康。
1.2 实验方法
1.2.1 棉酚降解菌株的筛选 来自山东的土壤取10 g样品分散到90 mL 无菌水中,放入28 ℃恒温摇床180 r/min 培养,24 h 后将土壤悬液取出,并进行梯度稀释。分别取10和10的梯度稀释液100 μL,涂布于无机盐加棉酚的培养基中,置于28 ℃恒温培养箱5 d。挑取不同形态的单菌落,分别划线转接到以棉酚为唯一碳源的无机盐液体培养基中,28 ℃恒温培养,获得可以棉酚为唯一碳源生长的纯培养物。同时利用添加5 g/L 棉酚的筛选培养基加入土壤悬液进行连续的传代培养4~5 周,富集后稀释涂布平板。从上述平板上挑选长出的单菌落,接种到添加1 mmol/L棉酚无机盐培养基,鉴定是否可以利用底物棉酚作为碳源生长。
1.2.2 棉酚降解菌的鉴定 从土样中筛选到一株以棉酚为唯一碳源生长的菌株,并将其命名为 YL01。将YL01 制片,进行革兰氏染色,用光学显微镜油镜观察细菌形态。
YL01 生理生化鉴定参考文献[23-24]进行。
用细菌通用引物进行16S rRNA 基因PCR 扩增。PCR 反应体系(50 μL)为PCR Buffer (5×)10 μL,10 mmol/L dNTP 1 μL,引物27F (5'-AGAGTTTGA TCCTGGCTCAG-3') 1 μL,引物1492R (5'-GGTTAC CTTGTTACGACTT-3') 1 μL,Taq 酶(5 U/μL) 0.5 μL,模板4 μL (单菌落加50 μL 无菌水100 ℃煮8 min,离心后取上清为模板),无菌水32.5 μL。PCR 反应条件:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸5 min。将PCR 产物送上海生工测序,测得的序列登录NCBI用blastn 进行序列比对,利用Clustal W 和MEGA 7.0 软件进行分析,Neighbor-Joining 法构建系统发育树。
1.2.3 YL01 抗生素抗性分析 在无机盐培养基平板上挑取单菌落接种到添加不同抗生素(氨苄青霉素、氯霉素、卡那霉素、四环素、萘啶酸、庆大霉素和链霉素的浓度分别为50、34、10、15、20、10、10 μg/mL)的5 mL 1/4 LB 培养基中,每个实验组设置三重复,对照组为不加抗生素的1/4 LB 培养基。180 r/min,28 ℃摇床培养,分别在第1、2、3 d 观察其是否生长,以测试其对抗生素的抗性情况。
1.2.4 菌株生长曲线和对棉酚的降解效果
1.2.4.1 棉酚标准工作曲线 配制摩尔浓度为0.04、0.08、0.12、0.16、0.20 mmol/L 的棉酚标准溶液,溶剂为0.2%磷酸-乙腈(15:85 V/V)溶液,每个浓度设置三重复,经HPLC 测定计算峰面积。色谱条件如下,色谱柱:Thermo Fisher Accucore C柱,流动相:0.2%磷酸-乙腈(20:80 V/V),流速:0.5 mL/min,紫外检测波长:235 nm,进样量:5 μL,柱温:25 ℃。以棉酚标准液的摩尔浓度(mmol/L)为纵坐标,以峰面积为横坐标,绘制标准曲线,并求得回归方程为:y=(2×10)x-0.004,=0.999。
1.2.4.2 菌体生物量和棉酚降解率的测定 在以0.65 mmol/L 浓度的醋酸棉酚为唯一碳源的液体无机盐培养基中,接种YL01 单菌落,180 r/min,28 ℃摇床培养。同时设置不接菌的空白对照组,实验组与空白组均设置三重复。通过平板稀释计数法检测其10 d 内的生长情况。在第3、15、24、36、48、72、96、132、168、204、240 h 取100 μL 菌液,稀释后取50 μL 涂布于1/4 LB 平板(稀释倍数为10~10,以长出的单菌落数量在30~300 之间为宜),每个稀释度设置三重复,置于28 ℃培养,1 d 后计菌落数,按下列公式进行计算:
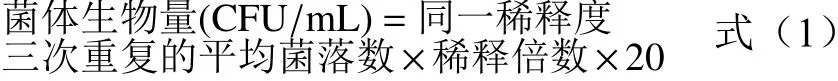
同时取1 mL 菌液加入等体积的乙酸乙酯,涡旋充分萃取,静置分层后取上清液,重复两次后合并上清液,取1 mL 用氮气吹干,用0.2%磷酸-乙腈(15:85 V/V)溶液重新溶解后,经HPLC 测定,将峰面积代入标准曲线回归方程计算棉酚含量。根据下式计算降解率。

式(2)中:c为最后一天实验组棉酚含量,mmol/L;c为第0 d 实验组的棉酚含量,mmol/L。
1.2.5 YL01 底物谱分析 将新活化的单菌落,接种到添加2 mmol/L 不同底物(萘、联苯、水杨酸、邻苯二酚、原儿茶酸、龙胆酸、对苯醌)的MM 培养基中,通过测定OD观察其是否生长。
1.2.6 发酵培养基最适碳源实验 为将来大规模培养菌株sp. YL01,考虑使用廉价的原料,降低生产成本,确定玉米浆为氮源,探索YL01 的最佳碳源及碳源浓度条件。固定氮源为浓度40 g/L 的玉米浆,设置5 mmol/L 和10 mmol/L 浓度梯度的甘油、淀粉和葡萄糖为碳源,每组三重复,保持其余组分添加浓度与种子培养基浓度相同。分别接种,于28 ℃ 200 r/min 摇床过夜培养,除去过夜时间,每隔3 h 取样测定吸光度OD,探究菌株在组分优化培养基中的生长情况。
1.2.7 固态发酵过程中蛋白含量以及棉酚降解效率测定
1.2.7.1 Bradford 法制作蛋白质标准曲线 配制1 mg/mL 牛血清蛋白(BSA)标准品溶液,分别吸取0.1、0.2、0.4、0.6、0.8 和1.0 mL 的BSA 标准溶液,再分别加入0.9、0.8、0.6、0.4、0.2 和0 mL 的双蒸水,混匀后准确吸取40 μL 于离心管中,加入考马斯亮蓝试剂2 mL,混匀后遮光反应5 min,以双蒸水为空白对照,在波长595 nm 处测定吸光度。以吸光度为纵坐标,以蛋白质的质量浓度(mg/mL)为横坐标,绘制标准曲线,并求得回归方程为:y=0.565x+0.108,=0.971。
1.2.7.2 固态发酵 称量0.1156 g 醋酸棉酚,溶解到5 mL 丙酮中,在100 g 灭菌棉粕(精确至0.001 g)中逐滴加入棉酚溶液,拌匀后取12 g 棉粕接种YL01 菌液10 mL(接种量为7×10CFU),同时设置不加菌的空白对照组,实验组与空白组均设置三重复。放置在28 ℃恒温培养箱中进行发酵。
1.2.7.3 棉粕中棉酚含量的测定 从第0 d 开始,每48 h 取1 g 样品加入14 mL 丙酮后进行涡旋,超声辅助萃取,静置取上清1 mL 氮吹至干,用0.2%磷酸-乙腈(15:85 V/V)溶液溶解后,经HPLC 测定峰面积,代入标准曲线回归方程计算棉酚含量。
1.2.7.4 棉粕粗蛋白的提取 准确称取1 g 棉柏样品,粉碎过80 目筛,按1:15(W/V)的料液比加水涡旋5 min,用1 mol/L NaOH 溶液调节体系pH 至11.5,50 ℃浸提2 h,6000 r/min 离心10 min,分离得上清液,再往残渣中加10 mL 水涡旋2 min,50 ℃浸提过夜,6000 r/min 离心10 min,分离得上清液,合并两次提取液。
1.2.7.5 棉粕蛋白含量的测定 取40 μL 棉粕蛋白提取液,加水稀释至2 mL,再取40 μL 稀释液和2 mL 考马斯亮蓝试剂混合,遮光反应5 min 后在波长595 nm 处测吸光值。平行重复三次,以40 μL 水和2 mL 考马斯亮蓝试剂混匀后调零。将吸光度代入标准曲线回归方程计算蛋白质含量。
1.3 数据处理
2 结果与分析
2.1 棉酚降解菌株的筛选
从土样中筛选到一株以棉酚为唯一碳源生长的菌株,并将其命名为YL01。菌株YL01 在无机盐固体培养基上菌落湿润、粘稠、边缘整齐,如图1。在光学显微镜下观察,菌体呈现球形。
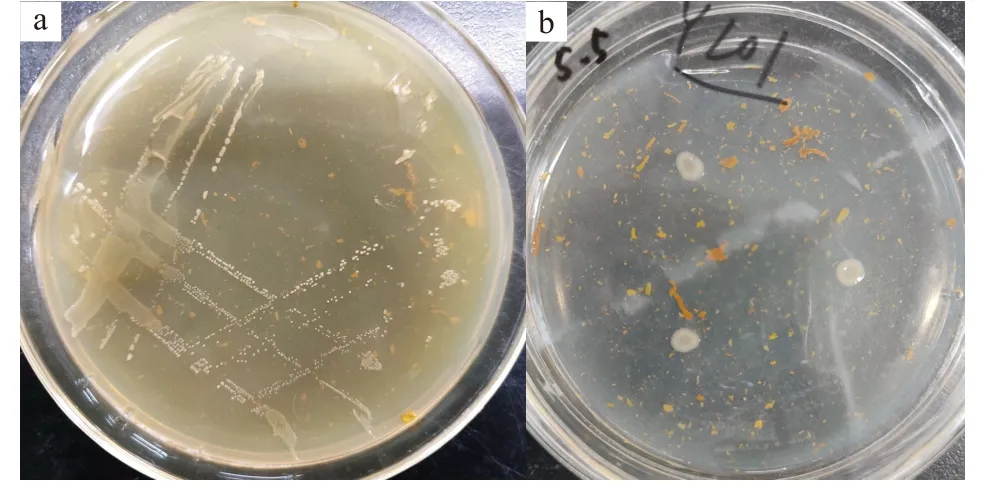
图1 YL01 菌落形态Fig.1 Colony morphology of bacterium YL01
2.2 棉酚降解菌的鉴定
2.2.1 菌株YL01 革兰氏染色鉴定 对棉酚降解菌YL01 进行革兰氏染色,呈现红色,因此鉴定该菌株为革兰氏阴性菌(G),如图2。
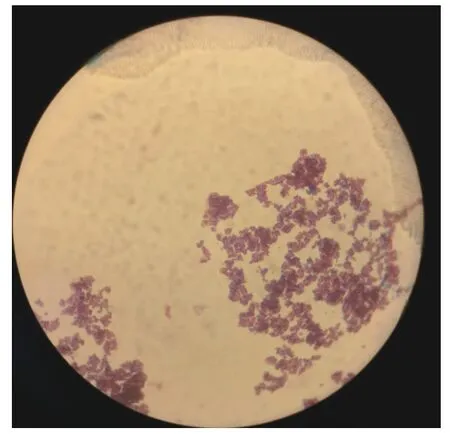
图2 YL01 革兰氏染色鉴定Fig.2 Gram staining identification of bacterium YL01
2.2.2 YL01 生理生化特征 YL01 能在5、10、41 ℃生长,不能在50 ℃生长,能水解尿素,不能产吲哚,也不能使L-鸟氨酸脱羧(见表1),这些特征与相同。但是YL01 能利用L-阿拉伯糖、淀粉和葡萄糖生长,而.不能;YL01 能在5 ℃生长,能利用L-鼠李糖、D-果糖、淀粉和葡萄酸钙,而1GBT 不能;YL01 不能利用松三糖,而1GBT、可以。YL01 能在41 ℃生长、能水解尿素、能利用淀粉、葡萄糖、葡萄酸钙和柠檬酸钠生长,而不能;YL01 不能产吲哚,也不能使L-鸟氨酸脱羧,而可以。经过全基因组测序,YL01 的DNA 的GC 含量为55.64%,与.NBRC 14939 的55.4% GC 含量相接近。结果表明,YL01 的生理生化性质与和较为接近。

表1 YL01 生理生化特征Table 1 Physiological and biochemical characteristics of YL01
2.2.3 16S rRNA 序列分析及系统发育树的构建将测得的16S rRNA 序列与NCBI GenBank 中所有已测定的原核生物的16S rRNA 序列进行比对,与IL11 的一致性达到99%以上。使用MEGA7.0 软件处理所得数据,得到了YL01及相关菌株的进化距离并构建了系统发育树(图3)。初步鉴定YL01 为拉乌尔菌属(sp.)。

图3 菌株YL01 的系统发育树Fig.3 Phylogenetic tree of strainYL01
2.3 YL01 抗生素抗性分析
在1/4 LB 培养基中添加不同的抗生素,通过测定OD观察YL01 生长情况,结果显示菌株可以在含有氨苄青霉素的培养基中生长,表明其具有氨苄青霉素的抗性,而对氯霉素、卡那霉素、四环素、萘啶酸、庆大霉素、链霉素均无抗性(表2)。因此YL01在环境中释放较为安全,具有较好的应用前景。
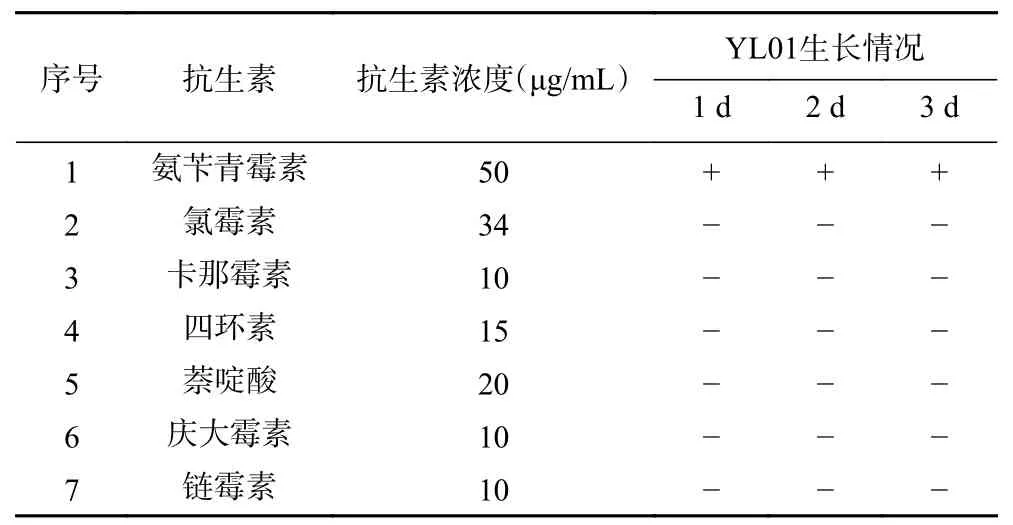
表2 YL01 在含有不同抗生素的1/4 LB 培养基中的生长情况Table 2 Growth of YL01 in 1/4 LB medium containing different antibiotics
2.4 YL01 生长曲线和对棉酚的降解效果
在以棉酚为唯一碳源的培养基中,YL01 从24 h开始进入生长对数期,第168 h 生物量达到最大值并进入稳定期(图4)。第10 d 棉酚降解率为48%。由于底物棉酚难溶于水,当用丙酮溶解后加入液体培养基会形成浑浊的悬浊液,无法使用分光光度计测定OD了解菌体生长情况,因此采用平板稀释涂布计数法来监测菌体生长,菌落总数统计检测存在一定计数误差。

图4 YL01 的生长曲线和底物棉酚浓度随时间的变化Fig.4 The growth curve of YL01 and the change of substrate gossypol concentration with time
2.5 YL01 底物谱分析
在无机盐培养基中添加不同的底物(浓度均为2 mmol/L),观察YL01 7 d 内的生长情况,结果显示其除了可以利用棉酚外,还能利用邻苯二酚、原儿茶酸和对苯醌作为唯一碳源生长,不能利用萘和联苯作为唯一碳源生长(表3)。说明菌株YL01 可能以邻苯二酚或原儿茶酸开环途径代谢棉酚,可能存在多条与芳香族化合物代谢相关的基因簇,但是降解途径不经过萘和联苯,具体开环方式仍需进一步研究。

表3 YL01 在不同底物中的生长情况Table 3 The growth of YL01 in different substrates
2.6 发酵培养基最适碳源实验
在不同碳源(甘油、淀粉、葡萄糖)组成的培养基中,YL01 均在第9 h 进入对数生长期(图5),在第27 h 生物量达到最大值,其在10 mmol/L 葡萄糖中OD最高,可以达到11.5。但是考虑到原料价格成本因素,确定5 mmol/L 淀粉为最适碳源培养YL01用于后续固态发酵实验。

图5 YL01 在不同碳源中的生长情况Fig.5 Growth of YL01 in different carbon sources
2.7 固态发酵效率及蛋白含量变化
对棉粕固态发酵不仅能降低棉酚含量,还可提高其营养价值,改善饲料适口性,同时检验YL01的实际脱毒效果。与空白对照组相比,8 d 内棉酚含量极显著降低(<0.01),降解率为43%(图6),同时蛋白含量增加了10%(图7)。随着时间延长棉粕中水分蒸发会使其质量减少,带来棉酚含量的上升,考虑到这一点,实际降解率应高于测定值。蛋白含量的增加是由于在发酵的过程中,菌株分泌的各种酶。由于菌体接种量较小,仅为5.83×10CFU/g,通过加大接种量可以提高固态发酵过程中对棉酚的降解率。为了排除棉粕中土著菌株和高温高压对棉酚含量的影响,本实验将棉粕灭菌后额外加入棉酚,在部分已发表的文献中,固态发酵实验并没有这一步操作,其真实降解效率值得商榷。

图6 棉粕中棉酚含量随时间的变化Fig.6 Changes of gossypol content in cottonseed meal with time
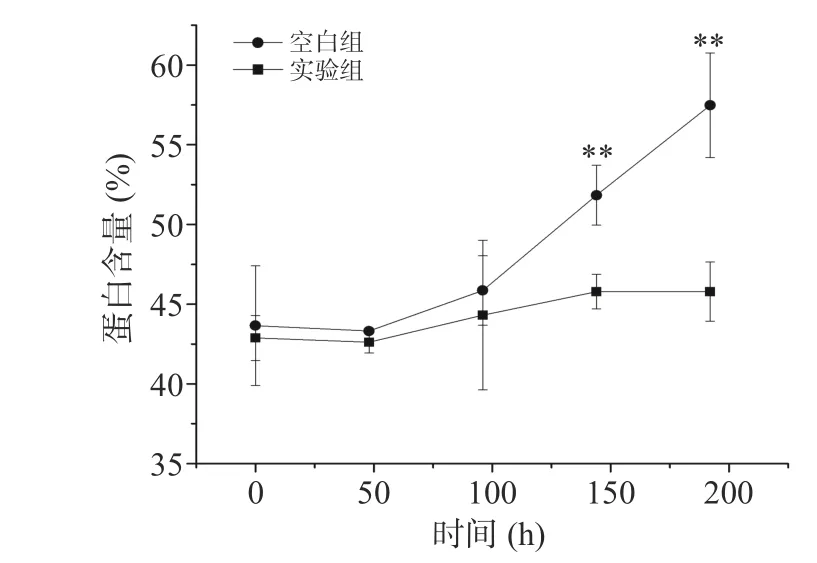
图7 棉粕中蛋白含量随时间的变化Fig.7 Changes of protein content in cottonseed meal with time
3 结论
从土壤中筛选分离到一株以棉酚为唯一碳源生长的菌株,经16S rRNA 基因测序和生理生化鉴定,鉴定其为sp.。YL01 在以棉酚为唯一碳源的无机盐液体培养基中生长10 d,棉酚的降解率为48%;接种该菌株到棉粕中,固态发酵8 d 后棉酚的降解率达43%,蛋白含量增加10%。YL01 与其他拉乌尔菌属的种在进化上亲缘关系较远,是否是一个新种,需要进一步实验研究。本研究在以棉酚为唯一碳源的培养基中测定菌株的生长和对棉酚的降解,还同时测定了液体培养和固态发酵条件下的棉酚降解效率,二者互相印证了该菌对棉酚的降解能力。本研究提供了更多降解棉酚的微生物菌种资源,对运用生物技术消除棉粕中棉酚具有潜在的应用前景,也为进一步开展棉酚的微生物降解机理研究奠定了基础。

