国产那屈肝素钙注射液在中国健康受试者中的生物等效性及安全性研究Δ
李洁,宋恒文,杨能,邵志超,钱春艳#(.常州市第一人民医院临床试验机构办公室,江苏常州 3000;.常州千红生化制药股份有限公司,江苏常州 35)
低分子肝素是应用化学或酶解方式,将肝素解聚并裂解成分子量1 000~12 000(平均4 000~6 000)的肝素片段,并以此所制成的一类分子量较小的肝素制剂[1-2]。低分子肝素的药理作用主要包括抗凝血、抗血栓、抗炎、调节细胞增殖、抗肿瘤、预防腹部术后粘连、抗脂质代谢紊乱、抗氧自由基生成等,主要用于心脑血管疾病、肾脏疾病、肝脏疾病、产科疾病和急性胰腺炎、扁平苔藓、癌症的临床治疗,以及术后血栓的预防[3]。那屈肝素钙是一种低分子肝素,由普通肝素通过解聚和分离所得,较普通肝素具有更长的半衰期(t1/2)[4];同时,该药具有明显的抗凝血因子Ⅹa(anti-coagulation factorⅩa,Anti-Ⅹa)活性和较弱的抗凝血因子Ⅱa(anti-coagulation factorⅡa,Anti-Ⅱa)活性,主要用于预防和治疗血栓栓塞[4]。那屈肝素钙注射液原研药的商品名为速碧林®(FRAXIPARINE®,注册证号 H20181137),由爱尔兰Aspen Pharma Trading Limited公司研发。本研究所用国产那屈肝素钙注射液(国药准字H20193057)由常州千红生化制药股份有限公司研发,根据其注册批件的要求,本研究拟探讨该受试制剂与参比制剂(原研药)在中国健康人群中的生物等效性和安全性,为国产制剂的进一步研究和应用奠定基础,为提高药品可及性、节约医药成本提供支持。
1 材料
1.1 主要仪器
本研究所用主要仪器包括SpectraMax Plus 384型多功能酶标仪(美国Molecular Devices公司)、M37615型涡旋混合器(美国Thermolyne公司)、XS205型分析天平(瑞士Mettler Toledo公司)、Simplicity型纯水仪(德国Millipore公司)等。
1.2 主要药品与试剂
本研究的受试制剂为那屈肝素钙注射液(国药准字H20193057,批号 851911010A,规格 0.6 mL∶6 150 AⅩaIU),由常州千红生化制药股份有限公司生产;参比制剂为那屈肝素钙注射液(注册证号H20181137,批号5313A,规格 0.6 mL∶6 150 AⅩaIU),由法国 Aspen Notre Dame de Bondevile公司生产。
低分子肝素(批号Batch 10,Anti-Ⅹa活性100 IU/mL,Anti-Ⅱa活性33 IU/mL)由欧洲药品质量管理局提供,用于配制标准曲线样品、质控样品和其他验证样品;Anti-Ⅹa和Anti-Ⅱa活性检测试剂盒均购自法国HYPHEN BioMed公司;其余试剂均为分析纯,水为纯化水。
1.3 血浆
健康人体柠檬酸钠抗凝血浆(空白基质)来自武汉市传染病医院Ⅰ期临床试验研究室;混合空白基质(血浆)由5名健康人体抗凝血浆混合制得;空白溶血基质(血浆)的制备方法如下:将含柠檬酸钠抗凝剂的全血样品于≤-60℃条件下快速冷冻不少于30 min使血细胞破裂,解冻后于2~8℃下以2 500×g离心15 min,取上清液适量,与单一来源的空白基质混合,即得溶血体积比分别为0.25%、0.5%、1.0%、2.0%的空白溶血基质。
2 低分子肝素Anti-Ⅹa和Anti-Ⅱa活性的检测
2.1 分析方法
使用Anti-Ⅹa、Anti-Ⅱa活性检测试剂盒,采用发色底物法以多功能酶标仪测定人血浆样品中低分子肝素的Anti-Ⅹa、Anti-Ⅱa活性。
2.2 方法学考察
2.2.1 标准曲线和定量下限 取低分子肝素适量,用空白基质制备标准曲线样品。其中,Anti-Ⅹa活性检测所用标准曲线样品的活性分别为0.010 0、0.050 0[定量下限(lower limit of quantification,LLOQ)]、0.080 0、0.125、0.250、0.500、0.750、0.850、1.00[定量上限(upper limit of quantitation,ULOQ)]IU/mL,Anti-Ⅱa活性检测所用标准曲线样品的活性分别为0.010 0、0.018 0(LLOQ)、0.040 0、0.060 0、0.080 0、0.120、0.160、0.200(ULOQ)IU/mL。检测波长为405 nm,参比波长分别为450 nm(Anti-Ⅹa活性)和455 nm(Anti-Ⅱa活性)。采用SoftMax®Pro GxP 5.4.1软件进行数据采集,采用Watson LIMS 7.4.1软件对理论活性值与所测平均光密度(optical density,OD)值进行回归,采用五参数法对标准曲线所有有效活性水平样品进行逻辑拟合,权重因子为1。本方法通过验证的定量范围分别为0.050 0~1.00 IU/mL(Anti-Ⅹa活性)和0.018 0~0.200 IU/mL(Anti-Ⅱa活性)。
2.2.2 准确度与精密度 准确度与精密度评估将采用6个验证分析批,由2名实验人员在2 d内完成。每个准确度和精密度验证分析批包含1套新鲜配制的标准曲线样品和空白对照样品以及5套5个活性水平的质控样品,其中Anti-Ⅹa活性检测所用质控样品的活性分别为1.00(ULOQ)、0.800[高 浓度 质控(high quality control,HQC)]、0.400[中浓度质控(moderate quality control,MQC)]、0.100[低浓度质控(low quality control,LQC)]、0.050 0(LLOQ)IU/mL,Anti-Ⅱa活性检测所用质控样品的活性分别为 0.200(ULOQ)、0.150(HQC)、0.100(MQC)、0.050 0(LQC)、0.018 0(LLOQ)IU/mL。按“2.2.1”项下方法检测并处理数据,结果见表1。由表1可见,在本方法条件下,Anti-Ⅹa活性和Anti-Ⅱa活性的批间和批内准确度和精密度均符合相关标准[5]。

表1 Anti-Ⅹa和Anti-Ⅱa活性检测方法准确度与精密度试验结果(n=5或n=6)
2.2.3 基质效应 取空白基质和混合空白基质,按“2.2.1”项下方法分别制备ULOQ、LLOQ样品和空白基质水平选择性样品(Anti-Ⅹa活性:10批次;Anti-Ⅱa活性:20批次)。结果显示,在本方法条件下,在定量范围内未见明显的基质效应。
取空白溶血基质(Anti-Ⅹa活性检测所用溶血基质的溶血体积比分别为0.25%、0.5%、1.0%,Anti-Ⅱa活性检测所用溶血基质的溶血体积比分别为0.25%、0.5%、1.0%、2.0%)和混合空白基质,按“2.2.1”项下方法分别制备ULOQ、LLOQ样品及其对应活性的空白基质水平选择性样品。结果显示,当溶血体积比≤0.25%时,空白溶血基质对Anti-Ⅹa、Anti-Ⅱa活性的检测无影响。
2.2.4 平行性 选用3个接近实测最大活性的临床样品考察平行性。采用混合空白基质稀释上述样品,且保证至少有3个稀释度样品的Anti-Ⅹa和Anti-Ⅱa活性落在定量范围内。结果显示,接近实测最大活性的临床样品经混合空白基质稀释后,定量范围内样品活性值的CV均满足相关标准,所有稀释度样品的测试结果(经稀释倍数校正)的精密度均满足相关标准[5],提示临床样品稀释具有平行性。
2.2.5 稀释效应和钩状效应 Anti-Ⅹa活性和Anti-Ⅱa活性检测结果显示,在10、5倍ULOQ活性样品中均未观察到钩状效应,样品在按最小稀释倍数进行稀释之前最多可以采用混合空白基质预稀释80、32倍。
2.2.6 稳定性 标准品原始储备液(Anti-Ⅹa和Anti-Ⅱa活性)在-90~-60℃下放置41 d稳定;将其溶于基质中,在室温和2~8℃下放置27 h均稳定,在-25~-15℃、-90~-60℃下放置62 d均稳定,反复冻融(-80℃~室温,下同)6次稳定。
将受试制剂(Anti-Ⅹa活性)溶于基质中,在室温和2~8℃下放置27 h均稳定,在-25~-15℃、-90~-60℃下放置61 d均稳定,反复冻融6次稳定。将参比制剂(Anti-Ⅹa活性)溶于基质中,在室温和2~8℃下放置27 h均稳定,在-25~-15℃、-90~-60℃下分别放置39、61 d均稳定,反复冻融6次稳定。将受试制剂(Anti-Ⅱa活性)溶于基质中,在室温和2~8℃下放置27 h均稳定,在-25~-15℃、-90~-60℃下分别放置40、61 d均稳定,反复冻融6次稳定。将参比制剂(Anti-Ⅱa活性)溶于基质中,在室温和2~8℃下放置27 d均稳定,在-25~-15℃、-90~-60℃下分别放置61 d均稳定,反复冻融6次稳定。
在冰水浴条件下,含标准品、受试制剂、参比制剂的人全血样本(Anti-Ⅹa和Anti-Ⅱa活性)放置2 h均稳定。
3 2种制剂的生物等效性及安全性评价
3.1 纳入与排除标准
本研究方案通过常州市第一人民医院伦理委员会审核批准[伦理批件号(2020)药第02号]。
健康受试者纳入标准包括:(1)18周岁及以上,男女不限;(2)体质量不低于50 kg,体质量指数为19.0~26.0 kg/m2;(3)经生命体征、体格检查,血常规、尿常规、血生化检测,胸片(正位)/胸部CT检查,传染病筛查,凝血功能检查,妊娠试验(女性)和12导联心电图检查等,各指标均无异常或异常但无临床意义;(4)在未来6个月内无生育计划且自愿采取有效避孕措施;(5)充分了解试验目的、性质、方法和可能发生的不良反应,自愿参与本研究并签署知情同意书,能够按照方案要求完成试验。
排除标准包括:(1)有过敏史(如哮喘、荨麻疹、湿疹等)或过敏体质者,已知对本药成分或类似物、鱼精蛋白和橡胶过敏者;(2)药物滥用筛查阳性或酒精呼气测试阳性者;(3)有凝血功能障碍疾病史者,或在过去6个月内发生过增加出血风险相关事件者,或既往有颅内出血、胃肠道出血、紫癜、消化道溃疡疾病史者,或过去30 d内接受过大手术者,或有活动性病理性出血、颅内出血疾病史者;(4)经传染病筛查出现以下任一情况者:抗人类免疫缺陷病毒抗体阳性、乙肝表面抗原阳性、抗丙肝抗体阳性、抗梅毒螺旋体抗体阳性;(5)在筛选前3个月有献血史或失血超过400 mL者[6]。
3.2 给药方案与血样采集
本试验采用开放、随机、单剂量、两序列、两周期交叉设计,健康受试者采用区组随机化方法按1∶1分配到TR(受试制剂-参比制剂)组和RT(参比制剂-受试制剂)组。受试者均禁食过夜(至少10 h),并于给药前后禁水1 h。两组患者均于第1周期的第1天空腹皮下注射受试制剂或参比制剂6 150 AⅩaIU,第2周期交叉给药,清洗期为7 d。
在给药0 h(给药前1 h内)和给药后0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、10、12、16、24 h采集血样4 mL至含柠檬酸钠的抗凝管中,轻柔颠倒混匀数次,于4℃下以2 500×g离心15 min,取上层血浆1 mL转移至分析用冻存管中,剩余血浆转移至备份用冻存管中。所有样品均需在采集后120 min内完成离心,并置于-20℃冰箱中冻存。待受试者同周期血浆全部收集完成后再统一转移至-60℃超低温冰箱中冻存。试验期间,所有受试者统一进食标准餐。
3.3 数据处理
将随机化后至少服用1次药物(无论参比制剂或受试制剂)且具有安全性评价数据的受试者纳入安全性分析集;将充分依从于试验方案且按照方案要求完成给药、生物样品采集和检测分析的受试者纳入符合方案集。
取各受试者血浆样品,按“2.1”项下方法检测后,按随行标准曲线计算其Anti-Ⅹa、Anti-Ⅱa活性。利用WinNonlin®8.0分析软件,采用非房室模型计算两药的药效动力学参数并绘制活性-时间曲线。药效动力学参数包括Anti-Ⅹa、Anti-Ⅱa活性最大值(Anti-Ⅹamax、Anti-Ⅱamax)、活性-时间曲线下面积(AUEC0-t、AUEC0-∞)、达峰时间(tmax)、t1/2。应用SAS 9.4软件,对Anti-Ⅹa活性的药效动力学参数(Anti-Ⅹamax、AUEC0-t和AUEC0-∞)进行生物等效性分析。若受试制剂与参比制剂Anti-Ⅹa活性的主要药效动力学参数几何均值比的90%置信区间在80.00%~125.00%内,可认为两药生物等效[7]。
3.4 结果
3.4.1 受试者人口学特征 本研究共纳入健康受试者24例,其中男性20例、女性4例,均为汉族;身高为(170.05±6.86)cm,体质量为(64.82±6.50)kg,体质量指数为(22.41±1.83)kg/m2;所有受试者均完成全部试验。
3.4.2 受试者给药后2种制剂的药效动力学参数比较24例受试者空腹皮下注射那屈肝素钙注射液受试制剂或参比制剂后,其Anti-Ⅹa、Anti-Ⅱa活性的药效动力学参数见表2,其活性-时间曲线见图1(图1B中,因Anti-Ⅱa活性在16 h后低于LLOQ,故时间范围为0~16 h)。

图1 受试者给予受试制剂/参比制剂后的平均血浆抗凝血因子活性-时间曲线
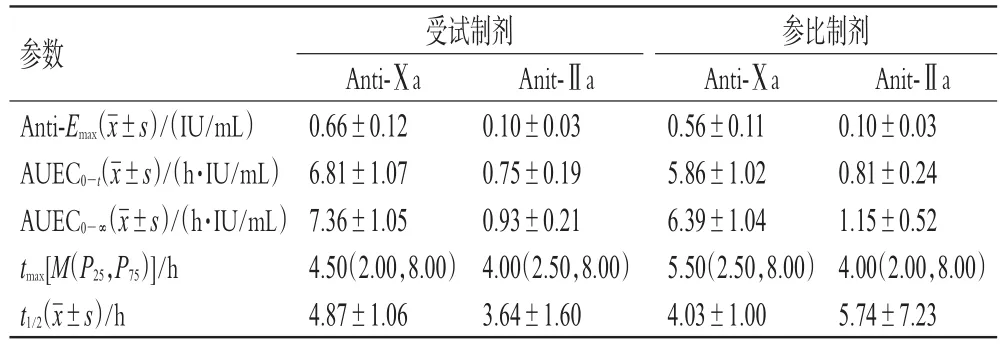
表2 受试制剂/参比制剂Anti-Ⅹa、Anti-Ⅱa活性的主要药效动力学参数(n=24)
3.4.3 生物等效性评价 两药药效动力学参数(Anti-Ⅹamax、AUEC0-t和AUEC0-∞)的几何均值比的90%置信区间分别为110.98%~123.50%、112.11%~121.24%、111.57%~120.00%。参照“3.3”项下生物等效性判定标准[7],两种制剂生物等效。
3.4.4 安全性评价 给药前后,所有受试者的生命体征及心电图检查均未见明显异常,有14例受试者发生不良事件,合计19例次,分级均为1级,无严重的不良事件发生。试验过程中,受试者发生的不良事件包括:低钠血症(受试制剂使用者2例次,参比制剂使用者1例次)、尿路感染(受试制剂使用者和参比制剂使用者各1例次)、体位性低血压(受试制剂使用者1例次)、恶心(参比制剂使用者1例次)、高尿酸血症(受试制剂使用者5例次,参比制剂使用者1例次)、窦性心动过速(参比制剂使用者2例次)、高甘油三酯血症(受试制剂使用者1例次)、紫癜(受试制剂使用者1例次)、斑丘疹(参比制剂使用者1例次)、血肿(受试制剂使用者1例次)。其中,血肿被判定为“肯定有关”,紫癜和斑丘疹被判定为“很可能有关”,其余不良事件均被判定为“可能无关”[8-10]。本课题组初步认为,那屈肝素钙注射液受试制剂和参比制剂均具有良好的安全性。
4 讨论
本试验设计主要参考国家药品监督管理局药品审评中心《关于仿制的低分子肝素类产品新增技术要求的意见》[11]、《低分子量肝素注射液人体药效学生物等效性研究一般考虑》[12]和美国FDA发布的低分子肝素类药品生物等效性指导原则(如Recommended Guidance:Draft Guidance on Enoxaparin Sodium[13])和既往文献报道[14],在健康受试者空腹条件下以体内药效学(Anti-Ⅹa、Anti-Ⅱa活性)为终点进行单剂量、双交叉的生物等效性研究。本研究采用发色底物法测定人血浆中受试制剂和参比制剂的Anti-Ⅹa、Anti-Ⅱa活性,方法学验证结果符合2020年版《中国药典》(四部)通则“生物样品定量分析方法验证指导原则”的相关要求[5]。
在本项以中国健康受试者为对象的那屈肝素钙注射液随机、开放、单剂量、两序列、两周期交叉的生物等效性试验中,受试制剂与参比制剂(Anti-Ⅹa活性)的主要药效动力学参数几何均值比的90%置信区间均在80.00%~125.00%内,可判断健康受试者空腹皮下注射那屈肝素钙注射液受试制剂(0.6 mL∶6 150 AⅩaIU)与参比制剂(速碧林®,0.6 mL∶6 150AⅩaIU)生物等效。
那屈肝素钙注射液的安全性事件主要有不同部位的出血,偶见血小板减少症和血栓形成,极少数患者会出现皮肤坏死、注射部位小血肿、皮肤反应、全身性过敏反应(如血管神经性水肿、一过性氨基转移酶增高)[8-10]。本试验中,受试者发生的不良事件包括低钠血症、尿路感染、体位性低血压、恶心、高尿酸血症、窦性心动过速、高甘油三酯血症、紫癜、斑丘疹、血肿。所有药物相关不良事件(紫癜、斑丘疹、血肿)均为轻度,未见严重的不良事件发生,受试者生命体征各项指标大致保持平稳。由此表明,那屈肝素钙注射液受试制剂和参比制剂均具有良好的安全性。与既往研究相比[14],本项试验基于受试者体征、体格、血常规等检查结果,更多地关注了制剂的安全性。
综上所述,国产那屈肝素钙注射液与参比制剂生物等效,两药的安全性均较好。

