《中国大剂量甲氨蝶呤循证用药指南》解读Δ
宋再伟 ,刘 爽 ,赵荣生 #,翟所迪 ,张相林 ,李幼平 ,杜冠华 ,石远凯 ,缪丽燕 ,张伶俐 ,景红梅
(1.北京大学第三医院药剂科,北京 100191;2.北京大学医学部药物评价中心,北京 100191;3.中日友好医院药学部,北京 100029;4.四川大学华西医院中国循证医学中心,成都 610041;5.中国医学科学院北京协和医学院药物研究所药物靶点研究与新药筛选北京市重点实验室,北京 100050;6.中国医学科学院北京协和医学院肿瘤医院内科,北京 100021;7.苏州大学附属第一医院药学部,苏州 215006;8.四川大学华西第二医院药学部,成都 610044;9.北京大学第三医院血液内科,北京 100191)
大剂量甲氨蝶呤(high-dose methotrexate,HDMTX)指甲氨蝶呤(methotrexate,MTX)的给药剂量大于500 mg/m2,常用于急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)、骨肉瘤等疾病的一线化疗[1]。目前,HDMTX在临床治疗中存在较高的用药风险,且毒副作用表现出显著的个体差异,其相关代谢酶基因检测以及血药浓度监测时机、目标浓度等个体化用药方面亟待规范。
《中国大剂量甲氨蝶呤循证用药指南》(以下简称“指南”)是一部由北京大学第三医院药剂科发起,经中国药理学会治疗药物监测研究专业委员会批准制订,由中国药学会循证药学专业委员会、中国循证医学中心和推荐意见分级的评价、制定与评估(Grades of Recommendations Assessment,DevelopmentandEvaluation,GRADE)中国中心提供方法学支持的临床实践指南[2]。指南的使用人群为临床医师、药师、护师和其他相关者,目标人群为接受HDMTX治疗的血液恶性肿瘤或骨肉瘤患者。指南项目组成员包括指导委员会、共识专家组、制订工作组以及外审专家组。其中,指导委员会负责指南的重要决策,审核并批准推荐意见和指南发布;共识专家组由临床药学、血液肿瘤学、骨肿瘤学、循证医学及药物经济学等多学科专家组成,负责临床问题的确定与推荐意见共识的达成。
2017年5月,指南在国际实践指南注册平台上进行注册,注册号为IPGRP-2017CN021。指南项目组严格遵从临床实践指南的最新定义与世界卫生组织指南制订的方法学规范,在系统分析、梳理2.5万余篇研究证据的基础上,对HDMTX药物治疗证据进行了循证评价和定性、定量整合,采用GRADE方法进行证据质量评价与推荐意见强度分级,并考虑了国内7家医院共计124例患者的意愿[3],经过9家医院共计48位专家同行的外部评审后完成制订,最终形成了涵盖临床用药全流程的28条推荐意见,涉及用药前评估、预处理与常规给药方案、治疗药物监测(therapeutic drug monitoring,TDM)、亚叶酸钙解救、不良事件管理等[4]。指南全文于2022年2月发表于 British Journal of Clinical Pharmacology期刊[5],指南编写组现就指南的推荐意见进行中文版本的总结和解读,以促进指南更好地在我国进行推广实施,为HDMTX全程个体化给药提供全面的技术支撑和使用建议。
1 证据分级与推荐强度
指南采用GRADE方法进行证据质量评价与推荐意见强度分级,即证据质量分为高、中、低、极低4个等级,推荐意见强度分为强推荐、弱推荐2个等级。推荐意见的强度主要基于对利弊的权衡,不完全依赖于证据质量。此外,对于必须在指南中形成推荐意见但已发表文献证据有限的临床问题,通过综合临床经验与专家证据[6],参考已发布的专家共识或诊疗规范,并经指南指导委员会与共识专家组取得共识后形成推荐意见,在指南中将此类证据分级标记为“专家意见”。
2 推荐意见总结与解读
指南推荐意见的总体框架见图1。在多维度、全流程规范临床用药的前提下,个体化给药是指南的核心内容,药物基因检测与TDM是实现HDMTX个体化用药的“双臂”。用药前基因检测,可预先对患者的用药风险进行分层,如亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)活性重度减低提示HDMTX用药风险可能增加;用药后TDM,可监测实际治疗后的血药浓度(CMTX),评估是否达到目标浓度范围并指导剂量优化,确保CMTX维持在安全有效的治疗范围。
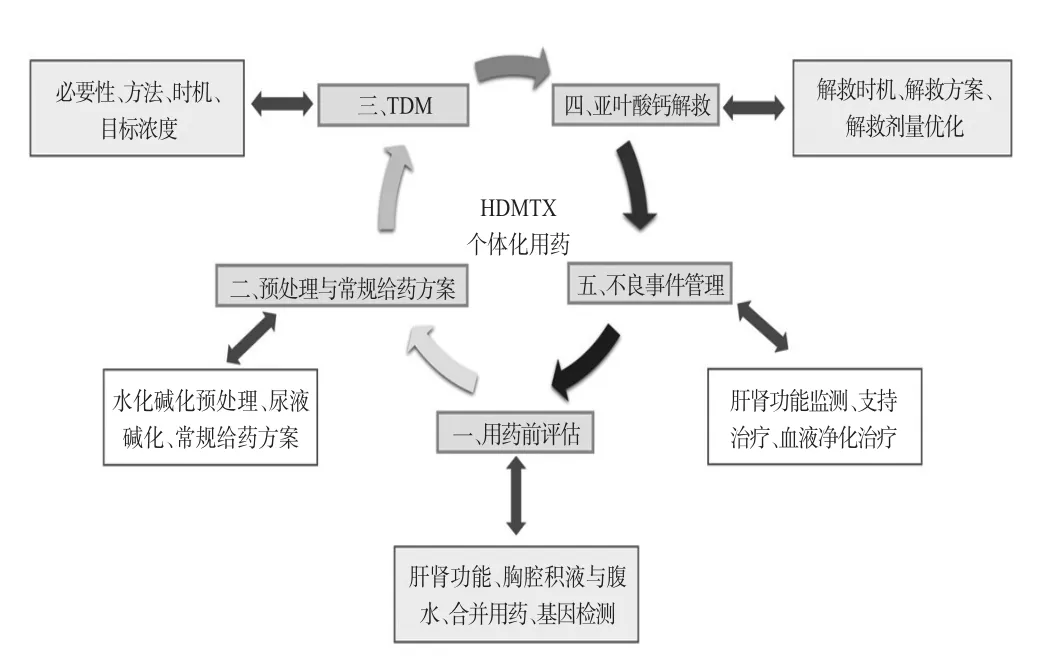
图1 指南推荐意见的总体框架
2.1 用药前评估
2.1.1 用药前评估肾功能的必要性
指南推荐意见1:推荐用药前常规检测肾功能,并将其作为个体化剂量调整的考虑因素之一(强推荐,低质量证据)。
约90%的MTX以原型经尿液排泄。HDMTX诱导的肾功能损伤与MTX及其代谢物7-羟基甲氨蝶呤(7-OHMTX)在肾小管中沉淀及MTX对肾小管的直接毒性作用有关[7]。有2%~12%的患者可能发生急性肾损伤,肾损伤后可引起排泄延迟,导致药物蓄积,进而引起全身毒性反应[8]。系统评价证据表明,用药前评估肾功能并调整药物剂量,可显著降低肝损伤、消化道毒性和口腔黏膜炎等的发生风险(受篇幅所限,本文中的系统评价证据若无特别说明均可参见指南附件[5])。故指南推荐临床用药前常规完善血清肌酐等肾功能评估,并综合考虑患者既往化疗耐受性及是否合并使用了肾毒性药物,必要时应调整MTX剂量。对于基线肾功能不全的患者,水化碱化预处理、用药后进行TDM与肾功能监测对确保其用药安全尤其重要。此外,儿童和青少年ALL及骨肉瘤患者根据基线肾功能调整HDMTX初始剂量的方法参考国家卫生健康委员会发布的ALL及骨肉瘤诊疗规范,即当肌酐清除率分别为80~100、60~<80、40~<60、20~<40 mL/min时,MTX的剂量应分别下调至原剂量的80%、70%、50%、40%[9-10]。
2.1.2 用药前评估肝功能的必要性
指南推荐意见2:推荐用药前常规检测肝功能,并将其作为个体化剂量调整的考虑因素之一(强推荐,低质量证据)。
HDMTX相关的肝功能损伤多表现为一过性转氨酶等实验室指标升高,但多次重复的HDMTX治疗可能引起肝脏毒性累积。肝功能损伤的风险因素包括酒精性、病毒性以及脂肪性肝炎等病史[8]。系统评价证据表明,HDMTX治疗后患者的丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transferase,GGT)等指标水平显著升高,碱性磷酸酶(alkaline phosphatase,ALP)水平显著降低。故指南推荐临床用药前常规完善ALT、AST、GGT、ALP等肝功能指标检查,评估患者肝炎病史。目前国内外尚缺乏肝功能不全患者的MTX剂量调整方案,严重肝功能不全者应避免或谨慎应用HDMTX,并注意加强用药后定期肝功能监测。
2.1.3 用药前评估胸腔积液与腹水的必要性
指南推荐意见3:建议用药前评估胸腔积液与腹水。当积液量较大且必须使用HDMTX时,建议酌情减量并加强TDM,监测不良事件并及时处置(弱推荐,极低质量证据)。
当存在胸腔积液和腹水等第三间隙积液时,HDMTX在体内的药动学过程将发生变化。MTX可能在第三间隙积液中蓄积并从中缓慢流出,导致MTX终末半衰期延长,引起排泄延迟和其他严重不良事件[11]。胸腔积液和腹水等第三间隙积液被认为是HDMTX治疗的潜在相对禁忌。故指南建议用药前评估胸腔积液和腹水情况,当积液量较大时,建议临床评估是否可抽取积液。若大量积液无法抽取,是否应用HDMTX治疗取决于风险与获益的平衡;若继续采取HDMTX治疗,建议酌情减少剂量,并对CMTX与不良事件进行更严密的监测。
2.1.4 用药前评估合并用药的必要性
指南推荐意见4:推荐充分评估合并用药情况,并谨慎联用如下药物——(1)影响MTX药动学的药物,包括竞争血浆蛋白结合的药物(如阿司匹林、苯妥英)和影响MTX清除的药物(如非甾体抗炎药、青霉素类、质子泵抑制剂、磺胺类、环丙沙星以及维生素C等影响尿液酸碱度的药物)等。(2)影响MTX药效学的药物,包括引起血液毒性、肾毒性、肝毒性的药物以及华法林、环孢素、氢氯噻嗪或其他与MTX具有不良相互作用的药物。必须联用上述药物时,需密切监测CMTX与不良事件(强推荐,中等质量证据)。
MTX临床用药风险较高,药物相互作用复杂。基于对相关研究证据的系统评价,以及对药品说明书、Micromedex数据库的补充检索,指南将MTX药物相互作用类别归纳总结为药动学和药效学两大类,其中药动学方面的相互作用包括对MTX分布或排泄的影响。故指南推荐用药前应常规完善上述合并用药的风险评估,尤其警惕维生素C、质子泵抑制剂、利尿剂等化疗常用辅助药物对MTX的影响。鉴于HDMTX用药风险较高,应尽量避免联用具有潜在相互作用的药物,必须合并用药时需对CMTX与不良事件进行更严密的监测。
2.1.5 用药前检测代谢酶基因多态性的必要性
指南推荐意见5:血液恶性肿瘤患者可考虑检测MTHFR 677C>T(rs1801133)和1298A>C(rs1801131)基因多态性(弱推荐,中等质量证据)。
指南推荐意见6:特定情况下,血液恶性肿瘤患者可考虑检测ABCB1 3435C>T(rs1045642)基因多态性(弱推荐,低质量证据)。
指南推荐意见7:不推荐血液恶性肿瘤患者检测SLC19A1 80A>G(rs1051266)基因多态性(弱推荐,低质量证据)。
指南推荐意见8:不推荐骨肉瘤患者常规实施基因检测,必要时可考虑MTHFR与ABCB1相关基因检测(弱推荐,低质量证据)。
MTX在体内的药动学过程以及患者疗效或不良反应的个体差异较大,相关代谢酶与转运体的基因多态性可能为重要的影响因素之一。因此,基因检测是HDMTX个体化用药的热点问题,也是指南推荐意见的重点。目前的药物遗传学研究多聚焦于HDMTX相关不良反应,尚缺乏足够的证据支持基因多态性与临床疗效的相关性,所以指南中有关基因检测的推荐意见仅基于安全性考虑。鉴于血液恶性肿瘤与骨肉瘤患者的MTX给药剂量与输注方案差异较大,指南对这2类人群分别提供了推荐意见。
(1)对于血液恶性肿瘤患者:①MTHFR基因是HDMTX药物遗传学领域研究最广泛的基因,该基因的突变可导致酶活性下降和叶酸代谢障碍,进而影响MTX等叶酸拮抗剂的药理活性。系统评价结果显示,有较多证据支持MTHFR 677C>T位点的单核苷酸多态性(single nucleotide polymorphism,SNP)与血液毒性、口腔黏膜炎毒性风险增加有关;②ABCB1基因编码的P-糖蛋白(P-gp)参与MTX细胞外排转运,一定数量的证据表明3435C>T位点的SNP与肝脏毒性风险增加有关;③还原型叶酸载体(reduced folate carrier 1,RFC1/SLC19A1)参与MTX向胞内转运,但现有证据不支持其基因80A>G位点的SNP与HDMTX毒性相关[12]。此外,患者意愿调查显示,86.90%的血液恶性肿瘤患者愿意接受基因检测[3]。鉴于目前仍缺乏直接证据证实基因检测指导HDMTX用药的临床获益,也缺乏HDMTX基因检测的经济学证据,结合上述关联性证据的系统评价结果,指南建议可考虑进行MTHFR相关基因检测,必要时也可考虑检测ABCB1 3435C>T,但不建议检测SLC19A1 80A>G。药师应基于基因检测结果提供个体化用药解读与指导,对于用药高风险的患者可考虑酌情减量,并加强TDM与不良事件监测。
(2)对于骨肉瘤患者:支持MTHFR C677T与HDMTX毒性关联的证据较为有限,其他基因位点与HDMTX毒性的相关性尚不十分明确[13]。患者意愿调查显示,82.5%的骨肉瘤患者愿意接受基因检测[3]。指南专家依据临床经验一致认为,骨肉瘤患者中HDMTX相关基因检测的临床获益尚不明确。因此,综合考虑现有证据、临床经验与经济成本,指南不建议对骨肉瘤患者进行常规基因检测。对于骨肉瘤患者,尽管缺乏基因检测结果,但若规范开展TDM也有助于降低用药风险、促进个体化用药。
2.2 预处理与常规给药方案
2.2.1 水化碱化的预处理方案
指南推荐意见9:推荐在HDMTX输注前12 h或更早开始静脉水化碱化,并在用药前、用药期间及用药后持续规范地进行水化碱化(每日入量2.5~3 L/m2,持续时间≥72 h),直至CMTX低于0.1~0.2 μmol/L(强推荐,中等质量证据)。
充分的水化和尿液碱化对维持MTX在肾小管的溶解度以及经肾清除是必要的。系统评价证据表明,提前12 h或更早水化碱化与降低肾损伤发生风险有关,持续、充分的水化碱化与用药安全性改善和住院时间缩短有关。充分水化的定义为每日入量2.5~3 L/m2,持续时间≥72 h。
考虑到化疗可能引起患者的消化道反应,进而影响口服碳酸氢钠的吸收,结合临床可操作性,指南建议在静脉水化液体中加入碳酸氢钠,以实现尿液碱化。在临床实践中,建议临床医师与护理人员在滴注HDMTX前12 h或更早开始水化碱化。水化量可通过记录饮食与静脉滴注的入量进行估算,碱化可通过监测尿液pH判断是否达标。此外,监测出入量并维持平衡有助于以最低风险进行有效的水化作用。
2.2.2 尿液碱化的目标pH范围
指南推荐意见10:建议给药前、给药期间以及给药后维持尿液pH≥7.0(弱推荐,低质量证据)。
MTX及其代谢物7-OHMTX易在酸性条件下发生沉淀,引起急性肾损伤[7]。系统评价证据与临床经验表明,尿液pH≥7.0可显著改善用药安全、减少肾损伤发生。在临床实践中,笔者建议每天常规监测尿液pH,直至CMTX达到安全范围(即低于0.1~0.2 μmol/L)。对于发生排泄延迟或急性肾损伤的患者,建议增加监测频率,对尿液pH进行更严密的监测,并维持尿液pH≥7.5。
2.2.3 血液恶性肿瘤患者的常规给药方案
指南推荐意见11:用于血液恶性肿瘤的给药剂量通常为1~8 g/m2,建议采用首剂量/负荷剂量结合维持治疗的给药方式,其中首剂量/负荷剂量(给药总量的1/10)于0.5 h内静脉滴注,维持治疗剂量(给药总量的9/10)在23.5 h内持续滴注;用于中枢神经系统淋巴瘤时,通常于3~4 h内快速滴注(弱推荐,专家意见)。
对于ALL、NHL等疾病,快速滴注负荷剂量有助于尽早达到血药峰浓度(Cmax),剩余剂量持续滴注可维持稳态血药浓度(Css)。对于中枢神经系统淋巴瘤,快速滴注有助于MTX透过血脑屏障,增加脑脊液中的药物浓度。该推荐意见参考了已发布的专家共识和临床诊疗规范[7,9]。由于缺乏高质量的证据,指南建议全面评估患者的实际情况,结合既往化疗的疗效与耐受性,审慎制订给药与滴注方案。
2.2.4 骨肉瘤患者的常规给药方案
指南推荐意见12:用于骨肉瘤的剂量通常为8~12 g/m2,建议于4~6 h内快速滴注(弱推荐,专家意见)。
HDMTX用于治疗骨肉瘤时,需要更高的CMTX以增加药物在肿瘤组织的暴露,因此宜采用更高剂量,并在短时间内快速滴注。该条推荐意见参考了已发布的专家共识和临床诊疗规范[8-9]。但由于缺乏高质量的证据,指南建议全面评估患者的实际情况,审慎制订给药与滴注方案。
2.3 TDM
2.3.1 HDMTX给药后开展TDM的必要性
指南推荐意见13:推荐常规开展TDM(强推荐,低质量证据)。
MTX个体差异大,CMTX易受多种因素影响,且肿瘤患者往往伴随较多的合并用药。实施TDM并优化MTX和亚叶酸钙解救剂量有助于提高血药浓度达标率,降低不良事件发生率,改善疗效。患者意愿调查显示,95.24%的血液恶性肿瘤患者与92.50%的骨肉瘤患者均愿意接受TDM[3]。因此,指南推荐HDMTX给药后常规开展TDM。
2.3.2 TDM方法
指南推荐意见14:基于药物检测特异性与结果准确性,推荐采用高效液相色谱-串联质谱(HPLC-MS/MS)、高效液相色谱(HPLC)等分析方法开展TDM;当条件受限或需快速检测时,可采用荧光偏振免疫分析(FPIA)、酶放大免疫分析(EMIT)和化学发光微粒子免疫分析(CMIA)等试剂盒方法(强推荐,极低质量证据)。
MTX以原型和代谢物的形式存在于体内,包括MTX、7-OHMTX、多聚谷氨酸化甲氨蝶呤(PGMTX)、2,4-二氨基-N10-甲基蝶酸(DAMPA)。在MTX代谢物中,PGMTX和7-OHMTX被发现与抗肿瘤细胞增殖活性和/或不良反应有关,但其检测意义、检测时机及目标浓度范围均有待进一步明确,目前临床TDM仍以MTX为主。
HPLC和HPLC-MS/MS可用于检测和区分MTX及其代谢物,但成本相对高、样品处理复杂。试剂盒方法测定所需时间短,但线性范围窄、无法区分MTX及其代谢物(不同TDM方法的详细比较详见指南附件)。由于TDM发展水平因地区而异,色谱分析方法和试剂盒方法在TDM工作中均发挥了重要作用。指南建议各医疗机构可根据临床需求与自身条件选用合适的TDM方法。但值得注意的是,试剂盒方法的结果可能需校正。此外,应用美国FDA批准的MTX解毒剂谷卡匹酶后,患者体内MTX均转化为DAMPA,此时免疫测定方法可能会高估CMTX。故对于应用谷卡匹酶的患者,指南建议选用色谱分析方法,避免应用FPIA法。
2.3.3 TDM时机
指南推荐意见15:对于24 h持续滴注方案,推荐至少于滴注开始后24、48、72 h各监测 1次 CMTX,直至CMTX≤0.1~0.2µmol/L;当出现排泄延迟、急性肾损伤或其他严重不良事件时,应缩短监测间隔、增加监测频率(强推荐,专家意见)。
指南推荐意见16:对于滴注时间≤6 h的快速滴注方案,推荐至少于滴注开始后3~6 h(即滴注结束时)、24、48、72 h各监测1次CMTX,直至CMTX≤0.1~0.2 µmol/L;当出现排泄延迟、急性肾损伤或其他严重不良事件时,应缩短监测间隔、增加监测频率(强推荐,专家意见)。
HDMTX给药方案根据滴注时间可分为24 h持续滴注和快速滴注2类。相对应地,TDM方案根据滴注时间可分为2类:对于24 h持续滴注方案,滴注结束时的血药浓度(C24h)被认为是Css,与疗效和安全性相关,而消除相的C48h和C72h则主要与安全性有关;对于滴注时间≤6 h的快速滴注方案,滴注结束时的C3~6h被认为是Cmax,与疗效和安全性相关,而消除相的C24h、C48h、C72h则主要与安全性相关。故指南建议,至少在滴注结束时和滴注结束后24、48、72 h各监测1次CMTX。药师应结合不同时间点的目标浓度范围,为临床提供TDM结果解读;当出现排泄延迟或不良事件时,应缩短监测间隔、增加监测频率。
2.3.4 血液恶性肿瘤患者的C24h目标范围
指南推荐意见17:对于ALL患儿,推荐24 h滴注结束时C24h(即Css)的目标范围为16~40µmol/L(强推荐,中等质量证据)。
目前尚缺乏成人患者C24h目标范围的临床研究,相关证据仅关注ALL患儿——对于ALL患儿,C24h>16µmol/L可能有助于提高临床疗效,而C24h>40µmol/L可能会增加毒性风险[14]。故基于疗效和安全性平衡的考虑,指南推荐将16、40µmol/L分别作为ALL患儿C24h目标范围的下限和上限。对于成人血液恶性肿瘤患者,药师可一定程度上参考该浓度范围进行TDM结果解读,并积极探索验证成人患者的C24h目标范围。此外,开展TDM的同时仍有必要密切监测不良事件。
2.3.5 骨肉瘤患者的C4~6h目标范围
指南推荐意见18:对于骨肉瘤患者,建议4~6 h滴注结束时的C4~6h(即Cmax)的目标范围为1 000~1 500µmol/L(弱推荐,低质量证据)。
系统评价证据表明,对于骨肉瘤患者,C4~6h>1 000µmol/L的临床疗效更好,但C4~6h>1 500 µmol/L时疗效未显著改善,而严重毒性发生风险增加[15]。故基于疗效和安全性平衡的考虑,指南建议将1 000、1 500µmol/L分别作为Cmax目标范围的下限和上限。鉴于骨肉瘤患者MTX给药剂量较大,且需在短时间内快速滴注,故临床在开展TDM的同时仍有必要密切监测不良事件。
2.3.6 基于TDM的剂量调整
指南推荐意见19:建议基于TDM结果与目标治疗浓度,结合药动学特性,对MTX剂量进行个体化调整(弱推荐,低质量证据)。
已有不少群体药动学研究确定了HDMTX药动学参数的影响因素,但个体化浓度的预测模型尚未广泛建立。指南建议根据患者的个体情况(包括化疗疗效、耐受性以及本周期TDM结果),审慎调整下一周期的给药剂量。对于24 h持续滴注的患者,当条件允许时,可测定负荷剂量给药结束时的CMTX,并使用经过验证的药动学模型预测C24h,以调整维持剂量的输注速率,优化本周期给药剂量。
2.3.7 快速滴注方案的C24h目标范围
指南推荐意见20:对于滴注时长≤6 h的快速滴注方案,建议滴注后C24h的目标范围为C24h≤10µmol/L(弱推荐,低质量证据)。
从药动学角度考虑,快速滴注方案通常用于治疗骨肉瘤和中枢神经系统淋巴瘤,该方案中C24h可用于评估排泄延迟并预警不良事件。系统评价证据表明,C24h≤10µmol/L提示MTX清除正常、不良事件风险低;而C24h>50µmol/L则提示早期排泄延迟[5]。故指南建议骨肉瘤和中枢神经系统淋巴瘤患者接受HDMTX快速滴注方案时,C24h应≤10µmol/L。当出现排泄延迟时,应增加TDM频率,加强水化、碱化、亚叶酸钙解救等支持治疗,并密切监测不良事件。
2.3.8 C48h与C72h目标范围
指南推荐意见21:推荐开始滴注后C48h与C72h的目标范围分别为C48h≤1 µmol/L、C72h≤0.1~0.2 µmol/L;当C72h>0.1~0.2µmol/L时,可考虑缩短监测间隔、增加监测频率,并持续监测至CMTX≤0.1~0.2µmol/L(强推荐,中等质量证据)。
对于快速滴注方案或24 h持续滴注方案,消除相的C48h与C72h均用于评估MTX的清除情况。系统评价证据表明,C48h≤1µmol/L可提示清除正常、不良事件风险低,而C48h>5µmol/L则提示排泄延迟;C72h则被广泛用于评估是否已达到安全浓度,C72h≤0.1~0.2µmol/L时可停止TDM与解救[5]。故指南建议C48h应≤1µmol/L,C72h应≤0.1~0.2µmol/L。当存在排泄延迟时,应增加TDM频率,加强水化、碱化、亚叶酸钙解救等支持治疗,并密切监测不良事件。多数情况下,停止TDM的CMTX为≤0.1~0.2µmol/L;对于出现排泄延迟、急性肾损伤的患者,CMTX的安全范围应更为严格,以<0.05µmol/L为宜。
针对不同滴注方案的TDM时机与目标浓度相关推荐意见的总结见图2。
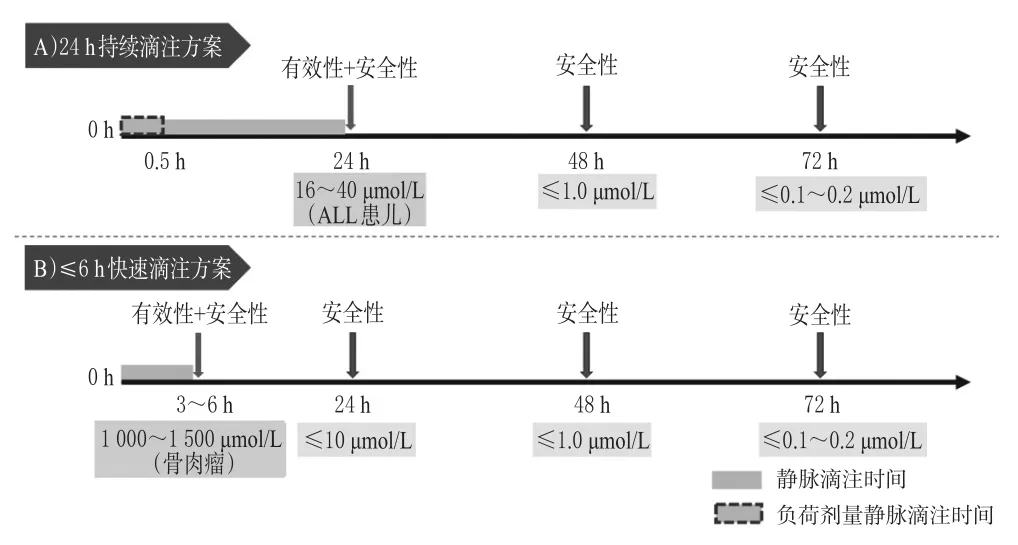
图2 HDMTX的TDM时机与目标浓度
2.4 亚叶酸钙解救
2.4.1 初始解救时机
指南推荐意见22:对于24 h持续滴注方案,推荐开始滴注后36~44 h给予首剂亚叶酸钙解救;当出现严重不良事件时,应结合临床、个体化地调整首剂解救时机(强推荐,低质量证据)。
指南推荐意见23:对于滴注时间≤6 h的快速滴注方案,建议开始滴注后12~24 h给予首剂亚叶酸钙解救;当出现严重不良事件时,应结合临床、个体化地调整首剂解救时机(弱推荐,专家意见)。
MTX是二氢叶酸还原酶抑制剂,通过拮抗叶酸发挥药理作用。亚叶酸钙是叶酸在体内的活化形式,可用作MTX解毒剂,故HDMTX治疗又称为HDMTX-亚叶酸钙解救疗法。合理的亚叶酸钙解救至关重要,过早解救可能拮抗化疗效果,而过晚解救则可能导致严重的不良事件[16]。
系统评价证据表明,与36 h时解救相比,24 h持续滴注方案首次解救延迟至42或44 h的疗效与安全性无显著差异,故指南推荐首次解救时机为开始滴注后36~44 h[5]。对于滴注时间≤6 h的快速滴注方案,参考已发布的专家共识[16]和临床诊疗规范[10],指南建议首次解救时机为开始滴注后12~24 h,但通常不晚于24 h。临床实际中,指南建议结合患者既往HDMTX化疗的耐受性与不良事件发生情况,个体化调整首剂亚叶酸钙解救时机;对于首剂解救相对较晚的患者,应加强不良事件监测。
2.4.2 初始解救方案
指南推荐意见24:首剂亚叶酸钙解救时,推荐常规予亚叶酸钙15 mg/m2,q6 h,静脉滴注或肌内注射(强推荐,低质量证据)。
系统评价证据表明,15 mg/m2剂量的用药安全性与20或30 mg/m2相比无显著差异。理论上,亚叶酸钙剂量越低,对化疗的拮抗作用越弱。此外,亚叶酸钙半衰期为4~6 h,尽管存在亚叶酸钙q3 h给药的经验性用法,但目前尚无研究证实缩短亚叶酸钙给药间隔的临床获益[16]。故指南推荐初始亚叶酸钙解救剂量为15 mg/m2,q6 h,加强解救的方法通常为增加单次解救剂量[16]。考虑化疗引起的消化道反应可能影响口服药物吸收,且亚叶酸钙生物利用度可能随剂量增加而降低,故建议给药途径优先考虑静脉注射或肌内注射。
2.4.3 解救剂量优化
指南推荐意见25:建议临床监测CMTX,并基于C42~48h调整亚叶酸钙解救剂量(弱推荐,专家意见)。
亚叶酸钙剂量调整方案参考ALL患儿临床诊疗规范制订[7],详见表1。当CMTX极高时,指南建议结合临床,适当上调亚叶酸钙剂量进行个体化解救,但需注意避免亚叶酸钙过量;当单次解救剂量较高时,建议输注时间宜保持在1 h以上,并警惕高钙血症副作用。亚叶酸钙解救应持续至CMTX降至安全范围(通常为CMTX≤0.1~0.2µmol/L);对于存在排泄延迟或不良事件的患者,可考虑持续解救至CMTX<0.05µmol/L。
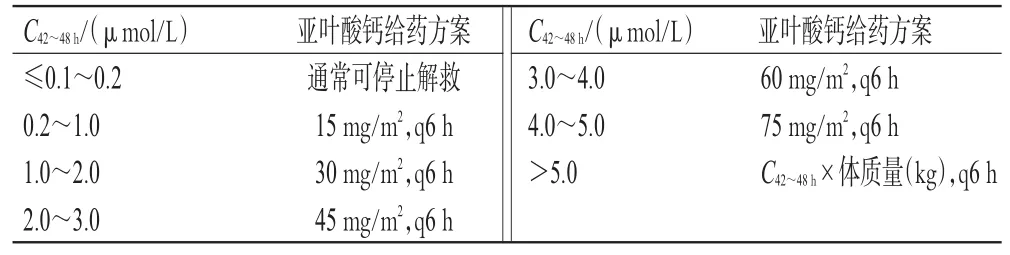
表1 亚叶酸钙剂量调整方案
2.5 不良事件管理
2.5.1 用药后肝肾功能监测
指南推荐意见26:建议用药后注意监测肝肾功能,直至CMTX达到安全范围(弱推荐,低质量证据)。
肝肾功能损伤为HDMTX常见的不良事件。系统评价证据表明,HDMTX给药后患者的肝肾功能会发生显著变化。指南建议结合临床,每1~3 d监测1次肝肾功能,直至CMTX≤0.1~0.2 µmol/L。
2.5.2 发生不良事件的支持治疗
指南推荐意见27:发生不良事件时,建议增加亚叶酸钙解救剂量,结合患者个体情况加强水化,持续碱化以维持尿液pH>7.0,并及时予含漱剂等其他对症支持治疗(弱推荐,专家意见)。
该推荐意见主要基于本指南专家组共识。发生不良事件需加强水化、碱化等支持治疗,建议维持每日入量2.5~3 L/m2,维持尿液pH≥7.5。水化过程需注意充分结合患者个体情况(如心力衰竭、肾功能不全),并注意监测出入量与电解质。对于口腔黏膜炎的防治,可使用含有氯己定、甲硝唑、复合维生素B、利多卡因、亚叶酸钙等的复方含漱剂,并注意嘱咐患者每日多次漱口。
2.5.3 血液净化治疗
指南推荐意见28:当CMTX过高、并发严重急性肾损伤或其他严重不良反应,且常规解救与支持治疗无法在短期内有效降低CMTX时,可考虑采用血液净化治疗。建议选用高通量血液透析、持续肾替代疗法或联合血液净化技术,并注意监测浓度反跳及血液净化治疗的副作用(弱推荐,低质量证据)。
当CMTX过高时,细胞内亚叶酸钙解救可能受到抑制,指南建议可考虑给予血液净化治疗以实现细胞外解救。常规血液透析和腹膜透析对于解救MTX中毒的疗效可能欠佳,不同血液净化治疗的比较详见指南附件[5]。当CMTX极高时,建议可联用高通量血液透析和血液灌注。当出现血流动力学不稳定或其他危及生命的紧急情况时,建议选用持续肾替代疗法。给予血液净化治疗的同时,需注意监测CMTX及血液净化相关副作用。
此外,谷卡匹酶已获美国FDA批准用于HDMTX中毒,该药可将体内MTX转化为DAMPA,迅速降低CMTX,临床可考虑将其作为一种治疗选择。目前也已有专家共识提供了谷卡匹酶给药的具体建议[10]。
3 讨论
本指南是国内首部抗肿瘤药物循证用药指南。与现有国内外HDMTX专家共识相比[16-17],本指南的区别和优势如下:(1)本指南遵循了国际公认的世界卫生组织和GRADE方法等指南制订规范,每条推荐意见均基于现有最佳证据的系统评价产生,通过严格设计的德尔菲法达成共识,并通过同行外部评审后定稿;(2)本指南的制订过程不仅重视指南专家组利益冲突管理,还通过调查患者的价值观与偏好实现了指南制订的患者参与,大大提高了指南的透明度和患者接受度;(3)本指南为HDMTX个体化给药提供了全面、实用的建议,涵盖用药前评估、预处理与常规给药方案、TDM、亚叶酸钙解救、不良事件管理等HDMTX用药全流程。综上,本指南可为进一步促进临床规范化开展HDMTX的TDM及其合理用药提供参考。
《中国大剂量甲氨蝶呤循证用药指南》工作组名单
指导委员会:杜冠华、石远凯、翟所迪、张相林、李幼平
共识专家组(按姓氏笔画顺序):王卓、王天有、王晓玲、牛晓辉、朱珠、汤静燕、克晓燕、李国辉、吴久鸿、邱峰、沈靖南、张毕奎、张伶俐、张艳华、陈耀龙、郑胡镛、郭卫、郭瑞臣、黄红兵、黄晓军、董梅、景红梅、甄健存、詹思延、肇丽梅、缪丽燕
外审专家组(代表):赵立波、张威、黄琳、蔡骅琳、夏凡、刘铎、刘韬、黄真
制订工作组:宋再伟、刘爽、胡杨、谈志远、黄振城、林巧楠、王冠儒、姜丹

