LncRNAMNX1-AS1 调节miR-744-5p/SH3BGRL3对喉癌细胞生长、迁移的影响
尹称意,马兵良,徐珏
喉癌主要以鳞状细胞癌最常见,其发病率呈上升趋势[1]。尽管现在医疗水平技术不断提高,但是喉癌患者的预后情况尚无明显改善,侵袭和转移是造成喉癌高死亡率的重要原因[2]。因此,研究喉癌发生发展的作用机制有利于发现喉癌诊治和判定预后的潜在标志物。长链非编码RNA(lncRNAs)是由RNA 聚合酶II转录生成的长度超过200 nt的副产物,虽然不具有编码蛋白质的能力,但其序列特征与信使RNA(mRNA)相似,参与细胞增殖、分化、代谢及个体发育等生物学功能[3-4]。既往研究显示,喉癌患者血清、癌组织中LncRNA H19 表达均上调,LncRNA H19 可能作为评估患者预后的重要标志物[5]。长链非编码RNA MNX1 反义RNA1(LncRNAMNX1-AS1)是新发现的一种分子[6],有研究显示,干扰LncRNA MNX1-AS1 诱导卵巢癌细胞的干样特性降低,对细胞抑制作用明显[7]。另有研究显示,LncRNA MNX1-AS1 在膀胱癌中显著上调且与不良预后相关[8]。但LncRNA MNX1-AS1 调节喉癌细胞生长、迁移的作用机制尚未见报道。因此,本研究分析干扰LncRNA MNX1-AS1 对喉癌细胞生长、迁移的影响,初步探讨其影响喉癌发展的作用机制,现报道如下。
1 资料与方法
1.1 材料 实验细胞:人喉癌Hep-2 细胞购自中科院上海细胞所。实验主要试剂和仪器:所使用质粒以及抗体均购自上海吉玛公司;Cell Counting Kit-8(CCK8)购自日本同仁Dojindo 公司;RPMI-1640 培养基、青链霉素购自武汉益普生物科技有限公司;胎牛血清、胰蛋白酶购自北京泽平科技有限责任公司;Trizol、LipofectamineTM2000 购自北京索莱宝科技有限公司,TaqMan©MicroRNA Reverse Transcription kit 及TaqMan©UniversalPCR MasterMix购自上海凯杰企业管理有限公司;cDNA反转录试剂盒购自上海康朗生物科技有限公司;BCA 试剂盒购自上海羽哚生物科技有限公司;Transwell 小室购自Corning 公司(美国);双荧光素酶报告基因系统试剂盒购自成都安森盛源科技有限公司ELx808 酶标仪购自常熟市圣海电器有限公司。
1.2 方法
1.2.1 细胞培养 将Hep-2 细胞置于含有10%FBS和1%青霉素-链霉素的RPMI1640培养基培养。将细胞保持在37℃充满5%CO2的培养箱中。
1.2.2 细胞转染 取对数期生长的Hep-2 细胞,接种至不含血清的RPMI 1640 培养基的6 孔板中(1.0×105个/孔),培养24 h 后。构建稳定敲低细胞系:将细胞分成sh NC 组和sh MNX1-AS1 组,将lncRNA MNX1-AS1 shRNA 慢病毒转染至sh MNX1-AS1 组细胞,将对照shRNA慢病毒插入pLVX-tdTomato-Puro载体转染至sh NC 组。构建瞬时转染细胞系:将细胞分成 NC mimics 组、miR-744-5p mimics 组、NC inhibitor 组、miR-744-5p inhibitor 组、sh SH3BGRL3组、miR-744-5p inhibitor+sh SH3BGRL3组。利用LiPofectamine TM 2000 脂质体转染法,将miR-NC mimics 转染至NC mimics组细胞,miR-744-5p mimics 转染至miR-744-5p mimics 组,miR-NC inhibitor 转染至NC inhibitor 组细胞,miR-744-5p inhibitor 转染至miR-744-5p inhibitor 组细胞,sh SH3BGRL3 转染至sh SH3BGRL3 组,miR-744-5p inhibitor和同时 sh SH3BGRL3 转染至miR-744-5p inhibitor+sh SH3BGRL3 组细胞。转染48 h 后收集细胞用于后续实验。引物序列见表1。

表1 实验所用引物序列
1.2.3 实时荧光定量(RT-PCR)检测MNX1-AS1、miR-744-5-p 和SH3BGRL3表达水平 采用Trizol 法提取细胞的总RNA,采用紫外分光光度计法测定RNA的浓度。以RNA 为模板进行逆转录获得cDNA 并置于4 ℃保存,进行荧光定量PCR 扩增,置于RT-PCR 仪中进行测定,设置反应条件:95 ℃,5 min 预变性;95 ℃变性10 s,60 ℃退火35 s,65 ℃延伸30 s,扩增35 个循环。以U6 和GAPDH 做为内参。采用2-CT法统计MNX1-AS1、miR-744-5-p 和SH3BGRL3 mRNA 相对表达量。
1.2.4 敲低MNX1-AS1 表达对喉癌细胞生长的影响 取对数期生长的sh NC组和sh MNX1-AS1 组Hep-2 细胞,细胞转染见1.2.2 项,将细胞(5×103/孔)接种于96 孔板。采用LipofectamineTM2000进行转染后将细胞置于CO2培养箱进行培养24 h,于0、24、48、72 h 对细胞吸光度(OD)进行检测。每孔加入100l 体积的CCK-8 溶液于37 ℃环境中继续孵育2 h,用酶标仪检测450 nm的吸光度。
1.2.5 过表达miR-744-5p 对喉癌细胞生长的影响 取对数期生长的NC mimics 组和miR-744-5p mimics 组Hep-2 细胞,细胞转染见1.2.2 项,细胞生长具体操作过程同1.2.4 项。
1.2.6 MNX1-AS1/miR-744-5p/SH3BGRL3轴对喉癌细胞生长的影响 取对数期生长的NC inhibitor 组、miR-744-5p inhibit or 组和miR-744-5pinhibitor+shSH3BGRL3组Hep-2 细胞,细胞转染见1.2.2 项,细胞生长具体操作过程同1.2.4 项。
1.2.7 敲低MNX1-AS1 表达对喉癌细胞迁移能力的影响 取对数期生长的sh NC 组和sh MNX1-AS1 组Hep-2 细胞,细胞转染见1.2.2 项。在24 孔板中,将细胞悬液(5×104/ml)接种于Transwell上室,下室加入500l 含10%血清的培养基,置于培养箱孵育。37 ℃、5%CO2培养箱中培养48 h,取出Transwell 小室,棉签轻轻擦拭小室膜上表面,甲醛固定10 min,0.3%结晶紫溶液染色20 min,用PBS洗3 次,在倒置显微镜下观察,观察小室膜下表面细胞数量取其平均值,本实验平行重复3 次。
1.2.8 过表达miR-744-5p对喉癌细胞迁移能力的影响 取对数期生长的NC mimics组和miR-744-5pmimics 组Hep-2 细胞,细胞转染见1.2.2 项。迁移实验操作步骤见1.2.7。
1.2.9 MNX1-AS1/miR-744-5p/SH3BGRL3轴对喉癌细胞迁移能力的影响 取对数期生长的NC inhibitor 组、miR-744-5p inhibitor 组和miR-744-5p inhibitor+sh SH3BGRL3 组Hep-2 细胞,细胞转染见1.2.2 项。迁移实验操作步骤见1.2.7。
1.2.10 双荧光酶素报告基因实验LncRNAMNX1-AS1 与miR-744-5-p 结合位点通过生物信息学预测网站StarBase v3.0(http://starbase.sysu.edu.cn/)上进行鉴定。将含有 miR-744-5p 结合序列的LncRNA MNX1-AS1 插入pLVX-IRESPuro 载体获得野生型质粒MNX1-AS1 WT。LncRNA MNX1-AS1 与miR-744-5p结合的序列被突变并插入pLVX-IRESPuro 载体获得突变型质粒MNX1-AS1 Mut。取对数期生长的喉癌细胞Hep-2 接种于24 孔板中(2.5×105个/孔),培养24 h后,弃培养基。采用Lipofectamine TM 2000 转染1 g 荧光素酶报告载体,将MNX1-AS1 WT 与miR-744-5p mimic或 NC mimic、MNX1-AS1 Mut 与miR-744-5p mimics 或 NC mimic+MNX1-AS1 Mut 分别共转染喉癌细胞Hep-2 中。转染12 h 后,更换新鲜的培养基。再培养24 h 后,裂解细胞,离心(3 500 r/min、5 min)后,取上清液检测荧光素酶活性。
1.2.11 蛋白免疫印迹实验 取NCmimics 组和miR-744-5p 组细胞,加入RIPA裂解液提取细胞总蛋白,BCA法蛋白浓度测定蛋白浓度。沸水浴中煮沸10min,电泳后转膜,用5%脱脂牛奶室温封闭1h。加入一抗SH3BGRL3(1∶5 000),4 ℃孵育过夜。次日PBS 洗涤3 次,然后加入相应二抗(1∶1000),室温孵育1h,PBS洗涤3次,发光液进行显色,选择内参GAPDH。
1.3 统计方法 采用SPSS 22.0 统计软件进行分析。计量资料以均数±标准差表示,多组比较采用单因素方差分析,两组比较采用t 检验;计数资料采用2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 LncRNA MNX1-AS1、miR-744-5p、SH3BGRL3在喉癌组织中表达水平及细胞转染效率 与sh NC 组相比,MNX1-AS1组MNX1-AS1mRNA水平降低(P<0.05);与NC mimics 组相比,miR-744-5pmimics 组miR-744-5p mRNA 水平升高(P <0.05);与NC inhibitor 组相比,miR-744-5p inhibitor 组miR-744-5p mRNA 水平降低(P <0.05);与shNC组相比,shSH3BGRL3 组SH3BGRL3 mRNA 水平降低(P <0.05)。见图1。

图1 LncRNA MNX1-AS1、miR-744-5p、SH3BGRL3 在喉癌细胞中表达水平
2.2 敲低MNX1-AS1 表达对喉癌细胞生长的影响 细胞培养至48 h 后,sh-NC 组细胞吸光值明显高于sh MNX1-AS1 组(P <0.05)。见表2。
表2 敲低MNX1-AS1 表达对细胞生长的影响(=3)

表2 敲低MNX1-AS1 表达对细胞生长的影响(=3)
2.3 miR-744-5p 过表达对细胞生长的影响 细胞培养至48 h 后,NC mimics组细胞吸光值明显高于 miR-744-5p mimics 组(P <0.05)。见表3。
表3 过表达miR-744-5p 对细胞生长的影响(=3)

表3 过表达miR-744-5p 对细胞生长的影响(=3)
2.4 敲低MNX1-AS1 表达对喉癌细胞迁移能力的影响 与sh NC 组相比,sh MNX1-AS1 组细胞迁移数量明显减少(P <0.05)。见封二彩图7。
2.5 miR-744-5p 过表达对喉癌细胞迁移能力影响 与NC mimics 组相比,miR-744-5p mimics 组细胞迁移数量明显减少(P <0.05)。见封二彩图8。

图8 过表达miR-744-5p 对喉癌细胞迁移能力的影响
2.6 LncRNA MNX1-AS1与miR-744-5p靶向调节关系 生物信息学显示miR-744-5p 具有LncRNA MNX1-AS1潜在结合序列。与NC mimic 和MNX1-AS1 WT 共转染组相比,miR-744-5p mimic 和MNX1-AS1 WT 共转染组细胞荧光素酶活性降低(P <0.05)。同时,MNX1-AS1Mut转染细胞的荧光素酶活性无变化(P >0.05)。sh-MNX1-AS1 组细胞中miR-744-5p 的表达比sh-NC 细胞中表达增加(P <0.05)。与NCmimics 组相比,miR-744-5p mimics 组中SH3BGRL3 蛋白表达水平明显降低(P <0.05)。见图2。
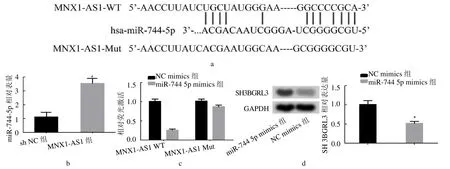
图2 LncRNA MNX1-AS1 与miR-744-5p 靶向调节关系
2.7 MNX1-AS1/miR-744-5p/SH3BGRL3轴对喉癌细胞生长的影响 细胞培养至72h后,与NCinhibitor组相比,miR-744-5p inhibitor 组细胞吸光度高于miR-744-5p inhibitor 组(P <0.05);miR-744-5p inhibitor+sh SH3BGRL3 组吸光度低于miR-744-5p inhibitor 组,但高于NC inhibitor 组(P <0.05)。见表4。
表4 MNX1-AS1/miR-744-5p/SH3BGRL3 轴在喉癌细胞中的作用(=3)

表4 MNX1-AS1/miR-744-5p/SH3BGRL3 轴在喉癌细胞中的作用(=3)
2.8 MNX1-AS1/miR-744-5p/SH3BGRL3轴对喉癌细胞迁移的影响 与NC inhibitor组相比,miR-744-5p inhibitor组迁移细胞数量增加(P <0.05);miR-744-5p inhibitor+shSH3BGRL3组迁移细胞数量少于miR-744-5pinhibitor 组,多于NC inhibi tor 组(P <0.05)。见封三彩图1。

图1 MNX1-AS1/miR-744-5p/SH3BGRL3 轴对喉癌细胞迁移的影响(*<0.05,#<0.05)
3 讨论
喉癌是临床常见的头颈部肿瘤,临床主张采用手术和保守治疗方案治疗喉癌患者[9]。在过去的几十年里,随着环境污染的加重、人口老龄化的趋势,喉癌的发病及死亡状况不容乐观[10]。因此,寻找特异、有效的喉癌肿瘤标志物已成为喉癌研究的热点之一。近年来,越来越多的研究表明,lncRNA异常表达在肿瘤的研究中取得了较大进展,其具有成为诊断和治疗肿瘤的标志物的潜质[11-12]。
本研究结果表明细胞转染成功且稳定。MNX1-AS1 是运动神经元和胰腺同源框蛋白1 及基因的反义RNA,已被多项研究证明是多种人类恶性肿瘤的致癌基因[13]。例如过表达MNX1-AS1 促进体外肝内胆管癌细胞的增殖、迁移和侵袭[14]。有研究表明,MNX1-AS1 在宫颈癌和肺癌组织以及细胞系中均明显表达上调[15-16],这与本研究结果基本一致。此外,本研究通过一系列体外细胞功能试验结果发现,敲低MNX1-AS1 表达抑制喉癌细胞生长和迁移能力。LncRNA 可以通过表观遗传水平、转录及转录后水平调控基因表达,是近年来研究非编码RNA 的热点,特定lncRNA 表达的改变与喉癌的发生发展密切相关[17-18]。既往研究显示,敲低MNX1-AS1 表达抑制卵巢癌细胞增殖和迁移[19],与本研究结果相似,说明MNX1-AS1 在喉癌中发挥致癌作用。
此外,lncRNA在位于细胞质中时通常作为与miRNA结合的ceRNA而发挥作用,调节多个靶基因的表达[20]。本研究发现过表达miR-744-5p 可以抑制喉癌细胞增殖和迁移能力。越来越多的研究表明,miRNA在喉癌中表达上调或下调,发挥促癌或者抗癌作用。既往研究显示,过表达miR-744-5p 可以抑制膀胱癌细胞增殖、迁移和侵袭,而抑制miR-744-5p 则起相反的作用[21]。结合本研究结果表明,miR-744-5p 在喉癌细胞中低表达,并且发挥癌基因作用,过表达miR-744-5p可以阻止喉癌Hep-2 细胞生长和迁移的能力。同时,本研究探索了靶向MNX1-AS1 的miRNA发现miR-744-5p 是具有潜在结合序列的预测miRNA。随后,本研究通过荧光素酶报告基因测定证实了miR-744-5p 靶标与MNX1-AS1 结合。另外,研究发现敲低MNX1-AS1 表达可以上调miR-744-5p 在Hep-2 细胞中的表达,而过表达miR-744-5p 可以下调SH3BGRL3蛋白在Hep-2 细胞中表达。SH3BGRL3是硫氧还蛋白超基因家族的成员,被称为肿瘤坏死因子抑制蛋白[22]。本研究结果显示,与NC inhibitor 组相比,miR-744-5p inhibitor 组细胞吸光度值、迁移细胞数量高于miR-744-5pinhibitor 组;miR-744-5pinhibitor+shSH3BGRL3 组吸光度值、迁移细胞数量低于miR-744-5pinhibitor组,但高于NCinhibitor组。这些研究结果证明MNX1-AS1 敲低的作用可以通过miR-744-5p 的下调来逆转,而SH3BGRL3的敲低则消除了这种可逆作用。MNX1-AS1 可能通过miR-744-5p/SH3BGRL3 轴促进喉癌的发展过程,MNX1-AS1 可能成为治疗喉癌的潜在靶点。

