舞毒蛾气味结合蛋白基因克隆及对CO2胁迫的响应
王建国 孙丽丽 李欣悦 苑 冉 曹传旺,2
(1. 东北林业大学林学院,黑龙江 哈尔滨 150040;2. 东北林业大学森林生态系统可持续经营教育部重点实验室,黑龙江 哈尔滨 150040)
全球气候变暖已经引起世界范围内的关注,据IPCC报道CO2浓度在2005年已达到397 μL/L,并预测在21世纪中叶将达到550 μL/L左右,21世纪末将达到800 μL/L左右[1]。随着全球气候变暖,大气CO2浓度不断升高会直接或间接影响森林生态系统,昆虫作为森林生态系统中的重要组成,同样也会受到CO2浓度变化带来的影响[2]。高浓度CO2下的棉铃虫(Helicoverpa armigera)幼虫发育迟缓,幼虫质量下降,取食量和排粪量增加[3]。与正常大气环境相比,高浓度CO2下草地贪夜蛾(Spodoptera frugiperda)各虫态发育历期显著延长,且蛹质量显著大于低浓度CO2[4]。高浓度CO2下饲养的棉蚜(Aphis gossypii)对植物挥发物的响应更强,对棉苗的趋向性增强,同时气味结合蛋白(OBP)基因(OBP2和OBP7)和化学感受蛋白基因(CSP4和CSP6)的相对表达量增加[5]。气味结合蛋白是一类小分子球状蛋白,通常由135~220个氨基酸组成,含有2~3个二硫键[6]。昆虫通过气味结合蛋白对外界气味分子进行特异性识别[7]。气味结合蛋白与挥发性物质结合,并将其运输至昆虫触角感觉神经元末梢上的受体,将化学信号转化为电信号,从而实现气味从触角表皮到气味受体之间的传递[8]。基于OBP基因在嗅觉系统中的重要作用,越来越多的昆虫OBP基因被鉴定,如苹果蠹蛾(Cydia pomonella)[9]、桔小实蝇(Bactrocera dorsalis)[10]、黑腹果蝇(Drosophila melanogaster)[11]和棉铃虫(Helicoverpa armigera)[12]。其中黑腹果蝇基因组中鉴定了60条OBPs[11],棉铃虫转录组中鉴定了26条OBPs[12]。
舞毒蛾是一种世界性林业食叶害虫,国内外报道舞毒蛾能够危害500多种寄主植物[13],给我国农林业造成了巨大损失。随着全球气候变暖,高浓度CO2对昆虫的嗅觉行为具有显著影响,OBPs是昆虫重要的嗅觉基因,而舞毒蛾OBPs的鉴定及其对CO2浓度胁迫响应报道甚少。因此,本研究在分析舞毒蛾转录组文库的基础上克隆获得了LdOBP1和LdOBP2基因,进行基因序列分析,并利用实时荧光定量RT−PCR技术分析LdOBP1和LdOBP2对CO2浓度变化的响应,为探讨高浓度CO2下舞毒蛾适应性机制提供理论基础。
1 材料与方法
1.1 供试昆虫与处理
舞毒蛾卵和人工饲料均购于中国林业科学研究院森林生态环境与保护研究所,卵在10 %甲醛溶液中浸泡1 h,用清水反复冲洗干净后放入光周期14L∶10D、温度(25 ± 1)℃、湿度(70 ± 5)%的CO2人工气候培养箱中孵化,实验组CO2浓度分别设置为550 μL/L和750 μL/L,对照组为正常大气CO2浓度(397 μL/L),舞毒蛾卵至成虫放置于不同CO2浓度下饲养,舞毒蛾1~3龄,每养虫盒每龄放置30头幼虫,4龄以后每养虫盒放置10头幼虫,人工饲料切成小块饲喂,每天更换养虫盒及新鲜饲料。
1.2 LdOBP基因克隆与分析
采用RNeasy Mini动物组织总RNA提取试剂盒,提取各龄期舞毒蛾总RNA,提取的样品由深圳华大基因科技有限公司进行转录组文库构建及测序。对获得的Unigenes进行Blastx和Blastn分析,根据功能注释结果选择具有完整ORF的OBP基因,设计引物进行RT−PCR验证,测序验证获得2个OBP基因序列。利用表1中软件及程序对LdOBP1和LdOBP2进行生物信息学分析。利用Blast (http://www.ncbi. nlm.nih.gov/BLAST/)程序进行序列同源性搜索,选择与其相似度高的不同昆虫的OBP蛋白氨基酸序列,利用ClustalW进行多序列比对。利用Clustalx (1.83)和MEGA5.1构建系统发育树。

表1 舞毒蛾LdOBP1和LdOBP2基因特性分析生物信息学软件Table 1 Bioinformatics software for gene characterization analysis of LdOBP1 and LdOBP2 in L. dispar
1.3 实时荧光定量RT-PCR
解剖舞毒蛾3龄幼虫第1天头、表皮和中肠,触角、头、胸、腹、足取自羽化第1天舞毒蛾成虫,上述样品均取自3头以上舞毒蛾,液氮冻存后提取RNA。用DNaseI(Promega)消化总RNA中的DNA,测定其质量浓度,按照PimeScriptTMRT reagent Kit(Takara)合成cDNA。反应条件:42 ℃60 min,8 ℃ 5 s,16 ℃ 10 min。将cDNA稀释10倍备用。引物采用Primer 5.0软件进行设计,内参基因(Actin、TUB和EF1α),LdOBP1和LdOBP2基因的引物序列见表2,由生工生物工程(上海)股份有限公司合成。按照SYBR Green Real-time PCR Master mix荧光定量PCR试剂盒(Toyobo)在CFX96 Real−Time PCR Detection System(Bio−Rad)检测LdOBP1和LdOBP2基因的表达量。反应体系为:2 × SYBR premix ExTaq酶10 μL,上、下游引物(10 μmol/L)各1 μL,稀释后的cDNA 2 μL,去离子水补足至20 μL。反应条件:94 ℃ 30 s,94 ℃ 12 s,58 ℃ 45 s,72 ℃40 s,81 ℃ 1 s,循环数为45,用2−ΔΔCT方法进行基因相对表达水平分析[14]。每个样品重复3次。对3个内参进行几何平均以标准化数据,用内参基因的CT值归一化目的基因的CT值:ΔCT=CT(目的基因)− CT(内参基因),再用对照样品的ΔCT值归一化待测样品的ΔCT值:ΔΔCT= ΔCT(待测样品)−ΔCT(对照样品),用2−ΔΔCT计算基因相对表达量。

表2 本文所用引物序列Table 2 Primer sequences used in this study
1.4 数据统计和分析
采用Excel 2007计算表达量数据,运用SPSS 17.0(SPSS Inc, USA)统计软件进行ANOVA分析,使用Origin Pro 8.5软件进行数据统计和绘图。
2 结果与分析
2.1 LdOBP基因克隆与序列分析
通过舞毒蛾转录组分析和RT−PCR验证获得2个舞毒蛾OBP家族全长基因,LdOBP1和LdOBP2基因开放阅读框(ORF)大小分别为450 bp和417 bp,编码149个和138个氨基酸。ProtParam预测编码LdOBP1和LdOBP2蛋白的分子量分别为19.41和15.35 kDa,理论等电点分别为11.17和6.73,LdOBP1为碱性蛋白,LdOBP2为酸性蛋白。BlASTP对2个蛋白保守区预测表明,LdOBP1和LdOBP2蛋白属于气味结合蛋白家族。运用TMH MM2.0 Server分析舞毒蛾LdOBP1和LdOBP2基因的跨膜区域,并未发现跨膜区域。舞毒蛾LdOBP1基因未发现信号肽序列,而LdOBP2基因含有信号肽序列,位置在1−22。
2.2 LdOBP进化树分析
通过BLASTP进行序列同源性搜索,选择与舞毒蛾OBP序列相似程度高的11种昆虫的26个OBP蛋白进行多序列比对和进化树分析(图1和图2)。多序列比对结果显示,LdOBP1具有6个保守的Cys残基(C),符合Classic家族特征,LdOBP2具有4个保守的Cys残基(C),缺失第2、5位的Cys残基,符合Minus−C家族特征。进化树分析结果表明:11种昆虫的OBP蛋白分为2类,其中舞毒蛾LdOBP1与桃小食心虫(Carposina sasakii)AYD42195.1亲缘关系近而聚为一支,舞毒蛾LdOBP2与桃小食心虫AYD42180.1亲缘关系近而聚为另一支。

图1 舞毒蛾气味结合蛋白的分子进化树Fig. 1 The phylogenetic tree of OBPs in L. dispar

图2 舞毒蛾LdOBP和其他昆虫OBPs氨基酸序列比对Fig. 2 Alignment of amino acid sequences of LdOBP in L. dispar and OBPs in other insects
2.3 CO2浓度对LdOBPs组织特异性表达的影响
为了进一步明确CO2浓度变化对LdOBPs基因表达水平的影响,采用qRT−PCR技术测定CO2浓 度 分 别 为397 μL/L(大 气 浓 度)、550 μL/L和750 μL/L时,舞毒蛾3龄幼虫和雌、雄成虫各组织OBPs基因表达量(图3~5)。LdOBP1和LdOBP2基因均在幼虫头部表达水平最高。高浓度CO2胁迫下,LdOBP1基因表达量显著下降,而幼虫头部和中肠LdOBP2基因在高浓度CO2胁迫下表达水平呈现上升趋势。在550 μL/L和750 μL/L CO2浓度胁迫下,幼虫头部LdOBP1基因表达量分别比对照组下降了32.70%和42.33%,在表皮中表达量分别比对照组下降了50.95%和62.17%,在幼虫中肠LdOBP1表达量比对照组分别降低了16.22%和16.35%。LdOBP2基因在550 μL/LCO2浓度胁迫下幼虫头部和表皮表达量均有所下降,分别为对照组的82.13%和74.09%;CO2浓度为750 μL/L时表皮中LdOBP2基因相对表达量呈下降趋势,比对照组降低了66.15%,而头部表达水平显著上升,其表达量为对照组的1.36倍。LdOBP2基因在中肠的表达水平随CO2浓度的升高呈上升趋势,550 μL/L和750 μL/L CO2浓度处理组表达水平分别增加了30.31 %和23.59 %(图3)。LdOBP1和LdOBP2基因在雌、雄成虫触角表达水平显著高于其他组织。随着CO2浓度升高,LdOBP1和LdOBP2基因表达水平显著下调。550 μL/L和750 μL/L CO2浓度下,LdOBP1基因在雌成虫触角的表达量分别比对照组下降54.18%和61.14%,LdOBP2基因在雌成虫触角的表达量分别比对照组下降43.65%和52.79%;LdOBP1基因在雄成虫触角的表达量分别比对照组下降21.25%和59.32%,LdOBP2基因在雄成虫触角的表达量分别比对照组下降55.99%和57.33%。不同CO2浓度下雌、雄成虫其他组织LdOBPs基因表达量无显著性差异(图4和图5)。
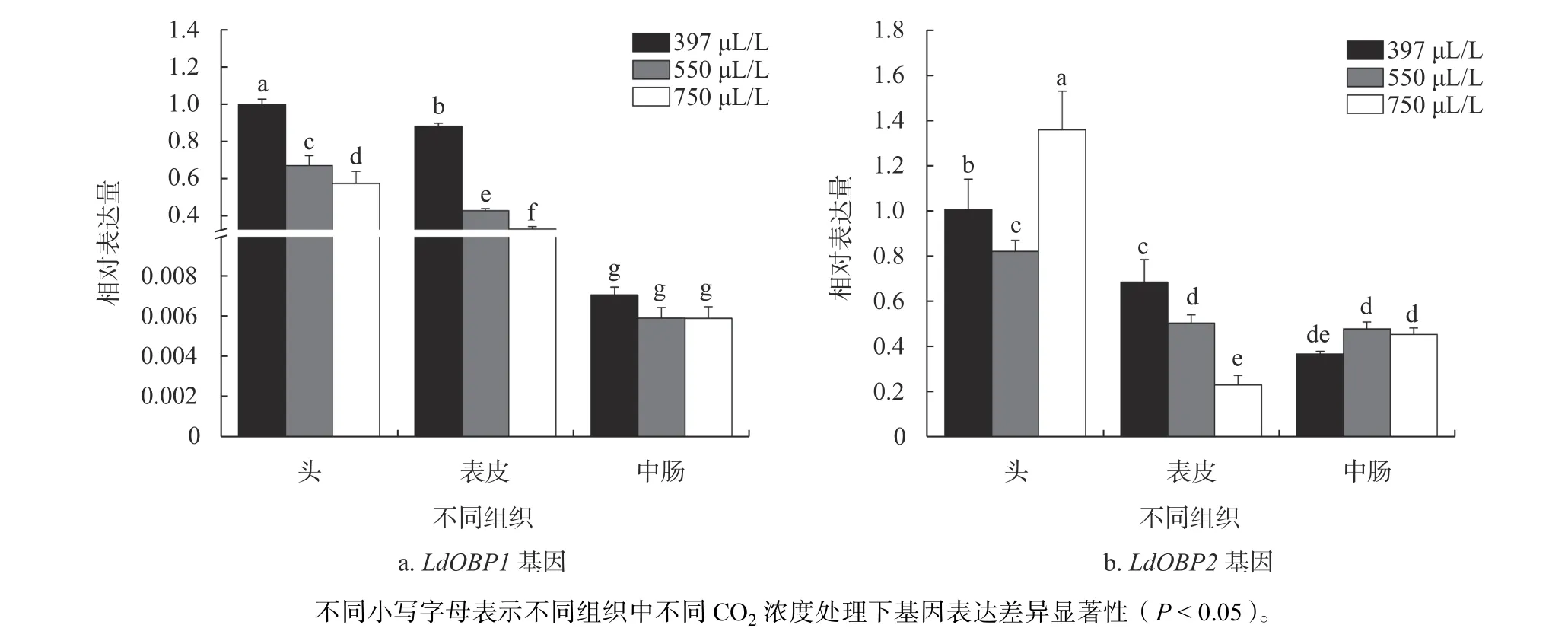
图3 不同CO2浓度下舞毒蛾幼虫组织LdOBP1和LdOBP2基因表达量Fig. 3 Gene expressions of LdOBP1 and LdOBP2 in different tissues of L. dispar larvae under different CO2 concentrations
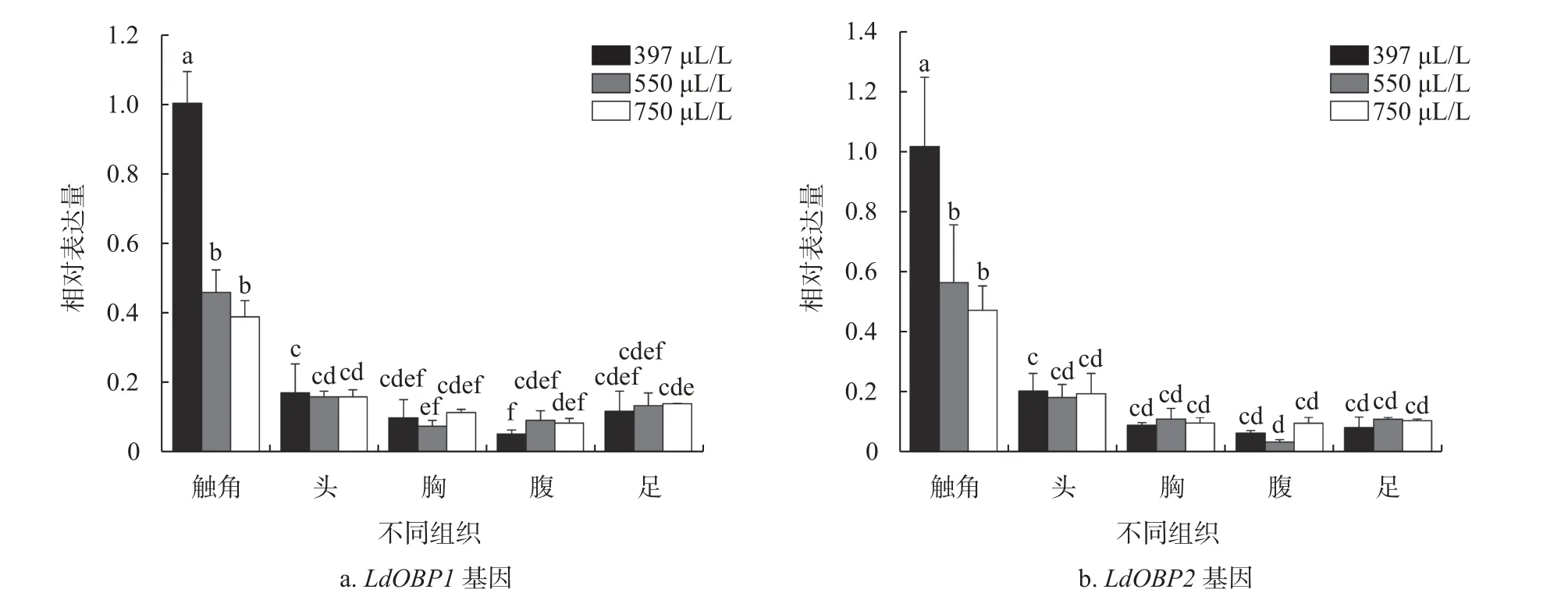
图4 不同CO2浓度下舞毒蛾雌成虫各组织LdOBP1和LdOBP2基因表达量Fig. 4 Expression levels of LdOBP1 and LdOBP2 in different tissues of female L. dispar adults under different CO2 concentrations
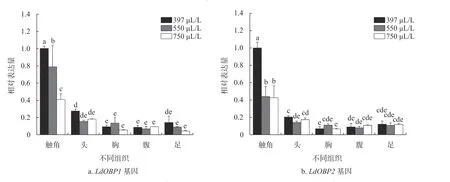
图5 不同CO2浓度下舞毒蛾雄成虫各组织LdOBP1和LdOBP2基因表达量Fig. 5 Expression levels of LdOBP1 and LdOBP2 in different tissues of male L. dispar adults under different CO2 concentrations
3 结论与讨论
近年来,舞毒蛾虫害的大面积暴发,给我国农林业造成巨大损失。目前,舞毒蛾研究主要集中在生物学特性及外源次生物质对其生长发育和生化酶的影响[15−16],而有关舞毒蛾气味结合蛋白及其嗅觉分子机制研究鲜有报道。气味结合蛋白的特异性表达影响昆虫一系列的生命活动[17]。目前已在多种昆虫中鉴定出了OBP基因,如意大利蜜蜂(Apis mellifera)[18]、中华按蚊(Anopheles sinensis)[19]、斜纹夜蛾(Spodoptera litura)[20]、中红侧沟茧蜂(Microplitis mediator)[21]等。随着研究的深入,OBP基因的功能逐渐得到验证,一般来说其功能主要为以下几类:1)当气味分子进入淋巴液后,OBP能特异性的识别气味分子[22]。2)由于气味分子多为脂溶性,OBP可以作为气味分子的溶剂,与气味分子结合形成水溶性复合体,并将其运送至神经元膜[23]。3)能够对气味分子起到保护作用,使其免于被气味降解酶降解[24]。本研究克隆获得2个舞毒蛾OBP家族全长基因,多序列比对结果显示LdOBP1和LdOBP2分别属于Classic和Minus−C家族。进化树分析结果表明舞毒蛾LdOBP1与桃小食心虫AYD42195.1聚为一支,LdOBP2与桃小食心虫AYD42180.1聚为另一支,表明其亲缘关系较近,可能具有相似的功能。
全球气候变暖对昆虫的影响引起国内外广泛关注[1]。CO2浓度变化引起昆虫的生长发育等生理变化机制成为研究热点。如高浓度CO2(800 μL/L)下粘虫(Mythimna separata)雌成虫寿命显著缩短,且产卵量显著下降[25]。舞毒蛾2龄幼虫取食高浓度CO2培育下的小青杨(Populus pseudosimonii)体重显著低于取食大气CO2浓度培育下的小青杨幼虫体重[26]。闫丽琼等报道高浓度CO2显著抑制舞毒蛾幼虫LdJHBP基因的表达[27]。但关于CO2浓度变化对昆虫嗅觉系统影响的研究较少,相关研究主要集中在嗅觉相关基因的表达与寄主选择行为机制。研究报道CO2浓度升高的条件下,棉蚜OBP基因表达量增加,对植物挥发物的选择能力增强[5]。在高浓度CO2下,埃及伊蚊(Aedes aegypti)嗅觉受体神经元受到抑制,导致其寻找宿主的行为能力受阻[28]。本实验研究高浓度CO2胁迫下舞毒蛾LdOBP1和LdOBP2基因的表达情况,研究结果显示舞毒蛾LdOBP1和LdOBP2基因均在幼虫头部表达水平最高。LdOBP2基因表达水平在高浓度CO2下头部和中肠表现出不同程度的促进。这一结果与CO2浓度变化下棉蚜OBP2和OBP7基因表达模式类似[5]。而高浓度CO2下显著抑制了舞毒蛾各组织LdOBP1基因表达,但2个基因表达模式不同,这可能由于两者功能存在差异。不同CO2浓度下舞毒蛾LdOBP1和LdOBP2基因均在成虫触角表达水平最高,头部次之,其余组织表达量较少,这表明舞毒蛾LdOBP1和LdOBP2基因主要在舞毒蛾触角中发挥作用。该结果也与多数昆虫的表达模式类似,如杨小舟蛾(Micromelalopha troglodyta)的组织特异性表明MtroOBP1在成虫各组织均有表达,其在触角中的表达量最高[29]。中华蜜蜂(Apis cerana)的组织表达谱显示AccOBP3基因在足部和触角中表达水平较高,头部和腹部表达量较低[30]。同时本研究发现高浓度CO2胁迫下显著抑制了舞毒蛾触角中LdOBP1和LdOBP2基因表达。这些结果表明高浓度CO2影响舞毒蛾不同组织中LdOBPs基因的表达。
本实验成功克隆了舞毒蛾LdOBP1和LdOBP2基因,qRT−PCR结果表明LdOBP1和LdOBP2基因在舞毒蛾各个组织中均有表达,其中在头部和触角中显著高表达,高CO2浓度胁迫下,显著抑制了LdOBP1和LdOBP2基因表达。综上所述,舞毒蛾LdOBP1和LdOBP2基因表达变化可能会影响舞毒蛾的嗅觉信号传导,进而影响舞毒蛾的取食、种间交流、寄主选择等行为,并以此来响应CO2浓度变化,但具体的功能与行为学反应有待进一步研究,本实验结果将为后续研究OBP1和OBP2蛋白的生理功能提供基础,并有助于阐明舞毒蛾对气候变化时的适应机制。

